污泥無機濕法資源化回收銅鎳的研究
曾斌龍
(廈門暉鴻環境資源科技有限公司,福建 廈門 361000)
目前《國家危險廢物名錄》(2021年版)自2021年1月1日實施,該《名錄》增加了更多的利用豁免環節,促進了危險廢物的利用。電鍍污泥因含大量的金屬離子,對土壤及水環境潛在污染風險巨大,被收錄于《國家版危險廢物名錄》,類別HW17。但因其常富集有銅、鎳等金屬離子,資源化利用可行性高。目前國內無機濕法資源化多采用酸溶+除雜+分步碳酸化合物法工藝制取碳酸銅、碳酸鎳,但存在資源化的電鍍污泥品質要求單一,只適用于單項提取銅、鎳,當電鍍污泥中銅、鎳含量均較高時,存在分離不徹底,產品純度低等問題。因此,研究一套可行的無機濕法資源回收工藝顯得尤為重要。
1 酸溶浸取部分
在污泥的濕法資源化回收銅、鎳離子工藝中,有效地浸取所需的有價金屬是非常關鍵的步驟,直接影響到產品的數量。Silva J E等[1]的研究顯示,采用硫酸浸取金屬所需時間基本上在1 h內可以完成,在所有的硫酸浸出測試中采用(100 g/L)的測試可在最經濟的條件下最有效地獲得所需的有價金屬。酸浸法的主要特點是對銅、鋅、鎳等有價金屬的浸取效果較好,對雜質的選擇性較低,特別是對鉻、鐵等雜質的選擇性較差[2]。Veglib等[3]的研究顯示,硫酸對銅、鎳的浸出率可達95%~100%。
因此針對污泥中銅、鎳金屬的資源化,采用硫酸-酸溶浸取方法是一種較好的選擇。考慮到泵對含固流體的輸送能力問題,工藝上可采用的100 g/L硫酸,液固比10∶1(L∶kg),進行酸溶浸取,同時,為避免電鍍污泥中堿性物質含量過高,影響酸溶浸取效果,其過程控制pH值不高于0。
2 濕法工藝除雜控制理論分析
硫酸-酸溶步驟可分離出不溶物濾餅(砂石、泥漿等),但其浸取液中除存在銅、鎳資源化金屬離子外,仍富集了大量的鐵(Ⅲ)、鉻(Ⅲ)、鋅等雜質金屬離子,該部分雜質金屬離子將直接影響銅、鎳資源化產品純度及質量。
因此,浸取液的除雜顯得尤為重要,一方面要求盡可能的去除浸取液中存在的鐵(Ⅲ)、鉻(Ⅲ)等雜質金屬離子,另一方面應盡可能的避免因除雜導致的銅、鎳等資源化離子的損耗;根據溶度積理論,在浸取液中要實現資源化金屬離子與雜質金屬離子較理想的分離,除離子濃度影響外,兩者化合物的溶度積差值應盡可能大,避免因共沉淀致使資源化金屬離子的損失;
一般情況下,經酸溶后的浸取液中的重金屬離子主要以鐵、鉻、鋅、銅、鎳及鈣的離子為主,其常見的無機化合物溶度積常數詳見表1[4],相關的弱酸電離常數詳見表2[4]。
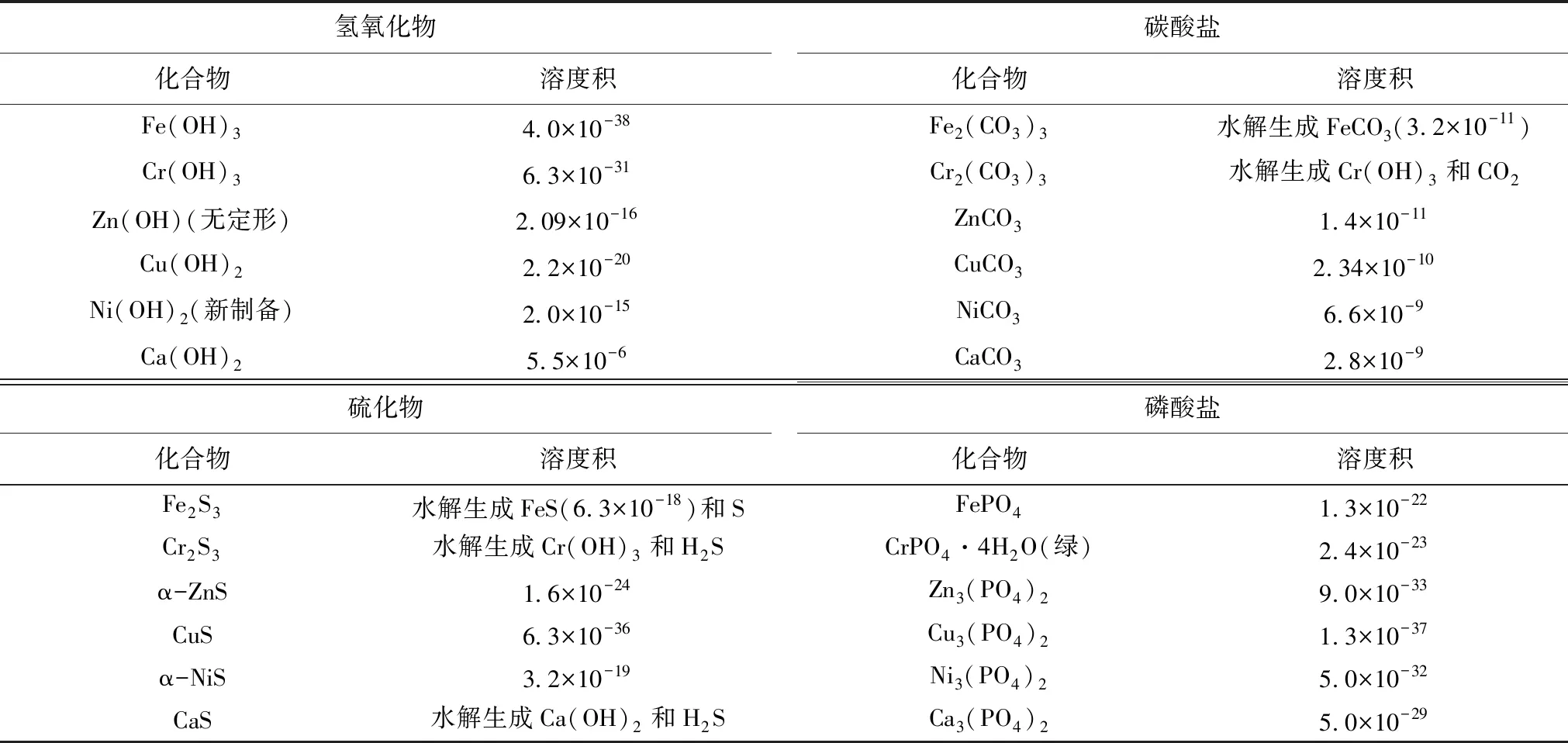
表1 鉻、鐵、鎳、銅、鋅無機化合物溶度積表

表2 相關弱酸電離常數表
在浸取液中,當某種金屬離子濃度低于10-5mol/L時,可認為該種金屬離子已完全沉淀,根據溶度積及電離平衡理論及表1、表2數據,采用不同方式除雜的控制終點pH值計算如下。
2.1 氫氧化法方式除雜理論分析
以鐵(Ⅲ)離子除雜過程為例,涉及的化學方程式如下:
Fe3++3OH-=Fe(OH)3↓
其理論除雜控制終點pH值計算為:
Ksp,Fe(OH)3=c(Fe3+×c3(OH-)?c(OH-)=
298 K條件下,水的電離常數[8]:
KaH2O=1.0×10-14
c(H+)=Ka(H2O)/c(OH-)=6.29×10-4mol/L
? pHFe(OH)3,(除雜)值=3.20
同理可得:
pHCr(OH)3,(除雜)值=5.60
pHCa(OH)2,(除雜)值=13.87
pHZn(OH)2,(除雜)值=8.66
2.2 硫化法方式除雜理論分析
因硫化鈣、硫化鉻均水解生成相應的氫氧化合物,故其理論除雜控制終點pH值可基本按相應的氫氧化合物的控制終點計。而酸性條件下,硫化鐵水解生成硫化亞鐵,故其除雜控制終點pH值按硫化亞鐵計。
其中以鋅離子除雜過程為例,涉及的化學方程式如下:
Zn2++S2-=ZnS↓
H2S=H++HS-
HS-=H++S2-
? Zn2++H2S=ZnS↓+2H+
故其總化學反應平衡常數可寫為:
其理論除雜控制終點pH值如下:
K=c2(H+)/c(Zn2+)
?pHZnS,(除雜)值=1.12
同理可得:pHFeS,(除雜)值=4.42
2.3 碳酸化法方式除雜理論分析
因碳酸鐵、碳酸鉻均水解生成相應的氫氧化合物,故其理論除雜控制終點pH值可基本按相應的氫氧化合物的控制終點計。而碳酸鋅及碳酸鈣法除雜控制終點pH值計算過程與硫化法除雜控制終點pH值計算過程類似,故可得:
pHZnCO3,(除雜)值=5.38
pHCaCO3,(除雜)值=6.54
2.4 磷酸化法方式除雜理論分析
同樣,以鋅離子除雜過程為例,涉及的化學方程式如下:
3Zn2++2PO42-=Zn3(PO4)2↓
H3PO4=H++H2PO4-
H2PO4-=H++HPO42-
HPO42-=H++ PO43-
? 3Zn2++2H3PO4=Zn3(PO4)2↓+6H+
故其總的化學平衡常數分別為:
其理論除雜控制終點pH值如下:
? pHZn3(PO4)2,(除雜)值=4.38
同理可得:
pHCa3(PO4)2,(除雜)值=5.01
pHCr(PO4)2,(除雜)值=4.69
3 銅、鎳離子分步提取理論分析
硫酸-酸溶的浸取液中,鎳、銅的存在形態基本以硫酸鎳、硫酸銅的電解離子存在,根據硫酸鎳、硫酸銅的溶解度曲線,在293 K下,硫酸鎳的飽和溶解度約為370 g/L即c(Ni2+)=2.39 mol/L,硫酸銅的飽和溶解度為207 g/L即c(Cu2+)=1.29 mol/L[6]。
3.1 氫氧化法分步提取理論分析
采用氫氧化法分步提取銅、鎳離子過程,涉及的化學方程式如下:
Cu2++2OH-=Cu(OH)2↓
Ni2++2OH-=Ni(OH)2↓
參照本文第2.1章節計算過程,其理論完全沉淀pH值為:
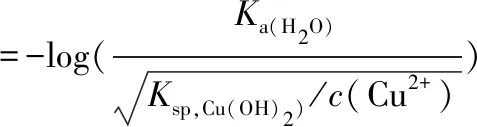
? pHCu(OH)2,(完全沉淀)值=6.67
同理,pHNi(OH)2,(完全沉淀)值=9.15
同理,浸取液中銅、鎳離子濃度飽和時,其理論開始沉淀pH值為:
pHCu(OH)2,(飽和,開始沉淀)值=4.11
pHNi(OH)2,(飽和,開始沉淀)值=6.46
3.2 硫化法分步提取理論分析
采用硫化法分步提取銅、鎳離子過程,其總化學方程可寫為:
Cu2++H2S=CuS↓+2 H+
Ni2++H2S=NiS↓+2 H+
參照本文第2.2章節計算過程,其理論完全沉淀pH值為:

? pHCuS,(完全沉淀)值=-4.58
同理,pHNiS,(完全沉淀)值=3.77
同理,浸取液中銅、鎳離子濃度飽和時,其理論開始沉淀pH值為:
pHCuS,(飽和,開始沉淀)值=-7.14
pHNiS,(飽和,開始沉淀)值=1.08
3.3 碳酸化合法分步提取理論分析
采用碳酸化合法分步提取銅、鎳離子過程,其總化學方程可寫為:
Cu2++ H2CO3=Cu CO3↓+2 H+
Ni2++ H2CO3=Ni CO3↓+2 H+
參照本文第2.3章節計算過程,其理論完全沉淀pH值為:
pHCuCO3(完全沉淀)值
? pHCuCO3,(完全沉淀)值=6.00
同理,pHNiCO3,(完全沉淀)值=6.72
同理,浸取液中銅、鎳離子濃度飽和時,其理論開始沉淀pH值為:
pHCuCO3,(飽和,開始沉淀)值=3.44
pHNiCO3,(飽和,開始沉淀)值=4.03
3.4 磷酸化合法分步提取理論分析
采用磷酸化合法分步提取銅、鎳離子過程,其總化學方程可寫為:
3Cu2++2H3PO4=Cu3(PO4)2↓+6H+
3Ni2++2H3PO4=Ni3(PO4)2↓+6H+
參照本文第2.4章節計算過程,其理論完全沉淀pH值為:
pHCu3(PO4)2(完全沉淀)=-log
? pHCu3(PO4)2,(完全沉淀)值=3.58
同理,pHNi3(PO4)2,(完全沉淀)值=4.51
同理,浸取液中銅、鎳離子濃度飽和時,其理論開始沉淀pH值為:
pHCu3(PO4)2,(飽和,開始沉淀)值=1.06
pHNi3(PO4)2,(飽和,開始沉淀)值=1.95
3.5 鐵粉置換法分步提取理論分析
在298 K、標準狀態下,各電極反應方程式、標準電極電勢及電極能斯特方程詳見表3[5]。

表3 298 K、標準狀態下標準電極電勢及電極能斯特方程
根據表3可得,浸取液中,鐵粉置換銅、鎳離子的置換反應方程式、標準反應電動勢、反應能斯特方程,具體詳見表4。

表4 298K、標準狀態下標準反應電動勢及反應能斯特方程
由表4可知,其標準反應電動勢E1>E3>E2,一般情況下,往酸性浸取液中添加鐵粉,其反應優先級(1)>(3)>(2),根據反應能斯特方程,隨著反應離子和產物離子的濃度比不斷降低,其反應電動勢隨之降低,反應趨勢亦逐漸減小,直至反應達到平衡。
當酸性浸取液中銅離子置換完全即c(Cu2+)=10-5mol/L時,聯立式(1)、(3)可得:

?c(H+)=1 710.44 mol/L
? pHCu(置換完全)值=-3.23
同理,當酸性浸取液中鎳離子置換完全時,聯立式(2)~(3)可得:
?c(H+)=3.22×10-7mol/L
? pHNi(置換完全)值=6.49
當酸性浸取液中銅離子濃度飽和即c(Cu2+)=1.29 mol/L時,聯立式(1)、(3)可得:
c(H+)=6.14×105mol/L? pHCu(飽和,開始置換)值=-5.79
當酸性浸取液中鎳離子濃度飽和即c(Ni2+)=2.39 mol/L時,聯立式(2)~(3)可得:
c(H+)=1.58×10-4mol/L? pHNi(飽和,開始置換)值=3.80
4 工藝設計方案選擇分析
無機濕法資源化回收工藝設計方案基本工藝組合框架一般為:資源化金屬離子浸取工藝+不溶性雜質去除工藝+雜質金屬離子去除工藝+分步提取資源化金屬離子工藝。
其中雜質金屬離子去除工藝及分步提取工藝的選擇是評價整個濕法資源化回收工藝的核心所在,針對銅、鎳離子的資源化,根據本文第二節、第三節理論分析結果,各工藝理論pH值控制點詳見表5。

表5 濕法資源回收工藝方案pH值理論控制點表
根據表5數據分析,若采用單一的雜質金屬離子去除工藝,均存在某種雜質金屬離子去除理論pH值控制點高于銅或鎳離子開始沉淀理論pH值控制點,將造成較大量的資源化金屬離子的損失。
若采用單一的資源化金屬離子分步提取工藝,要么銅、鎳離子存在共沉淀pH值區域,例如氫氧化法、碳酸化合法、磷酸化合法;要么存在工藝過程處于強酸環境,造價成本高,pH值計選型較難,產品對下游冶煉工業可能遭二次污染,例如硫化物法、磷酸化合法;要么為液-固相反應,反應速率較慢,特別是鐵粉置換鎳金屬時其反應電動勢小反應速率將非常緩慢。
因此,綜上所述,單一雜質金屬離子去除工藝及資源化金屬離子分步提取工藝均存在明顯缺陷。通過對表5數據綜合分析,可采用硫酸-酸溶浸取+過濾不溶性雜質+鐵粉置換銅離子+過濾+硫化除鋅+氫氧化法爆氣除鐵鉻+過濾+氫氧化法制氫氧化鎳的組合形式進行工藝設計方案。
5 濕法資源回收工藝實驗驗證
對工藝設計研究方案進行實驗,實驗步驟:硫酸-酸溶浸取(硫酸濃度100 g/L;pH值<0;反應時間2 h)+過濾不溶性雜質+鐵粉置換銅離子工藝(鐵粉細度150 μm,過量1.2~1.5,pH值<0.5;反應時間2 h)+過濾得產品銅(水洗除鹽晾干)+硫化鈉除鋅(pH值=0.8~1.0;反應時間0.5 h)+ 氫氧化法爆氣除雜沉淀(pH值=5.0~6.0;反應時間1.5 h)+過濾沉淀+氫氧化合物法制氫氧化鎳工藝(pH值=9.0~10.0;反應時間0.5 h)+過濾得氫氧化鎳。
檢測標準:pH值的測定均采用《水質 pH值的測定 玻璃電極法》(GB 6920);銅鎳、鐵、鉻離子的測定均采用《水質 32種元素的測定 電感耦合等離子體發射光譜法》(HJ 776);固體均采用微波消解法《土壤和沉積物 金屬元素總量的消解 微波消解法》(HJ 832)
實驗數據詳見表6,數據計算結果詳見表7。
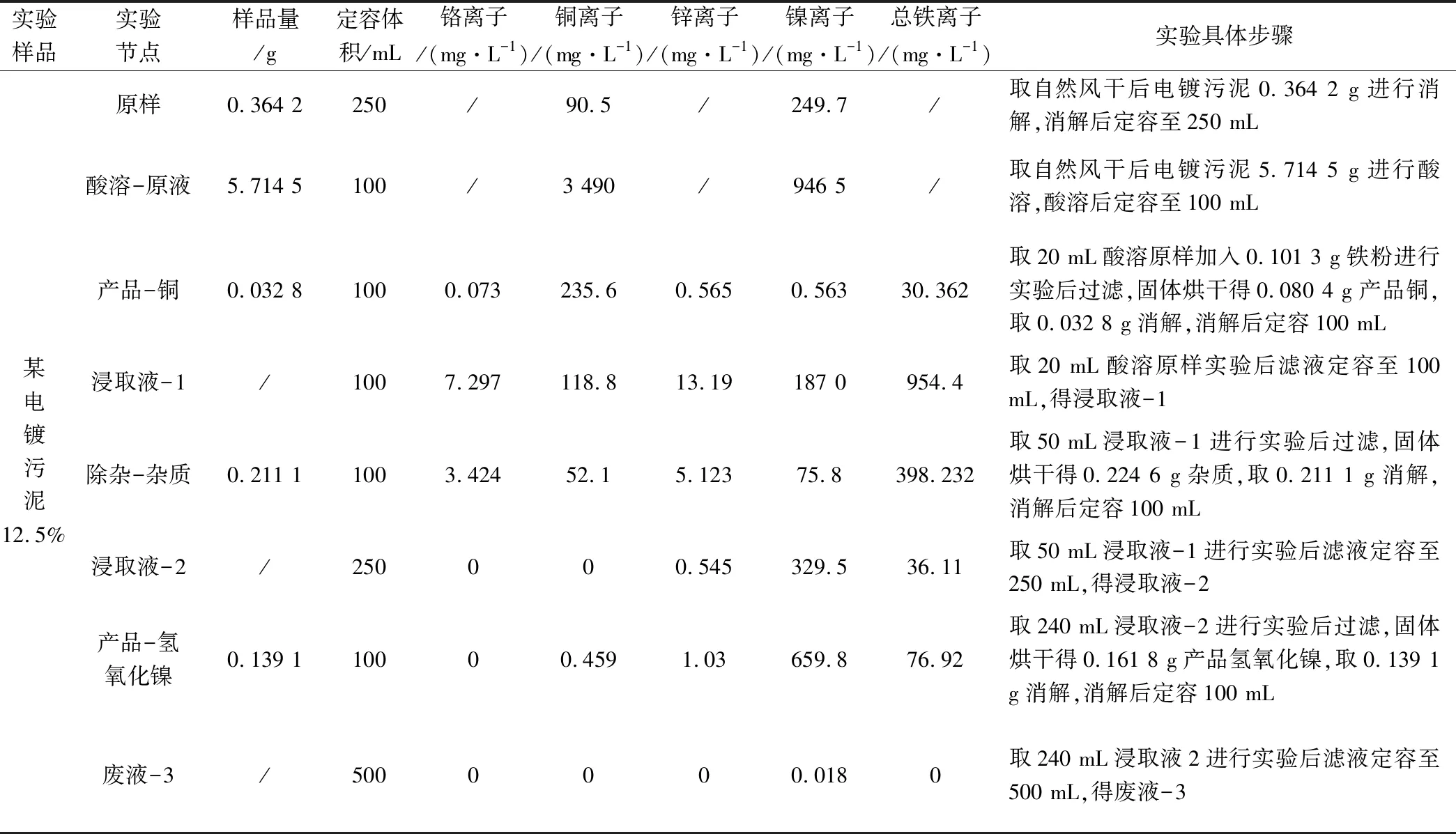
表6 具體實驗數據一覽表

表7 實驗數據計算結果(均折算為20 mL酸溶原樣折算)
實驗分析:
(1)鐵粉置換銅離子工藝段:銅離子置換率為82.98%,銅純度為71.83%,主要殘留為未完全反應的鐵粉。限制其置換率及純度的主要原因為置換時間不足,隨著反應進行,當溶液中銅、亞鐵離子比例降低,其反應電動勢隨之降低,反應趨勢亦減小,反應速率下降,越到反應后期所需反應時間越長。
(2)硫化鈉除鋅工藝段:鋅離子去除率為82.65%,其鋅的去除率較低的主要原因為實驗過程為減少硫化鎳共沉淀的可能性,pH值過程控制點為0.8~1.0,未能完全去除鋅離子。
(3)氫氧化法爆氣除鐵鉻工藝段:鉻離子去除率可達99.85%,其去除率較高原因為鐵粉置換過程產生的亞鐵離子在酸性條件下,具有較強的還原性,可將溶液中六價鉻全部還原成三價鉻,在后續除雜過程去除。鐵離子去除率為88.79%,去除率較低的主要原因為小試采用爆氣法,氧化不完全,致使部分亞鐵離子未完全氧化為鐵離子,氫氧化亞鐵溶度積8.0×10-16[4]與氫氧化鎳溶度積接近,未能在除雜工藝段去除,遺留至氫氧化合物法制氫氧化鎳工藝段中與氫氧化鎳共沉淀,且堿性條件下亞鐵離子也易氧化成鐵離子形成氫氧化鐵沉淀,這也是氫氧化鎳產品純度為75.24%,主要殘留物為氫氧化亞鐵、氫氧化鐵的主要原因。
(4)浸取液2中鎳保留率為88.10%,造成鎳離子損失的主要原因為氫氧化鐵絮凝沉淀過程的電位網捕作用,部分的鎳離子被網捕沉淀,同時在除雜工藝氫氧化法的控制點pH值為5.0~6.0,根據水的電離平衡常數可知,該區域調節過程所需堿液較少,pH值變化較靈敏,容易出現超pH值現象引起氫氧化鎳的共沉淀。
綜上所述,可對設計的工藝控制條件進行微調改進提高銅、鎳離子資源化的質量:在鐵粉置換金屬銅工藝段置換時間延長或采用粒徑更小的鐵粉;硫化鈉除鋅工藝段pH值過程控制點改為1.0~1.3;爆氣氫氧化法除鐵鉻工藝段中添加適量的雙氧水增強氧化效果且對pH值控制點精確控制;
6 結語
1)通過理論分析及實驗驗證,針對資源化回收對象為銅、鎳產品時,采用本文設計工藝方案可行性高,適用于各種品質的電鍍污泥的資源化回收利用,銅、鎳含量適用區間廣泛,電鍍污泥中銅、鎳分離徹底。
2)通過本文實驗驗證,采用硫酸-酸溶浸取電鍍污泥(硫酸濃度100 g/L;pH值<1.5;反應時間2 h),銅離子浸取率可達98.31%、鎳離子浸取率可達96.63%,基本與Veglib等[5]的研究結論一致。
3)通過理論分析及實驗驗證,采用設計工藝可有效去除鉻、鋅、鐵等離子,并有效資源化回收產品銅、產品氫氧化鎳。銅、鎳、鉻、鋅、鐵等離子基本不發生共沉淀現象,并可有效去除鉻、鋅、鐵等離子,其中鉻離子去除率不低于99.85%,鋅離子去除率不低于82.65%,鐵離子去除率不低于88.79%。其鐵粉置換銅離子率不低于82.98%,銅產品純度不低于71.83%,鎳保留率不低于88.10%,氫氧化鎳產品純度不低于75.24%。
4)采用本文設計工藝后,廢液中銅、鎳、鉻、鋅、鐵離子可滿足《污水綜合排放標準》(GB 8978—1996)第一類污染物最高允許排放濃度,無需增設車間污水處理設施。

