高齡老人血清尿酸水平與代謝綜合征的相關性分析
鄭卉 王惠 尹紅麗 尹冬華 程陽 王穎
高尿酸血癥(hyperuricemia,HUA)是由于嘌呤代謝產生的天然產物尿酸(uric acid,UA)產生過多或排泄不足而引起的代謝性疾病[1],是代謝綜合征(metabolic syndrome,MS)、高血壓、糖尿病、心血管疾病和卒中的潛在致病因素[2]。血清UA已成為慢性病的預警和干預指標之一。
HUA的患病率隨著年齡增長而升高[3],然而目前的大多數證據都是基于成年人或年齡<80歲的老年人。≥80歲的高齡老人缺乏基本數據。另一方面,高齡老人被認為延遲或避免了與年齡相關疾病的發作[4]。高齡老人衰老過程中是否存在HUA與MS的相互作用尚不清楚。目前相關研究均是在歐洲血統的高加索人的一般成年人和老年人群中開展的[5],年齡和種族可能對兩者關系有顯著影響[6],老年人和亞洲成年人被認為更容易受到HUA的影響[7]。本研究旨在探討高齡老人血清UA水平與MS的關系。
1 對象與方法
1.1 研究對象 選取2019年在江蘇省省級機關醫院健康管理中心體檢的1013例高齡老人為研究對象,年齡80~96歲,男690例,女323例。
1.2 診斷標準 根據中華醫學會糖尿病學分會建議的MS診斷標準[8]:(1)超重和(或)肥胖:BMI≥25;(2)高血糖:FPG≥6.1 mmol/L和(或)已確診糖尿病;(3)高血壓:SBP/DBP≥140/90 mmHg,和(或)已確診高血壓;(4)血脂紊亂:TG≥1.7 mmol/L,和(或)HDL-C<0.9 mmol/L(男),<1.0 mmol/L(女)。具備以上4項組成成分中的3項或全部者可確診為MS。
估計腎小球濾過率(estimated glomerular filtration rate,eGFR) 通過MDRD方程計算得來[9]。eGFR <60 mL/(min·1.73 m2)診斷為慢性腎臟病(chronic kidney disease,CKD)[10]。HUA的診斷標準為男性血清UA水平>416μmol/L,女性UA>357μmol/L[11]。
1.3 研究方法 所有受訪者均由經培訓的醫護人員進行基本信息收集、體格檢查及實驗室檢查。收集研究對象性別、年齡、疾病史等。體格檢查測量身高、體質量、SBP、DBP。血壓取連續測量3 次的平均值,每次測量間隔2 min。計算BMI =體質量(kg)/身高2(m2)。隔夜空腹抽取靜脈血檢測FPG、HbA1c、UA、肌酐(Cr)、尿素、ALT、AST、谷氨酰轉肽酶(GGT)、TG、HDL-C等。標本均于采血后2 h 內進行實驗室檢測。臨床生化指標測定及質量控制均在江蘇省省級機關醫院中心生化實驗室完成。

2 結果
2.1 一般資料比較 MS組的BMI、SBP、FBG、UA、Cr、ALT、GGT和TG水平均顯著高于非MS組;而eGFR和HDL-C水平顯著低于非MS組(P<0.05或0.01)。見表1。MS組HUA患病率為37.6%,顯著高于非MS組的23.7%(P<0.05)。
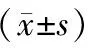
表1 2組間一般資料比較
2.2 血清UA水平與各指標相關性分析 血清UA 水平與年齡、BMI、TG和MS呈正相關(r=0.086、0.216、0.216、0.193,P<0.01),與性別、FBG和HDL-C呈負相關(r=-0.246、-0.066、-0.305,P<0.05或P<0.01)。
2.3 高齡老人發生MS的影響因素分析 將UA(<293.5μmol/L =0,293.5~<348.0μmol/L=1,348.0~<402.0μmol/L=2,>402μmol/L=3)、eGFR[>59.06 mL/(min·1.73 m2)=0,51.66~59.06 mL/(min·1.73 m)2=1,44.09~<51.66 mL/(min·1.73 m)2=2,<44.09 mL/(min·1.73 m)2=3]和ALT作為自變量,調整年齡、性別后進行多因素Logistic回歸分析,結果顯示在南京地區高齡老人中,UA、eGFR和ALT均為MS的危險因素(P<0.05),見表2。

表2 高齡老年人發生MS影響因素的多因素Logistic回歸分析
3 討論
目前血清UA 的生理參考值主要來自成人數據[12-13],在本研究中,高齡老人的HUA患病率為26.6%。此水平遠高于多項既往研究[3,14]。Meta分析顯示,50歲以上人群HUA患病率的性別差異縮小[15],部分原因是絕經后女性隨著雌激素的減少而失去保護[16]。
既往研究顯示,MS在普通人群中的患病率超過20%,在老年人中患病率更高[17]。在美國成年人中,MS的患病率隨著年齡的增長而增加,在 70 歲或以上的人群中達到 42.0%[18]。而本研究顯示,高齡老人中MS的患病率僅為20.7%,明顯較低。MS及其危險因素在心血管和其他與年齡相關的慢性疾病的發展中發揮著重要作用[19]。Framingham 研究顯示,MS的危險因素,如血壓、血糖和血脂,是心血管疾病發病率和死亡率的重要因素[20]。因此,本研究中發現高齡老人的MS低患病率是長壽的可能原因之一。
與既往成年人群中研究結果相似[21],在高齡老人人群樣本中同樣觀察到 TG、BMI水平與血清UA之間的正相關關系。HDL-C與UA之間呈負相關關系。此外,在本研究中,UA、eGFR和ALT為MS的獨立危險因素。
UA可通過激活多種炎癥信號通路導致脂肪組織炎性反應,引起糖脂代謝紊亂和代謝性疾病。肥胖顯著影響 UA 代謝可能與內臟脂肪促進極低密度脂蛋白和5-磷酸核糖焦磷酸導致UA過度產生、游離脂肪酸通過磷酸戊糖途徑增加嘌呤的合成,加速UA的產生等相關。血漿葡萄糖、TG水平升高和HDL-C水平降低可能與胰島素抵抗有關[22]。UA介導的脂肪腎素-血管緊張素系統上調可能導致胰島素抵抗[23]。UA也可能直接導致脂肪組織中胰島素抵抗的發展,通過氧化還原調節脂聯素水平[24]。胰島素抵抗被懷疑是將UA與MS的發展聯系起來的機制。降低UA水平可能是減少MS和心血管負擔的有用策略[22]。
ALT水平與肝臟脂肪儲存量、胰島素抵抗的嚴重程度相關。肝臟脂肪容量增加促使肝脂肪組織釋放過多的炎癥因子,也會促進ALT水平升高以及加速MS的發生發展[25]。
與eGFR>59.06 mL/(min·1.73 m)2相比,eGFR下降為MS的危險因素,而eGFR<60 mL/(min·1.73 m2)是鑒別CKD的重要診斷依據之一。已有既往研究顯示,MS與 CKD 發生關系密切,主要表現為對蛋白尿和 eGFR 的影響,其機制可能與中心性肥胖誘導機體產生胰島素抵抗,繼而出現代謝異常,最終導致腎小球內皮功能紊亂、血流動力學改變及氧化應激等作用有關。
目前的研究有幾個局限性。首先,血清UA可能受飲食、藥物等因素影響,但本研究中未能采集相關信息。其次,本研究為橫斷面研究,因果推論證據有限,尚需前瞻性研究驗證。第三,由于選擇接受調查的為參加體檢的老年人,相對健康,可能存在幸存者偏差,低估了相應風險。

