應激應答者
編譯 傳植
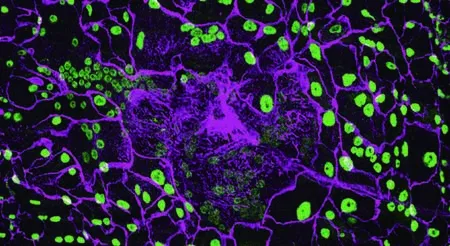
果蠅傷口周圍含有多個細胞核的巨型多倍體細胞
2008年,維姬 ? 洛西克(Vicki Losick)獲得博士學位后加入了卡內基科學研究所的一個果蠅實驗室,實驗室負責人希望他的博士后們能夠在新的領域開展研究。洛西克選擇了當時流行的研究熱點:干細胞。這是一類具有多種功能的細胞,能夠分化成為其他種類的細胞,在胚胎發育和成體組織更新中起到關鍵作用。洛西克對干細胞是否能夠修復受傷的組織感到好奇。于是,她和另一個博士后唐 ? 福克斯(Don Fox)開始用小針刺傷果蠅,希望記錄下干細胞修復傷口的過程。
而這兩位博士后各自獨立發現,傷口周圍的其他細胞出現了奇特的行為。這些細胞生長并復制DNA準備進一步分裂。接著它們停了下來,維持一種增大的單個細胞狀態,內含多份基因組的拷貝。現任職于波士頓大學的洛西克回憶道:“我當時相當震驚。”
當洛西克和福克斯幾天后觀察果蠅的傷口時,他們發現這些所謂的“多倍體細胞”才是治療傷口的主要細胞,而非干細胞。在針刺的部位,具有多個細胞核的巨型細胞快速封閉了傷口。福克斯回憶道:“我們同時發現了同樣的現象,并且干細胞和它無關。”
此后,兩位科學家對多倍體細胞的興趣不斷增長。大多數的植物和動物細胞都是二倍體,它們的基因組由來自父母的兩組染色體組成。多倍體細胞則有一組或多組額外的染色體,這曾經被認為是有害的異常現象,因助長癌癥發展而臭名昭著。但現在,洛西克表示,多倍體在果蠅中廣泛存在,“我認為人體中也是如此”。事實上,有數據顯示成年人類心臟中有80%的細胞是多倍體狀態,而出生時這一數值是零。
當人們發現多倍體細胞相當普遍,而且似乎至關重要,這一曾經鮮為人知的話題立刻吸引了癌癥研究人員、發育生物學家、演化生物學家、細胞生物學家和農業科學家。2023年5月,大約150名研究者在佛羅里達州齊聚一堂參加了洛西克參與組織的“生命之樹中的多倍體”會議,這些看似毫不相干領域的科學家們交流了信息。匹茲堡大學的發育生物學家夏瑪 ? 南達庫瑪(Shyama Nandakumar)說:“簡直難以置信,我們有如此多交叉的研究興趣。”

癌細胞中的巨大細胞核具有多組染色體,有利于腫瘤生存
研究結果顯示有多個基因會天然驅動多倍體的產生,證明這并非是細胞中的意外事件。研究人員找到線索表明,多倍體細胞能夠對從植物細胞到心臟等組織的發育起到關鍵作用。同時不斷有證據表明,多倍體細胞在各類組織和器官中都起到應對應激的重要作用,從受傷的果蠅,到損傷和疾病狀態下的人類肺臟、肝臟和腎臟。目前供職于杜克大學的福克斯指出,多倍體細胞“是干細胞的代替選擇”。
多倍體可能不只是有機體個體的一種應對方式,而是物種層面的行為。大約30%的植物是完全的多倍體生物,這意味著其所有細胞的染色體數量都是其祖先的兩倍或更多。一小部分動物也是如此,譬如一些火蠑螈。演化生物學家發現多倍體有機體比對應的二倍體往往具有競爭劣勢,這令人疑惑該遺傳特征為何能夠持續存在。研究人員確定了基因組復制的過程大約發生在數百萬年前,于是提出一種可能假設:多倍體或能夠幫助物種平安度過災難性的環境變化。從各種空間和時間尺度來看,多倍體都是一種“損傷響應”,佛羅里達大學的植物演化生物學家道格拉斯 ? 索爾蒂斯(Douglas Soltis)認為,“這是一個至關重要的演化事件,卻沒人關注”。
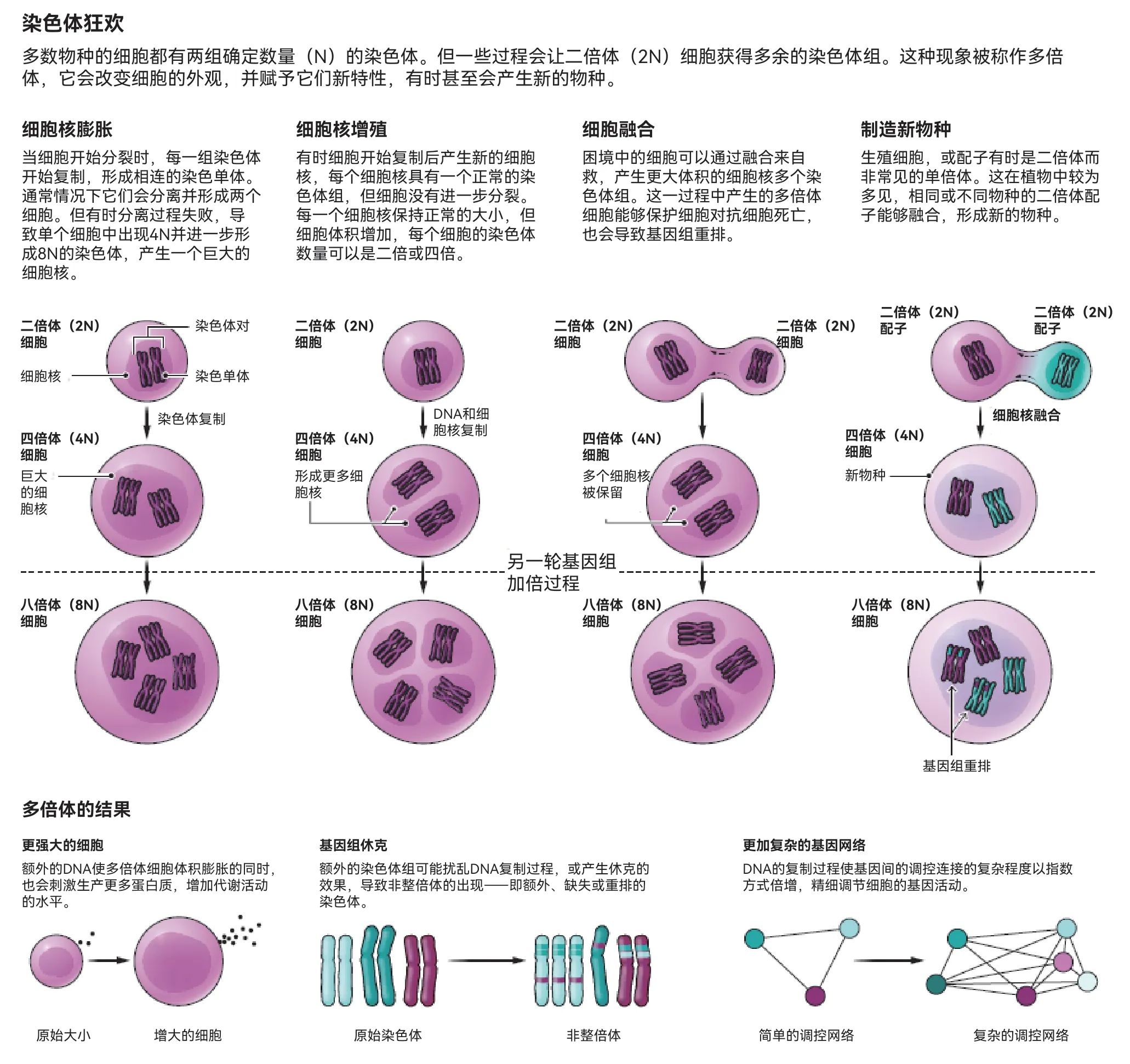
科學家在近一個世紀中發現多倍體細胞會由多種方式出現。一種情況是細胞分裂過程在中途被打斷,復制的DNA被留在了親代細胞中,并沒有進一步分裂成子細胞。另一種可能是多個細胞融合成具有多個細胞核的單個細胞。無論如何,結果都是產生了更大的細胞。洛西克說:“(細胞)通過變為多倍體,改變了物理特性。”
這種細胞有時會帶來危害,協助癌癥進展或抵抗放化療。多倍體細胞同樣在特定情況下會損害腎臟或肝臟。但洛西克和福克斯在受傷果蠅中的研究發現了多倍體細胞的另一功能。在二人查閱科學文獻尋找類似結果時,他們得知其他的研究團隊在疾病或應激狀態的組織中發現了多倍體細胞,這些受傷的器官組織包括肝臟。因此二人計劃進一步研究他們的果蠅系統。他們發現多倍體細胞的數量以及單個細胞中細胞核和基因組的數量不盡相同,取決于損傷尺寸等各種因素。
最重要的是,當二人通過操縱染色體復制或細胞融合所必要的基因以抑制多倍體細胞生成時,傷口便難以愈合。在卡內基研究小組2013年報道他們的結果前,一位杜蘭大學的果蠅生物學家鄧武民已經報告了果蠅卵巢損傷后也會出現類似的現象。福克斯指出,這些研究標志著“再生生物學的新前沿”。
福克斯、洛西克等人也記錄了細胞如何促進愈合。果蠅中,一些巨型細胞會很快填補損傷產生的空隙,由于它們具有各種基因的多份拷貝,能夠產生額外的蛋白質幫助加速修復過程。舉例來說,當針刺破壞了肌肉,這些細胞就能夠產生肌球蛋白,這種蛋白質參與肌肉的收縮。洛西克認為,多倍體細胞額外的DNA可能也讓它們能夠抵御損傷所致炎癥對DNA的破壞,這種炎癥通常會導致二倍體細胞死亡,而恢復能力下降。
類似的過程同樣發生在毒素損傷的小鼠腎臟,以及遭受脫水、創傷、感染或其他應激刺激下的人類腎臟中。在5月的會議上,佛羅倫薩大學細胞生物學家萊蒂齊亞 ? 德契拉(Letizia De Chiara)報告稱,她和佛羅倫薩的腎病學家保拉 ? 羅馬尼亞尼(Paola Romagnani)觀察到大量新產生的巨大多倍體細胞會迅速充滿小鼠腎臟的損傷部位,并恢復腎功能。她和同事也研究了腎臟器官慢性衰竭的人類患者的活檢結果,發現腎臟中充滿了多倍體細胞。她同時在會議上報告稱,對于從急性腎損傷中恢復的患者來說,這類細胞的數量會隨著時間逐漸下降。
一旦多倍體細胞完成損傷的控制工作后便會停下,因為這種尺寸過大的細胞一旦累積起來可能會有害。佛羅倫薩的研究小組2022年報告稱,它們可能會導致瘢痕和慢性腎臟衰竭。但洛西克的研究生盧瓦塞勒 ? 岡薩雷斯(Loiselle Gonzalez)發現特定的瘢痕本身能夠控制這種細胞的數量。她在5月的會議上報告稱,在受傷果蠅中阻斷瘢痕形成過程后,多倍體細胞會繼續形成,而傷口也不會完全關閉愈合。洛西克說:“包括纖維化在內的瘢痕樣組織對于限制多倍體而言或許是必要的。”
洛西克鑒定出一種能夠控制果蠅多倍體形成的蛋白質:它是哺乳動物中分子YAP1(yes1相關轉錄調節因子)在果蠅中對應的蛋白質。YAP1參與調控控制器官尺寸的基因。研究證實它可以刺激昆蟲傷口愈合過程中多倍體的形成,并在其活性下降時起到控制作用。佛羅倫薩的研究小組發現YAP1在小鼠腎臟中有相同的作用。羅馬尼亞尼表示:“令人驚奇的是,我們在果蠅(腹部)和哺乳動物腎臟中看到了非常相似的結果。”
德契拉表示,小鼠的研究表明在恰當的時機抑制YAP1能夠減少受損的腎臟形成有害瘢痕組織的風險。她和同事在動物模型中探索這種可能性。一些生物技術公司正基于YAP1通路開發其他用途的藥物,也許這種方式也能夠用于防止多倍體形成造成的有害結果。
靶向多倍體細胞的藥物或許也能夠用于對抗其最危險的作用:使癌細胞產生抵抗治療的能力。在大多數腫瘤細胞中,會有一部分細胞轉化為不再分裂的巨型多倍體細胞,它們額外的基因組材料使其對化療或放療產生抵抗能力。這些細胞同樣具有物理特性,它們的運動能力和伸縮性都有所增強,這增加了它們離開腫瘤部位并定殖于其他身體位置的能力,約翰 ? 霍普金斯醫學院的研究人員2022年在《生物學檔案》(bioRxiv)上發表了這一結論。
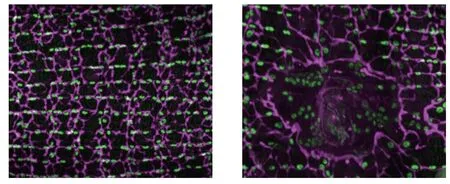
受傷前的果蠅腹部細胞呈現出均一的尺寸,排列整齊(左),但受傷后細胞會融合成具有多個細胞核的巨型細胞(右)
另一個霍普金斯的研究小組發現了一種多蛋白復合物,似乎對細胞的恢復力起到關鍵作用。當他們抑制多倍體細胞中該復合物的一個組成部分——CDK9蛋白時,這些細胞不再對抗癌藥物具有抗性,他們在會議中報告道,這意味著耐藥癌癥可能具有這一弱點,值得進一步探究。
似乎多倍體細胞在受損或應激組織中是一個受到歡迎的短期訪客,而在癌癥中是一個長期逗留的危險人物,那么為什么多倍體能夠持續存在,且幾乎存在于譬如小麥、草莓和甘蔗等一些物種的幾乎所有細胞中呢?這些物種多數都曾經歷過兩個或更多種的親緣物種間的雜交繁殖過程,它們的基因組因此聯合在了一起,而沒有回到二倍體的狀態。有時這些聯合的基因組會再次復制——像是小麥具有六組染色體,而草莓有八組。多次拷貝復制成長和營養必要的關鍵基因能夠形成更密集的谷穗、更大的果實和更高、更甜的莖稈。
這些特征對人類消費者而言是極好的,但對植物而言,“幾乎絕大多數全基因組復制現象實際上是適應不良。”根特大學的進化生物學家伊夫 ? 范德皮爾(Yves Van de Peer)評價道,譬如說,多倍體植物相對于二倍體植物需要更多的營養,生長速度也更慢。但這種特征能夠持續下去,范德皮爾相信答案在于抵抗應激這一點。
他和同事開始研究植物物種基因組發生復制的時機,探索其中是否具有一定的規律。他們發現許多復制發生于6 600萬年前,正好是小行星撞擊地球并引發大規模滅絕的時期。一項深入的研究發現這種結論能夠在更多的植物基因組中得到驗證,這揭示了氣候變化或冰河時期可能存在更多的全基因組復制浪潮。
“我起初有些懷疑(范德皮爾的看法),”索爾蒂斯說,“但他的結論卻經過了時間的考驗。”舉例來說,范德皮爾的團隊發現,擬南芥屬(常用于植物生物學研究)的一些物種在200萬年前的寒潮時成為多倍體。2019年,哈佛大學的演化生物學家查爾斯 ? 戴維斯(Charles Davis)發現一組熱帶花卉金虎尾目植物在5 000萬年前的一段極端溫暖的時期經歷了全基因組復制。如今,這一目包含16 000個物種,這證實了多倍體相對于其造成的損害能夠起到幫助物種的作用。

當浮萍被迫變為多倍體(右),其細胞相比于正常者(左)變大,使葉子顯得更大
范德皮爾如今相信多組基因組使得基因可塑性增加,多倍體從而能夠對新的應激進行快速調整,在足以摧毀大多數植物和動物的災難中存活下來。
范德皮爾表示,全基因組復制的模式“表明多倍體能夠在短期內,甚至立即產生演化優勢”。
他在會議上利用計算機建模和實驗結果支持這一結論。他的團隊建立數字有機體的群集,賦予它們“基因”以激活虛擬的輪子進行移動,讓有機體在一定的速度下接觸或躲避其他有機體。
在一些群集活動中,個體具有一份“基因組”的拷貝,而另一些則是兩份。為了測試這兩種類型的適應程度,范德皮爾評估了這些個體沿著網絡尋找虛擬“食物”的能力。擁有一份基因組拷貝的有機體的表現更好,而當研究人員限制食物的供應后卻發生了變化。“多倍體突然開始展現出更加極端的行為”,范德皮爾說,它們邁出更大的步伐,找到更多的食物,甚至會合作捕獵它們的競爭對手。最終單基因組的群集滅絕了。這項工作“確認了在一個應激壓力大的環境中,有額外的基因組拷貝是一件好事”。他在2019年的《公共圖書館 ? 綜合》(PLOSONE)中報告了這一結果。
“這項實驗證明它們能夠競爭過二倍體,這很引人注目,”索爾蒂斯說,“其中肯定有些奧秘。”
現如今,范德皮爾相信他已經找到了答案。模擬實驗中的基因會組成一個交互網絡,而范德皮爾發現具有兩倍基因的有機體形成的基因網絡具有更多聯結。因此有機體得以移動得更快,跳躍得更遠,并出現意料外的行為,或是以復雜的方式與其他有機體交互。
范德皮爾等人相信,活有機體中也可能會發生類似的現象。福克斯解釋道:“染色體數量增加,就會形成更多的聯結,用于精細調節基因的相對數量。”這使得部分特定蛋白數量增加,而另一些數量減少,從而改變有機體的行為、生理學或化學特性。洛西克補充說,多倍體物種“能夠更好地適應各種環境”。
二倍體有機體已經很好地適應了穩定的環境,因此許多這類精細調節并無必要。但當滅絕恐龍的小行星撞擊事件發生后,地球被野火的煙塵所籠罩而暗無天日,此時多倍體便具有存活的各式能力,范德皮爾假設道。“通常全基因組復制在演化上是死路一條,”他總結道,“但如果發生在正確的時機,便能夠創造進化的機會。”
為了驗證這一想法,范德皮爾和同事轉向一種小型水生植物紫背浮萍。通過將它們暴露于特定的化學物質,阻斷細胞分裂,誘導一些個體產生多倍體。然后,研究人員將二倍體和多倍體一同培養,比較二者應對應激(如高鹽或是高濃度重金屬的環境)時的反應。實驗證實多倍體植物承受能力更高,他在五月的會議上報告道。他的團隊很快將對不同代的浮萍進行基因測序,通過評估基因活動探究多倍體和二倍體的基因調控網絡存在哪些差別。
匹茲堡大學的演化生態學家蒂亞-林恩 ? 艾希曼(Tia-Lynn Ashman)和馬丁 ? 特科特(Martin Turcotte)也在浮萍中研究多倍體問題。多倍體植物相對于二倍體植物而言,生長速度通常更慢,種群數量也更小。但它們具有更加多樣的微生物生態系統,艾希曼在會議上報告道。
這可能是多倍體的另一個有益結果。研究人員逐漸意識到有機體的微生物組有助于其存活,多樣性更大的微生物群系能夠讓宿主消化更多種食物,或是通過其他方式增加宿主的承受能力。艾希曼指出,增加的多樣性能夠作為一種機制解釋全球尺度上觀察到的多倍體的廣泛生態適應性。
可以確定的是,多倍體細胞絕非異常情況,而是生命活動中應對損傷、疾病和有害環境等應激的一種主要機制。在會議上,佛羅里達自然博物館的植物演化生物學家帕梅拉 ? 索爾蒂斯(Pamela Soltis)說:“我們逐漸認識到全基因組復制并非簡單地將細胞中的一切進行復制,而是一種獨特的生物學過程。”
洛西克為這種看法上的轉變感到高興,她回憶起博士后導師對她的高度期許。“我感到自豪,”她說,“也很激動能夠成為這個新領域的一分子。”
資料來源Science

