微小RNA-214靶向調控PTEN對成骨細胞MC3T3-E1增殖、分化、礦化的影響及機制研究
方 宇,董重陽,高斌禮,李明宇,李 偉,郭 文,焦志超
(1.內蒙古醫科大學附屬醫院骨科,內蒙古 呼和浩特 010050;2.內蒙古醫科大學中醫學院,內蒙古 呼和浩特 010107;3.內蒙古醫科大學第二附屬醫院影像中心,內蒙古 呼和浩特 010010)
隨著老齡化加劇,近些年我國骨質疏松(Osteporsis,OP)發病率呈遞增趨勢。OP是一種代謝性的全身性骨骼疾病,多發于老年人及絕經后婦女等群體,主要臨床特征是骨組織中骨量減少、骨微觀結構受損、骨強度降低等,隨著疾病進展,骨脆性增加,骨折風險也急劇增加,導致患者出現骨骼疼痛、變形等不適癥狀,嚴重影響了患者的生活質量[1-4]。目前研究[5-6]認為,OP的發生發展與雄性激素、營養和其他物理因素引起的骨代謝失衡密切相關,在骨代謝中成骨細胞扮演著重要角色,其增殖和分化能力決定骨量多少。微小RNA(microRNA,miR)由約22個核苷酸組成,主要通過調控多個靶基因表達,從而參與調控疾病進程[7]。有研究[8]在小鼠尾懸吊誘導的骨丟失模型中發現,骨組織中的miR-214表達量明顯升高。然而,miR-214是否通過調控成骨細胞參與OP進程的相關研究較少。作為經典的信號通路,磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinases,PI3K)/蛋白激酶B(Protein kinase B,AKT)信號通路參與多種疾病發生與發展,近些年來發現PI3K/AKT可以在第10號染色體丟失性磷酸酶及張力蛋白同源基因(Phosphatase and tensin homolog deleted on chromosome ten,PTEN)介導下參與到骨代謝進程。生物信息學分析顯示miR-214能夠靶向調控PTEN。因此,本研究選取成骨細胞MC3T3-E1為研究對象,觀察miR-214調控PTEN對成骨細胞的作用及機制。
1 材料與方法
1.1 實驗細胞 成骨細胞MC3T3-E1和工具細胞HEK 293T購自中國科學院上海細胞研究所。
1.2 主要試劑 α-MEM培養基(批號:11965012)、鏈霉素/青霉素(批號:15070117)、高容量cDNA反轉錄試劑盒(批號:4368845)、TRIzol試劑(批號:15596035)、鏈霉素親和偶聯磁珠(批號:88392)、胎牛血清(批號:16140324)購自美國Thermo Fisher公司;miR-124模擬物(mimic)和陰性對照(NC)、pcDNA3.1-PTEN由廣州源井生物科技有限公司提供;CCK-8試劑盒(批號:C0038)購自上海碧云天生物技術有限公司;骨鈣素放射免疫試劑盒(批號:NJ0432)、堿性磷酸酶試劑盒(批號:NJ18723)購自南京建成生物科技有限公司;兔抗PTEN(批號:A2784)、Ⅰ型膠原蛋白(Col Ⅰ,批號:A5432)、骨橋蛋白(OPN,批號:A1137)、p-PI3K(批號:A4233)、p-AKT(批號:A4234)購自武漢愛博泰克生物科技有限公司。
1.3 實驗方法
1.3.1 細胞培養與轉染:復蘇MC3T3-E1細胞,使用含10%胎牛血清與100 mg/ml鏈霉素/青霉素的α-MEM培養基,恒溫培養箱中培養,條件設置為飽和濕度、溫度37 ℃、5% CO2。待融合達到80%后,加入胰蛋白酶消化、傳代。取對數生長期MC3T3-E1細胞,根據Lipofectamine 2000試劑盒說明書進行轉染,將細胞分為miR-124 mimic組、miR-124 NC組、pcDNA3.1-PTEN組、miR-124 mimic+pcDNA3.1-PTEN組,48 h后收集各組細胞備用。
1.3.2 實時熒光定量聚合酶鏈式反應(RT-qPCR)檢測細胞miR-124和PTEN mRNA表達:采用TRIzol試劑提取各組細胞總RNA,用反轉錄試劑盒轉錄成cDNA。PCR反應體系:上下游引物各0.5 μg、1 μg cDNA模板和SYBR Premix Ex Taq Ⅱ試劑盒,配制20 μl。反應條件:95 ℃預變性2 min;95 ℃ 15 s,60 ℃ 60 s,循環40次。引物序列見表1。采用2-ΔΔCt法計算miR-124、PTEN mRNA相對表達水平。

表1 各基因引物序列
1.3.3 雙熒光素酶報告基因檢測miR-124與PTEN靶向結合:miR-124與PTEN結合位點使用生物信息學數據庫Target Scan Human預測。構建突變型psiCheck2-PTEN-MUT-Luc和野生型psiCheck2-PTEN-WT-Luc熒光質粒,與陰性對照和miR-124模擬物共轉染至HEK 293T細胞,檢測熒光信號強度。
1.3.4 CCK-8法檢測細胞增殖:取各組對數生長期細胞,加入胰蛋白酶消化計數。按照2×104個/孔接種于96孔板中,置于恒溫箱(37 ℃、5% CO2)中培養48 h后,將10 μl CCK-8分別加入各組孔中,培養2 h,酶標儀檢測450 nm處的吸光度值(A)。細胞增殖率=(A樣品-A空白)/A空白×100%。
1.3.5 堿性磷酸酶活性檢測:取各組對數生長期細胞,加入胰蛋白酶消化計數,按照2×104個/孔接種于24孔板中,置于恒溫箱(37 ℃、5% CO2)中培養。待細胞貼壁后,棄去培養基,加入含有成骨誘導劑(0.15 mmo/L抗壞血酸、10-8mmol/L地塞米松以及10 mmol/L β-甘油磷酸鈉)的培養基,放回培養箱,然后繼續培養7 d,按照試劑盒說明書檢測。
1.3.6 骨鈣素水平檢測:取各組對數生長期細胞,加入胰蛋白酶消化計數,按照2×104個/孔接種于24孔板中,置于恒溫箱(37 ℃、5% CO2)中培養,等到細胞貼壁,將培養基去除,然后將含有礦化誘導劑(50 mg/L抗壞血酸和10 mmol/L β-甘油磷酸鈉)的培養基加入進去,返回培養箱當中,繼續培養21 d,按照骨鈣素放射免疫試劑盒說明書步驟檢測。
1.3.7 茜素紅染色:取各組對數生長期細胞,加入胰蛋白酶消化計數,按照5×103個/孔接種于96孔板中,置于恒溫箱(37 ℃、5% CO2)中培養。待細胞貼壁后,棄去培養基,加入含有礦化誘導劑的培養基,繼續培養21 d。取各組細胞加入70%乙醇,固定1 h后,然后加入濃度為10%的茜素紅,置于恒溫箱中,設置溫度37 ℃,繼續培養30 min,然后加入濃度為10%的西吡氯胺,室溫靜置10 min,取出并用PBS液沖洗2遍,鏡下觀察,在低倍鏡下任選5個視野,采用NIH Image 1.31軟件進行分析,根據鈣化面積與總面積比值計算礦化率,即礦化率=鈣化面積/總面積×100%。
1.3.8 Western blot檢測蛋白表達:加入適量預冷裂解液至各組細胞勻漿,于冰上孵育30 min。離心(4 ℃下10000 r/min)10 min后,取上清液,BCA定量后制樣。電泳、轉模、切膠片后,加入5%脫脂奶粉配置的封閉液,置于搖床中封閉1 h。加入一抗[PTEN(1∶1000稀釋)、Col Ⅰ(1∶500稀釋)、OPN(1∶500稀釋)、p-PI3K(1∶500稀釋)、p-AKT(1∶500稀釋)],搖勻置于恒溫箱(4 ℃)中過夜,洗膜,加入二抗(1∶5000稀釋),室溫孵育2 h。洗膜添加顯色液,避光5 min,采用Image J分析。
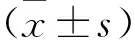
2 結 果
2.1 生物信息學分析及雙熒光素酶報告基因檢測結果 見圖1、2。在線生信(http://www.targetscan.org/vert_72/)預測顯示miR-124和PTEN存在結合位點。雙熒光素酶報告基因結果發現,miR-124 mimic組野生型PTEN的熒光素酶活性明顯低于miR-124 NC組(均P<0.05),miR-124 mimic組與突變型PTEN的熒光素酶活性比較差異無統計學意義(P>0.05)。

圖1 miR-124與PTEN結合位點

圖2 雙熒光素酶報告基因檢測結果
2.2 miR-124對MC3T3-E1細胞PTEN mRNA及蛋白表達的影響 見表2。qRT-PCR及Werstern blot結果顯示,與miR-124 NC組比較,miR-124 mimic組miR-124表達升高(P<0.05);與miR-124 NC組比較,miR-124 mimic組PTEN mRNA及蛋白表達降低,pcDNA3.1-PTEN組表達升高(均P<0.05);與miR-124 mimic組比較,miR-124 mimic+pcDNA3.1-PTEN組PTEN mRNA及蛋白表達升高(均P<0.05)。
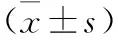
表2 miR-124對MC3T3-E1細胞PTEN mRNA及蛋白表達的影響
2.3 miR-124對MC3T3-E1細胞增殖的影響 CCK-8檢測結果顯示,miR-124 NC組、miR-124 mimic組、pcDNA3.1-PTEN組和miR-124 mimic+pcDNA3.1-PTEN組細胞增殖率依次為(87.34±3.25)%、(109.25±4.58)%、(53.47±2.93)% 和(85.43±3.22)%。與miR-124 NC組比較,miR-124 mimic組細胞增殖率升高,pcDNA3.1-PTEN組降低(t=6.757、13.407,均P<0.05);與miR-124 mimic組比較,miR-124 mimic+pcDNA3.1-PTEN組細胞增殖率降低(t=7.369,P<0.05)。
2.4 miR-124對MC3T3-E1細胞分化的影響 見表3。miR-124 mimic組細胞堿性磷酸酶活性、Col Ⅰ、OPN表達明顯低于miR-124 NC組,pcDNA3.1-PTEN組細胞堿性磷酸酶活性、Col Ⅰ、OPN表達明顯高于miR-124 NC組(均P<0.05)。miR-124 mimic+pcDNA3.1-PTEN組細胞堿性磷酸酶活性、Col Ⅰ、OPN明顯高于miR-124 mimic組(均P<0.05)。
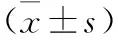
表3 調控miR-124表達對MC3T3-E1細胞分化的影響
2.5 miR-124對MC3T3-E1細胞礦化的影響 見表4。與miR-124 NC組比較,miR-124 mimic組細胞礦化率和骨鈣素水平降低,pcDNA3.1-PTEN組升高(均P<0.05)。與miR-124 mimic組比較,miR-124 mimic+pcDNA3.1-PTEN組細胞礦化率和骨鈣素水平升高(均P<0.05)。
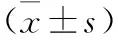
表4 miR-124對MC3T3-E1細胞分化的影響
2.6 miR-124對MC3T3-E1細胞PI3K/AKT信號通路蛋白的影響 見表5。Werstern blot檢測結果顯示,與miR-124 NC組比較,miR-124 mimic組細胞p-PI3K、p-AKT蛋白表達升高,pcDNA3.1-PTEN組表達降低(均P<0.05);與miR-124 mimic組比較,miR-124 mimic+pcDNA3.1-PTEN組細胞p-PI3K、p-AKT蛋白表達降低(均P<0.05)。
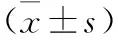
表5 miR-124對MC3T3-E1細胞PI3K/AKT信號通路相關蛋白表達的影響
3 討 論
正常情況下,成骨細胞和破骨細胞處于一種動態平衡狀態,其在維持機體骨量中扮演著重要角色,然而一旦平衡打破,可能誘發機體出現骨質疏松[9]。多數研究證實,在成骨細胞增殖、分化以及礦化過程中,microRNAs出現異常表達。Cui等[10]研究發現,在成骨細胞hFOB1.19中,當上調miR-296時,Cbfal蛋白表達也隨之上調,同時加劇了細胞成骨細胞分化。Yu等[11]研究發現,miR-455-3p能夠調控同源結構域相互作用蛋白激酶2(HIPK2)表達,介導轉錄激活蛋白3(STAT3)信號通路參與高糖誘導的成骨細胞凋亡和增殖。miR-214位于人染色體的1q24.3區域。有研究[12]顯示,乳腺癌骨轉移患者破骨細胞中miR-214表達明顯上調,且能夠下調腫瘤壞死因子受體相關因子3表達,促進破骨細胞分化,給予拮抗劑可減弱骨溶解轉移進展。本研究生信在線分析結果顯示miR-214和PTEN存在靶向結合序列。Liu等[13]研究發現,在糖尿病腎病大鼠中miR-214可以靶向調控PTEN。趙娜等[14]研究發現,在骨肉瘤中miR-214可以靶向PTEN抑制腫瘤細胞凋亡。本研究選取成骨細胞MC3T3-E1為研究對象,采用細胞轉染上調miR-214表達,結果顯示PTEN mRNA和蛋白均表達下調,雙熒光素酶報告基因檢測也證實兩者存在靶向調控關系。
PTEN位于人染色體的10q23.3,主要通過調控PI3K/AKT信號通路參與多種疾病進程[15-16]。研究[17]發現,PTEN在骨質疏松患者血清中的表達顯著高于健康人群,而miR-140-3p低于健康人群,且兩者存在靶向調控作用。本研究將miR-214 mimic和pcDNA3.1-PTEN單獨或兩者共轉染至成骨細胞MC3T3-E1中,結果顯示miR-214表達上調能夠明顯抑制細胞增殖、成骨分化和礦化,降低成骨分化堿性磷酸酶、Col Ⅰ、OPN和骨鈣素水平,而過表達PTEN則會逆轉上述作用,提示miR-214調控成骨細胞MC3T3-E1增殖、分化以及礦化是通過靶向調控PTEN完成。
骨代謝平衡受到多種信號通路調控,PI3K/AKT信號通路是一條內源性的轉導通路,參與了多種疾病進程,PI3K/AKT發生磷酸化后能直接調控細胞的增殖、凋亡與衰老等生理過程[18-19]。Khan等[20]采用Rapamycin阻斷PI3K/AKT信號通路,在鈣質沉積的茜素紅染色減弱,成骨細胞分化受到明顯抑制。本研究發現,過表達miR-124可以顯著上調p-PI3K、p-AKT蛋白水平,提示上調miR-214表達后,PTEN蛋白表達下降,進而激活PI3K/AKT信號通路,從而調控成骨細胞MC3T3-E1增殖、分化和礦化。micro-RNAs在骨重建過程中發揮重要作用,尤其在調控成骨細胞和破骨細胞分化功能以及骨質疏松等疾病方面[21-22]。未來有可能通過抑制或者過表達某些特定的microRNAs來減緩患者的骨丟失,促進骨重塑,從而達到治療骨病的目的。
綜上所述,miR-214通過靶向下調PTEN蛋白表達激活PI3K/AKT信號通路,從而調控成骨細胞MC3T3-E1增殖、分化和礦化。miR-214未來可能成為骨病潛在的治療靶點。本研究也存在不足之處,只是在細胞中初步揭示了miR-214調控MC3T3-E1細胞成骨分化的分子機制,而miR-214能否作為骨病診斷標志物以及其效能大小需進一步研究。

