膽綠素還原酶A rs699512和肝細胞溶質載體有機陰離子轉運蛋白家族成員1B1 rs4149015位點基因多態性與新生兒不明原因高膽紅素血癥易感性相關性研究
杜 晨,徐 征,高 宇,夏蘭蘭,李 燁,李 寧
(1.首都醫科大學附屬北京兒童醫院保定醫院檢驗科,河北 保定 071000;2.陸軍第八十二集團軍醫院檢驗科,河北 保定 071000;3.首都醫科大學附屬北京兒童醫院保定醫院新生兒科,河北 保定 071000)
高膽紅素血癥(Hyperbilirubinemia,HB)是新生兒較為常見的一種疾病,據統計其發病率超過55%,其中20%~30%是不明原因HB[1]。由于病因無法明確,增加了臨床診斷與治療難度,若患兒未得到及時有效治療,極易發生膽紅素腦病,甚至引發不可逆神經系統損害,因此明確易感基因對形成系統防治體系至關重要[2-3]。膽綠素還原酶A(Biliverdin reductase A,BLVRA)可通過還原膽綠素生成非結合型膽紅素,參與HB發生過程[4]。肝細胞溶質載體有機陰離子轉運蛋白家族成員1B1(Solute carrier organic anion transporter family member 1B1,SLCO1B1)是有機陰離子轉運因子1B1(Organic anion transportingpolypeptide 1B1,OATP1B1)的編碼基因,具有較高的遺傳變異性,在肝臟轉載膽紅素過程中發揮重要作用[5]。但目前關于BLVRA和SLCO1B1基因位點在不明原因HB中的研究較少。基于此,本研究探討BLVRA rs699512與SLCO1B1 rs4149015位點基因多態性在新生兒不明原因HB中的作用及意義,為臨床制定針對性防治方案提供借鑒。
1 對象與方法
1.1 研究對象 選取2022年1月至2023年1月于本院分娩和治療的新生兒不明原因HB患兒90例為HB組,另選取同期健康新生兒90例作為對照組。納入標準:新生兒不明原因HB符合《諸福棠實用兒科學》[6]中相關診斷標準;健康新生兒檢查各項指標正常;出生日齡<28 d;兩組監護人均對本研究知情,自愿簽訂知情同意書。排除標準:參與本研究前應用磺胺類、水楊酸類等影響膽紅素代謝的藥物者;伴有染色體異常、遺傳性代謝性疾病者;存在先天性心臟病、先天畸形、先天性膽管閉鎖、紅細胞增多癥、血管外溶血者;合并甲狀腺功能異常者;合并感染性疾病者;母嬰血型不合者。本研究經本院醫學倫理委員會審核并批準(倫理批號:TJIRB20201002)。
1.2 研究方法
1.2.1 資料收集:收集所有研究對象的一般資料,包括性別、胎齡、出生體重、開奶時間、紅細胞壓積、總膽紅素和結合膽紅素等數據。
1.2.2 基因多態性檢測:采集清晨空腹靜脈血2 ml,利用TIANGEN試劑盒提取DNA,紫外分光光度計測量樣品DNA純度與濃度,確認合格后保存于4 ℃冰箱內。采用聚合酶鏈反應-限制性片段長度多態性法檢測BLVRA rs699512和SLCO1B1 rs4149015位點基因多態性。PCR引物序列由上海生工生物工程有限公司設計,PCR反應體系體積25 μl,反應條件:95 ℃預變性5 min;94 ℃變性20 s,57 ℃退火20 s,72 ℃延伸30 s,循環37次;72 ℃延伸10 min。取5 μl DNA擴增片段行限制性內切酶消化反應與瓊脂糖電泳,在紫外燈光透視下分析BLVRA rs699512、SLCO1B1 rs4149015位點基因多態性檢測結果。委托華大基因科技股份有限公司進行DNA測序,采用Mutation Surveyor 4.0軟件進行基因序列比對分析。
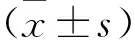
2 結 果
2.1 兩組臨床資料比較 見表1。HB組患兒總膽紅素和結合膽紅素水平明顯高于對照組(均P<0.05)。兩組其他資料比較差異無統計學意義(均P>0.05)。
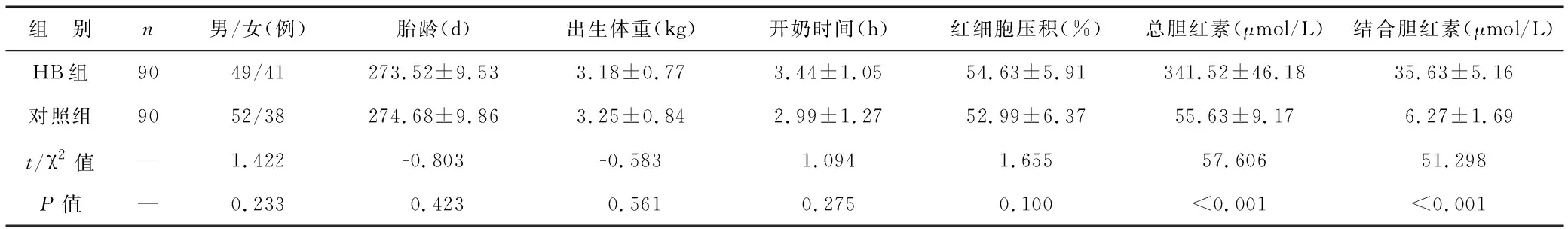
表1 兩組臨床資料比較
2.2 兩組BLVRA rs699512位點基因型分布和等位基因比較 見表2。兩組BLVRA rs699512位點基因型分布比較差異有統計學意義(χ2=9.202,P=0.010)。HB組GG基因型分布高于對照組,AA基因型分布低于對照組(均P<0.05)。HB組G等位基因頻率高于對照組(P<0.05)。
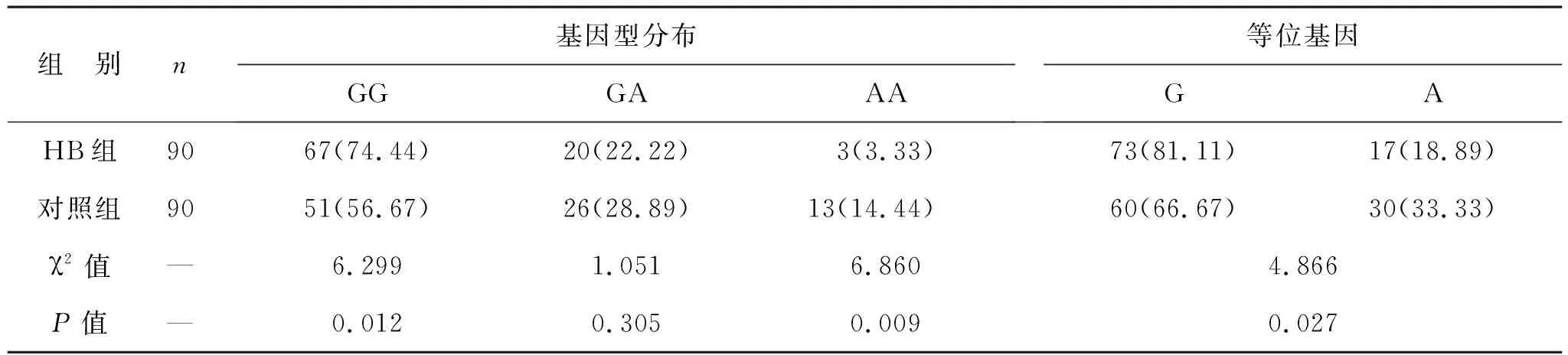
表2 兩組BLVRA rs699512基因型分布和等位基因比較[例(%)]
2.3 兩組SLCO1B1 rs4149015位點基因型分布和等位基因頻率比較 見表3。兩組SLCO1B1 rs4149015位點基因型分布比較差異有統計學意義(χ2=8.751,P=0.013)。HB組AA基因型分布高于對照組,GG基因型分布低于對照組(均P<0.05)。HB組A等位基因頻率高于對照組(P<0.05)。
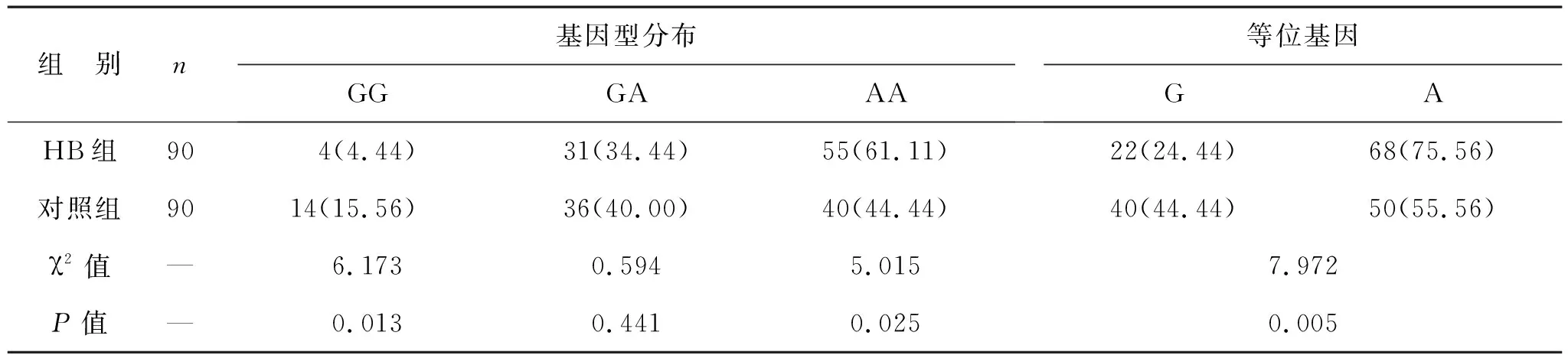
表3 兩組SLCO1B1 rs4149015基因型分布和等位基因比較[例(%)]
2.4 不同BLVRA rs699512基因型患兒血清膽紅素水平比較 見表4。不同BLVRA rs699512基因型患兒總膽紅素和結合膽紅素水平比較差異有統計學意義(均P<0.05)。BLVRA rs699512中GG基因型總膽紅素和結合膽紅素水平高于AA基因型(均P<0.05)。
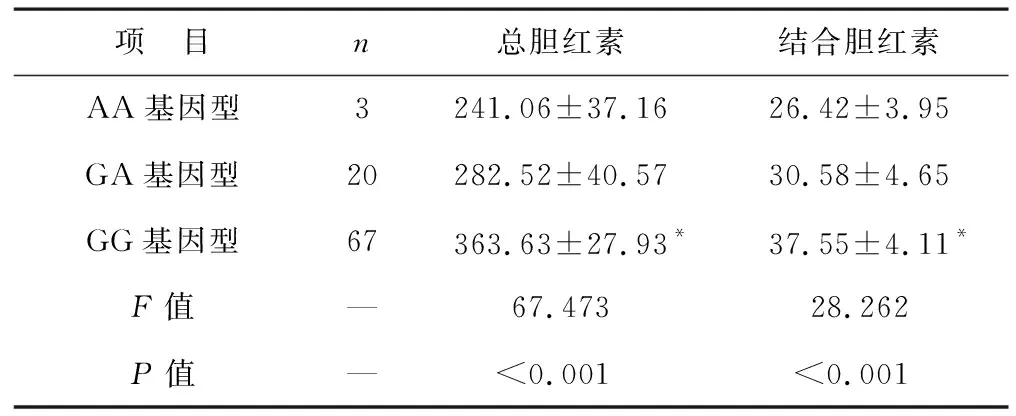
表4 不同BLVRA rs699512基因型患兒血清膽紅素水平比較(μmol/L)
2.5 不同SLCO1B1 rs4149015基因型患兒血清膽紅素水平比較 見表5。不同SLCO1B1 rs4149015基因型患兒總膽紅素和結合膽紅素水平比較差異有統計學意義(均P<0.05)。SLCO1B1 rs4149015中AA基因型總膽紅素和結合膽紅素水平高于GG基因型(均P<0.05)。
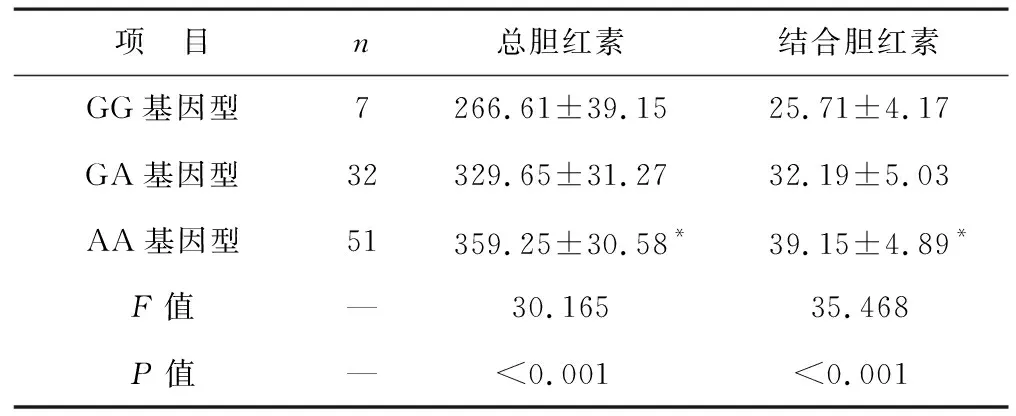
表5 不同SLCO1B1 rs4149015基因型患兒血清膽紅素水平比較(μmol/L)
2.6 BLVRA rs699512、SLCO1B1 rs4149015位點基因多態性與HB易感性的關系 BLVRA rs699512位點GG基因型與HB發生呈正相關,AA基因型與HB發生呈負相關(r=0.671、-0.608,均P<0.001)。SLCO1B1 rs4149015位點AA基因型與HB發生呈正相關,GG基因型與HB發生呈負相關(r=0.695、-0.633,均P<0.001)。
3 討 論
新生兒不明原因HB在臨床較為常見,且近年來發病率逐年升高,成為全球兒科醫師面臨的重要難題[7-8]。HB發生的主要原因包括遺傳和圍生期因素,雖然大多患兒經光療治療后均可痊愈,但仍有部分患兒可能會發展成膽紅素腦病,影響患兒的神經系統,留下后遺癥,甚至對其生命帶來威脅[9-10]。膽紅素在機體內主要由血紅素降解,但80%以上降解由網狀內皮系統中紅細胞血紅蛋白完成,剩余降解由骨髓中低效的紅細胞生成和其他血紅素蛋白完成[11-12]。在血紅素加氧酶催化分解下,血紅素可被分解為等分子量膽綠素、一氧化碳和鐵,其中BLVRA可將膽綠素降解,使其轉變為膽紅素,當其進入血液后可參與機體血液循環,同時與血清白蛋白結合,經轉運后特異性分布于肝臟并在肝細胞基底膜上的有機陰離子轉運攝取,最終進入肝細胞[13]。膽紅素進入細胞后可與受體蛋白相結合并降解于光面內質網,在尿苷二磷酸葡萄糖醛酸轉移酶催化后可進一步生產結合膽紅素,其可在水中相融并隨之排出體外[14]。
BLVRA是一種膽綠素還原酶,在機體內具體機制為:體內BLVRA蛋白可結合血紅蛋白加氧酶-1(HO-1)蛋白,導致其發生催化作用同時對兔血紅素氧合酶1(HMOX1)行應激誘導,增加其表達[15]。因此,理論而言HMOX1多態性可對膽紅素水平產生影響,兩者間應存在密切聯系。本研究發現,BLVRA rs699512位點GG基因型與HB發生呈正相關,AA基因型與HB發生呈負相關。在單核苷酸多態性數據庫中,有研究發現對于BLVRA基因中rs699512位點突變存在異議,其等位基因頻率明顯不同,其中白種人、中國人和日本人分別為0.23、0.27和0.40[16],但Chau等[17]研究指出,BLVRA rs699512位點基因與成人血清膽紅素無顯著關系,本研究與其存在差異,本研究發現HB組患兒BLVRA rs699512位點基因G等位基因頻率明顯高于對照組,GG基因型分布明顯高于對照組,AA基因型分布明顯低于對照組,GG基因型總膽紅素水平和結合膽紅素明顯高于AA基因型,提示BLVRA抑制劑可能對不明HB的發生具有明顯改善作用。分析原因,主要是由于rs699512位點A>G堿基置換可進一步加快氨基酸-蘇氨酸的轉變,而蛋白酶的活性與蘇氨酸之間存在密切關系,從而改變BLVRA蛋白酶活性[18];此外,由于BLVRA是一類HO-1轉錄因子,在機體內細胞信號傳導中參與并發揮作用,可抑制其合成并降低膽紅素的生成[19]。因此,推測BLVRA rs699512位點基因對BLVRA生成產生影響,進而降低膽紅素的合成,但具體機制需進一步研究。
SLCO1B1基因位于染色體12p12,在漿膜中的變異表達減少會在一定程度上降低有機陰離子轉運多肽2轉運活性,未結合膽紅素無法完成轉運,導致其在體內聚集,引起新生兒不明HB的發生[20]。本研究發現,HB組患兒SLCO1B1 rs4149015位點基因A等位基因頻率明顯高于對照組,AA基因型分布明顯高于對照組,GG基因型分布明顯低于對照組,且AA基因型總膽紅素水平和結合膽紅素明顯高于GG基因型。與以往研究不同,Amandito等[21]研究發現SLCO1B1基因位點與新生兒不明原因HB無關。分析原因,可能是由于不同地區人群可能存在遺傳有差異[22]。總之,目前在新生兒不明原因高膽紅素血癥中關于SLCO1B1 rs4149015位點基因的研究較少,且結果爭議較大,今后尚待進一步擴大樣本研究。
綜上所述,新生兒不明原因HB患兒BLVRA rs699512位點GG基因型與SLCO1B1 rs4149015位點AA基因型會顯著增加易感性,臨床可建立早期防治體系以改善患兒預后。

