長鏈非編碼RNA核富集轉錄子1對胃癌SGC7901細胞遷移、侵襲、自噬的影響及機制研究
布力布·吉力斯漢,賽福丁·柯尤木,劉春暉,王培紅
(新疆醫科大學附屬腫瘤醫院消化內科,新疆 烏魯木齊 836000)
胃癌的發生與既往胃部手術史、幽門螺桿菌感染、飲酒、基因異常表達、遺傳變異、攝入過多腌制食品等因素存在聯系,為發病、致死率較高的消化系統惡性腫瘤,早期臨床多表現為消化不良、上腹痛等,隨病情的發展可誘發惡病質、嘔血、上腹部明顯疼痛等,進而導致患者多臟器功能衰竭,最終死亡[1-2]。近年來,胃癌預后因治療技術進步而有所提升,但5年生存率仍舊較低。隨著研究深入,發現胃癌發生、發展中抑癌及原癌基因具有關鍵作用,因此從分子層面闡明胃癌進展機制對患者診斷、治療、5年生存率的提高具有重要意義[3]。長鏈非編碼RNA(long non-coding RNA,lncRNA)在胃癌細胞凋亡、侵襲、致瘤性、凋亡等過程中均發揮著調控作用,而lncRNA核富集轉錄子 1(Nuclear enriched abundant transcript 1,NEAT1)被報道在胃癌中呈高表達,且與患者淋巴結轉移、臨床分期、預后等密切相關[4]。絲裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)通路包括p38、c-Jun氨基末端激酶(C-jun amino terminal kinase,JNK)、細胞外信號調節激酶(Extracellular signal-regulated kinase,ERK),可參與細胞凋亡、增殖、分化等過程[5]。基于此,本研究分析lncRNA NEAT1通過調控MAPK通路對胃癌細胞遷移、侵襲及自噬的影響,以期為胃癌靶向治療提供借鑒。
1 材料與方法
1.1 實驗細胞 人胃癌SGC7901細胞購自中國科學院細胞庫。
1.2 主要試劑 RPMI-1640培養基(批號:20170153)購自武漢益普生物科技有限公司;lncRNA NEAT1沉默載體和上調載體(批號:20200369)購自深圳市豪地華拓生物科技有限公司;PCR試劑盒(批號:20100789)購自上海鈺博生物科技有限公司;四唑鹽(MTT)試劑盒(批號:20211137)購自深圳子科生物科技有限公司;BCA蛋白定量試劑盒(批號:20160739)購自上海碧云天生物技術公司;GAPDH(批號:ab8241)、上皮性鈣黏附素(E-cadherin,批號:ab4679)、基質金屬蛋白酶-9(MMP-9,批號:ab6648)、MMP-2(批號:ab3769)、Beclin-1(批號:ab4078)、Ⅱ型/Ⅰ型微管相關蛋白1輕鏈3(LC3-Ⅱ/LC3-Ⅰ,批號:ab7642)、p38(批號:ab7089)、JNK(批號:ab4012)、ERK抗體(批號:ab8579)均購自(Abcam公司)。
1.3 實驗方法
1.3.1 細胞培養及轉染:采用RPMI-1640培養液(含10% FBS)培養SGC7901細胞,在6孔板上接種對數期SGC7901細胞,2.5×105個/孔,培養液每3天更換1次,待濃度達到80%時,采用Lipofectamine 2000進行轉染,分為沉默組(轉染lncRNA NEAT1沉默質粒)、過表達組(轉染lncRNA NEAT1上調質粒),轉染后12 h內更換培養液,再培養24 h后對SGC7901細胞進行收集備用。
1.3.2 轉染效率測定:細胞lncRNA NEAT1表達采用實時熒光定量PCR(RT-qPCR)法檢測。采用TRIzol試劑盒對待檢細胞RNA進行提取和純化,后行反轉錄處理獲取總cDNA,采用Primer 5.0軟件設計引物序列,啟動PCR儀,采用2-ΔΔCt方法計算lncRNA NEAT1表達量。試驗重復3次。
1.3.3 細胞遷移、侵襲力檢測:細胞轉染48 h后,取轉染、未轉染后的SGC7901細胞接種至6孔板上(2.5×105個/孔)。培養4 h后將培養液棄去,后對各組細胞進行收集,將細胞密度調整至5.0×104個/ml。24孔板中放置Transwell小室,上室放置基質膠,自然晾干后加入細胞懸液(100 μl),下室加培養基500 μl,培養24 h后取出,用4%多聚甲醛固定、結晶紫染色,顯微鏡下觀察,拍照計數。遷移能力檢測時采用未鋪有基質膠的Transwell小室,其余操作同侵襲檢測。
1.3.4 相關蛋白表達量檢測:通過Western blot法進行檢測。SDS-PDGE電泳于每孔加入80 μg蛋白后進行,電泳結束后將蛋白電轉至PVDF膜上,5%脫脂奶粉對PVDF膜進行封閉,E-cadherin、MMP-9、MMP-2、Beclin-1、LC3-Ⅱ/LC3-Ⅰ、p38、JNK、ERK一抗(1∶1000)于搖床上室溫孵育,共孵育120 min,完成后采用TBST洗膜3次,5 min/次,后將E-cadherin、MMP-9、MMP-2、Beclin-1、LC3-Ⅱ/LC3-Ⅰ、p38、JNK、ERK二抗(1∶1000)于搖床上室溫孵育,共孵育60 min,完成后采用TBST洗膜3次,10 min/次。化學發光顯影采用ECL,以GAPDH為內參,相對條帶灰度光密度值采用Image J軟件分析。
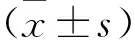
2 結 果
2.1 三組細胞lncRNA NEAT1表達量比較 對照組、過表達組、沉默組lncRNA NEAT1表達量依次為1.17±0.15、1.82±0.17、0.81±0.10。與對照組比較,過表達組lncRNA NEAT1表達量增加,沉默組lncRNA NEAT1表達量下降(均P<0.05)。與過表達組比較,沉默組lncRNA NEAT1表達量下降(P<0.05)。
2.2 三組細胞遷移、侵襲數比較 見表1(圖1、2)。與對照組比較,過表達組細胞遷移、侵襲數增加,沉默組細胞遷移、侵襲數下降(均P<0.05)。與過表達組比較,沉默組細胞遷移、侵襲數下降(均P<0.05)。

表1 三組細胞遷移、侵襲數比較(個)
2.3 三組細胞遷移、侵襲相關蛋白表達量比較 見表2。與對照組比較,過表達組E-cadherin蛋白表達量降低,MMP-9、MMP-2蛋白表達量升高;沉默組E-cadherin蛋白表達量升高,MMP-9、MMP-2蛋白表達量降低(均P<0.05)。與過表達組比較,沉默組E-cadherin蛋白表達量升高,MMP-9、MMP-2蛋白表達量降低(均P<0.05)。
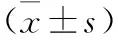
表2 三組細胞遷移、侵襲相關蛋白表達量比較
2.4 三組細胞自噬相關蛋白表達量比較 見表3。與對照組比較,過表達組Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表達量降低,沉默組Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表達量升高(均P<0.05)。與過表達組比較,沉默組Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表達量升高(均P<0.05)。
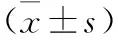
表3 三組細胞自噬相關蛋白表達量比較
2.5 三組細胞MAPK通路相關蛋白表達量比較 見表4。與對照組比較,過表達組p38、JNK蛋白表達量降低,ERK蛋白表達量升高;沉默組p38、JNK蛋白表達量升高,ERK蛋白表達量降低(均P<0.05)。與過表達組比較,沉默組p38、JNK蛋白表達量升高,ERK蛋白表達量降低(均P<0.05)。
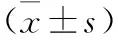
表4 三組細胞MAPK通路相關蛋白表達量比較
3 討 論
胃癌是由多基因、多因素共同誘發的臨床常見惡性腫瘤,近年來發病率呈上升趨勢,對患者生活質量造成了嚴重影響[6-7]。胃壁表層黏膜上皮細胞為胃癌起源,可進展到胃的各部位,具有較高的轉移及侵襲特性,多數胃癌患者早期癥狀并不明顯,確診時多為局部晚期或發生遠處轉移的晚期,錯過了最佳治療時機,遠期生存率較低,故對胃癌的發生遷移和侵襲的機制進行探討對于患者個體化治療、生存期延長、預后改善具有重要意義[8-10]。
lncRNA為近年來胃癌的研究熱點。lncRNA是可在轉錄及轉錄后水平上對染色質結構、調節基因表達進行改變的轉錄物,其表達失調可改變胃癌細胞相關表型,進而參與胃癌的發生、發展[11-12]。lncRNA NEAT1在乳腺癌、甲狀腺癌、胃癌、口腔鱗癌等多種腫瘤細胞系及組織中均呈高表達,在胃癌中lncRNA NEAT1與淋巴結轉移、臨床分期、預后生存等密切相關,可通過激活絲切蛋白2(CFL2)而促進癌細胞增殖,最終發揮促癌作用[13-14]。本研究發現,胃癌細胞經沉默lncRNA NEAT1干預后遷移、侵襲數量減少,自噬增強,表明lncRNA NEAT1可對胃癌細胞遷移、侵襲、自噬進行調控。
胃癌的發生和發展與細胞遷移、侵襲等存在聯系。E-cadherin是具有維持組織上皮完整性、細胞間黏附連結的黏附分子家族成員之一,在多種腫瘤中缺失或表達下調,進而破壞了腫瘤細胞間黏附功能,使得原發灶腫瘤細胞脫離并轉移,最終對腫瘤發生、發展起到了促進作用[15-16]。腫瘤細胞外基質重塑在腫瘤生長、浸潤、轉移中發揮著重要作用,而基質金屬酶可參與腫瘤細胞外基質重塑,其中MMP-9、MMP-2為Ⅳ型膠原的特異性水平解酶,MMP-9、MMP-2過表達可造成病變組織周圍Ⅳ型膠原分解,進而促進胃癌侵襲、轉移,且Ⅳ型膠原分解產生的脯氨酸可為胃癌能量代謝提供營養,有利于細胞存活[17-18]。本研究發現,經沉默lncRNA NEAT1干預后胃癌細胞E-cadherin表達量上升,MMP-9、MMP-2表達量下降,提示lncRNA NEAT1可通過調控E-cadherin、MMP-9、MMP-2表達而減弱腫瘤細胞侵襲。
自噬是可參與代謝調節、生物體發育、細胞衰老及凋亡的程序性細胞死亡方式,放射線、化療藥物、內質網應激、放射線等均可激活細胞自噬,在饑餓或應激狀態下自噬可通過分解胞質內生物大分子而提供自身生存所需營養,此外自噬可對衰老細胞器及受損結構、細胞內長半衰期蛋白進行清除,自噬水平變化可改變細胞功能,進而對腫瘤發生、發展造成影響,而Beclin-1、LC3為自噬標志物,可以對自噬水平的高低進行反映[19]。Beclin-1為自噬特異性基因,可與/磷酸酰肌醇3-激酶(PI3K)結合形成復合物,進而對胞質中的FYVE基序進行募集,促進自噬體膜形成且可誘導自噬體膜上自噬蛋白定位。細胞中過表達的Beclin-1對自噬具有誘導作用,但在多種惡性腫瘤中Beclin-1均呈缺失狀態,導致其對腫瘤細胞凋亡的抑制作用減弱。LC3可參與自噬胞膜延伸及成熟,在自噬成熟中發揮著重要作用,LC3-Ⅱ、LC3-Ⅰ為LC3兩種存在形式,新合成的細胞內LC3可經加工成為LC3-Ⅰ,而后者則被加工成為LC3-Ⅱ,LC3-Ⅱ含量隨自噬體膜的增加而增加,故LC3-Ⅱ/LC3-Ⅰ可在一定程度上對細胞自噬活性進行反映[20-21]。本研究發現,胃癌細胞經沉默lncRNA NEAT1干預后Beclin-1、LC3-Ⅱ/LC3-Ⅰ上升,提示lncRNA NEAT1可通過調控自噬標志物表達而誘導腫瘤細胞發生自噬。
細胞增殖、凋亡等與腫瘤細胞內信號通路改變存在密切聯系,MAPK通路是細胞將信號從細胞膜傳遞至核內的細胞自噬相關信號通路,家族成員包括p38、JNK、ERK,在細胞增殖、凋亡、自噬、惡性轉化中發揮著重要作用[22]。p38、JNK可經病理損傷及細胞應激信號激活,p38激活后可增加TNF-α表達、激活c-Jun而促進腫瘤細胞凋亡,且激活的p38可造成細胞凋亡及細胞周期阻滯;JNK激活后可上調促凋亡蛋白及半胱氨酸蛋白酶3(Caspase-3)表達,而Caspase-3為凋亡效應分子,可加速腫瘤細胞凋亡;ERK經生長因子等促有絲分裂刺激因素激活后可促進腫瘤細胞增殖,抑制凋亡[23]。本研究發現,胃癌細胞經沉默lncRNA NEAT1干預后p38、JNK表達量增加,ERK表達量降低,提示lncRNA NEAT1可抑制胃癌細胞遷移、侵襲,增強自噬,其機制可能與調控MAPK通路有關。
綜上所述,抑制lncRNA NEAT1可有效抑制胃癌細胞的遷移、侵襲、自噬,其機制可能與調控MAPK信號通路有關,為臨床上靶向治療胃癌提供新的研究方向。

