補腎健脾開心方對AD 大鼠自噬及凋亡相關蛋白的影響
李 瑩,王 瑩,孔明望
(湖北中醫藥大學基礎醫學院,武漢 430065)
阿爾茨海默病(Alzheimer’s disease, AD)是一種進行性神經系統退行性疾病。我國現已成為世界上AD 患者數量最多的國家[1]。AD 的病理機制復發多樣,目前尚無特異性的治療藥物。自噬和凋亡在AD 的病理進展中起重要作用。自噬與AD 基本病理特點的關系密切,影響Aβ 的產生和代謝以及Tau 蛋白的組裝,自噬功能失調可能加速AD 的進展[2]。失調的凋亡級聯反應可以導致異常神經元丟失,且可能先于AD 病理性特征出現,與癡呆程度密切相關[3]。因此,調控細胞自噬及凋亡,已成為研究防治AD 的重要途徑。
補腎健脾開心方是本課題組對《本草綱目》中益智及輕身延年藥物進行分析總結,并選取其中組成唐代孫思邈《千金要方》的名方“開心散”及六味地黃丸中“三補”的藥物配伍而成的自擬方。全方取先天后天互滋互用為思路,滋脾腎、開心腦、益神智,從而共同延緩AD 的進程。本課題組前期研究表明,補腎健脾開心方可有效改善AD 模型大鼠學習、記憶、認知能力[4],證實該方可明顯下調AD 大鼠海馬磷脂酰肌醇3 激酶(phosphatidylinositol 3-kinase, PI3K)、蛋白激酶B(protein kinase B, Akt)的表達[5-6],影響腦皮質區凋亡[7]。但補腎健脾開心方能否通過調控自噬緩解AD 進展,方中何種治法影響自噬和凋亡尚不明確。D-gal 干預可造成大鼠腦部Aβ、Tau 蛋白的異常表達、神經元損傷[8]。本實驗旨在通過D-半乳糖(D-galactose, D-gal)誘導AD 模型探討補腎健脾開心方是否影響自噬及凋亡,并探討其可能的作用機制。
1 材料和方法
1.1 實驗動物
70 只SPF級雄性SD 大鼠,3 月齡,體重(220±20)g,購于遼寧長生生物技術股份有限公司[SCXK(遼)2020-0001],飼養于湖北中醫藥大學SPF 級實驗動物中心實驗室[SYXK(鄂)2022-0067],環境溫度(23±2)℃,濕度(55%±5%),12 h 循環照明。用Morris 水迷宮測試其學習記憶能力,淘汰反應過于遲鈍及特別敏感的大鼠4 只,自由攝食、飲水,適應性飼養1 周后開始實驗。本實驗獲得湖北中醫藥大學實驗動物倫理委員會批準 ( HUCMS(00137435))。本實驗中,動物飼養和實驗過程均做到了按照實驗動物使用的3R 原則給予人文關懷。
1.2 主要試劑與儀器
補腎健脾開心方由熟地20 g、山藥20 g、山茱萸20 g、人參10 g、茯苓15 g、遠志6 g、石菖蒲20 g 組成;補腎方由熟地20 g、山茱萸20 g 組成;健脾方由山藥20 g、人參10 g、茯苓15 g 組成;開心方由遠志6 g、石菖蒲20 g 組成。藥物均采購于湖北中醫藥大學附屬國醫堂,經湖北中醫藥大學生藥教研室鑒定為純正藥材。常規煎煮之后,分裝備用。
D-半乳糖(美國Sigma 公司,批號:G0750);4%多聚甲醛(中國索萊寶公司,批號:P1110);二甲苯(國藥集團,批號:10023418);檸檬酸(上海滬試公司,批號:10007118);BSA(北京夏末科技有限公司,批號:DX6608);一抗兔抗大鼠LC3(武漢Bioss 公司,批號:bs-2912R);一抗兔抗大鼠Beclin1(武漢Bioswamp 公司,批號:PAB35215);一抗兔抗大鼠BAX(武漢Bioswamp 公司,批號:PAB37588);一抗兔抗大鼠 Bcl-2 (武漢 Bioswamp 公司, 批號:PAB33926);二抗山羊抗兔(武漢三鷹生物技術開發公司,批號:SA00013-4); cDNA 合成試劑盒(北京夏末公司,批號:SUM73061)。
Morris 水迷宮數據自動采集系統(中國醫學科學院藥物研究所);曠場實驗系統(成都泰盟科技有限公司);DYY-6C 型電泳儀(北京市六一儀器廠);TKD-TSF 自動組織脫水機(湖北康強醫療器械有限公司);電轉儀(美國Bio-Rad 公司);BRM2235 自動切片機(德國徠卡顯微系統有限公司);TB-718D 生物組織包埋機(泰維科技);DM1000 正置顯微鏡(德國徠卡顯微系統有限公司);DMIL LED 倒置顯微鏡(德國徠卡顯微系統有限公司)。
1.3 實驗方法
1.3.1 造模
動物適應性喂養1 周后,參照《藥理學實驗》[9]建立D-gal 大鼠AD 模型:將15 g 的D-gal 溶于500 mL 的0.9%生理鹽水,配成30 mg/mL 質量濃度的溶液,按300 mg/kg 劑量進行腹腔注射。同時隨機取10 只大鼠為空白組(Ctrl 組),注射等容積生理鹽水,每日1 次,持續6 周。
1.3.2 分組與給藥
取造模成功的50 只大鼠參照隨機數字表分為5 組:模型組(AD 組)、補腎組(BS 組,3.6 g/(kg·d))、健脾組(JP 組,4.05 g/(kg·d))、開心組(KX組,2.34 g/(kg·d))、補腎健脾開心組(BSJPKX組,9.99 g/(kg·d)),每組10 只。BS 組、JP 組、KX組、BSJPKX 組分別以相應藥物灌胃,空白組、模型組給予等容積生理鹽水,每日1 次,給藥4 周。
1.3.3 Morris 水迷宮測試
定位航行測試為實驗前1~5 d:記錄大鼠從不同象限入水到爬上平臺并停留超過10 s 所需的時間(即逃避潛伏期),連續5 d,每次測試120 s。空間搜索實驗為第6 天:第6 天撤除平臺,記錄動物跨越原平臺的次數,測試時長120 s。
1.3.4 曠場實驗
水迷宮實驗結束后1 d,將單只大鼠放置于曠場實驗生物數據采集系統實驗箱中心區域,記錄其自由活動情況,記錄時間為6 min,記錄內容主要為其運動距離和中心區域的運動時間。
1.3.5 蛋白印跡法(Western blot)
行為學測試結束,麻醉大鼠,每組取3 只生理鹽水心臟灌注,將腦皮質組織于冰上迅速取樣,約20 mg,剪碎后加入裂解液勻漿,12 000 r/min,4℃,離心15 min 取其上清。各組樣品蛋白濃度通過BCA法(bicinchoninic acid)測定后將其調為一致濃度。經10% SDS 聚丙烯酰胺(SDS-polyacrylamide gel electrophoresis, SDS-PAGE)凝膠電泳分離,聚偏二氟乙烯膜轉膜,5%脫脂奶粉于室溫封閉1.5 h。分別加入一抗(β-actin:1 ∶500,Beclin1:1 ∶1000,LC3:1 ∶1000)4℃孵育過夜。次日滴加辣根過氧化物酶標記的二抗(1 ∶10 000)37℃孵育1.5 h。加入增強型化學發光試劑顯色底物后,按常規X 線片顯影方法顯影。Image J 圖像分析軟件對樣品條帶的灰度值進行數字化分析。以β-actin 為內參蛋白。
1.3.6 免疫組化
行為學測試結束,麻醉大鼠,每組取3 只多聚甲醛心臟灌注,取腦皮質組織,石蠟包埋切片(厚度4 μm)。免疫組織化學染色檢測腦皮質B 淋巴細胞瘤-2(B 淋巴細胞瘤-2,Bcl-2)、BCL2-Associated X的蛋白質(Bax)的表達,組織中棕黃色或棕褐色顆粒為目標蛋白。石蠟切片經二甲苯脫蠟、梯度酒精水化、檸檬酸抗原修復、0.5%牛血清白蛋白(bovine albumin, BSA)濕盒孵育30 min 后,Bax 抗體(1 ∶100)、Bcl-2 抗體(1 ∶200)滴加覆蓋組織塊,4℃孵育12 h,二抗孵育30 min,再經DAB 染色、蘇木素復染、脫水、樹脂封片后,顯微鏡采集圖像。每張片子隨機選取3 個視野(×200),采用Image J 軟件分析光密度,取其平均值。
1.3.7 實時熒光定量PCR(qRT-PCR)
行為學測試結束,每組隨機取7 只大鼠斷頭處死,冰上迅速取腦皮質組織,使用TRIzol 試劑從腦組織中提取總RNA。用cDNA 合成試劑盒從1 μg總RNA 中合成cDNA。采用SYBR qPCR Mix 在Bio-Rad CFX Connect Real-time System 上進行實時定量PCR。qRT-PCR 條件為:95℃,10 min。靶基因的相對表達以GAPDH 為內參進行歸一化,以2-ΔΔCT方法計算倍數變化。使用的引物序列如下:Beclin1正向引物序列(5’ -3’):GAATGGAGGGGTCTAA GGCG 和反向引物序列(5’-3’):CTTCCTCCTGG CTCTCTCCT;P62 正 向 引 物 序 列(5’ - 3’):TCCTGCAGACCAAGAACTATGACATCG 和反向引物序 列( 5’ - 3’): TCTACGCAAGCTTAACACAA CTATGAGACA;Bax正 向 引 物 序 列(5’ - 3’):TTGCTACAGGGTTTCATCC 和反向引物序列(5’-3’):GTCCAGTTCATCGCCAAT;Bcl-2 正向引物序列(5’-3’):CAGAATCAAGTGTTCGTCAT 和反向引物序列(5’-3’):AGTCTTCATCTCCAGTATCC;GAPDH正向引物序列(5’-3’):CAAGTTCAA CGGCACAG和 反 向 引 物 序 列 ( 5 ’ - 3 ’): CCAGTA GACTCCACGACAT。
1.4 統計學方法
本實驗采用SPSS 25.0 統計軟件進行數據處理,用Graphpad Prism 8 繪制統計圖。數據計算使用平均數±標準差(±s)。符合正態分布的多組間比較采用單因素方差分析,組間兩兩比較采用LSD檢驗。以P<0.05 為差異具有統計學意義。
2 結果
2.1 各組大鼠學習記憶能力比較
如圖1 所示,在定位航行實驗中,逃避潛伏期隨著各實驗動物累積訓練時長的不斷增加,其總體趨勢顯示下降。開始訓練前2 d,各組實驗動物間逃避潛伏期未見顯著差異(P>0.05)。與Ctrl 組比較,從第3 天開始,AD 組大鼠逃避潛伏期明顯延長(P<0.01)。與AD 組比較,如圖1 所示從第3 天開始至實驗結束,BS 組、JP 組、KX 組、BSJPKX 組4 組大鼠逃避潛伏期顯著縮短(P<0.01)。與BSJPKX 組比較,在實驗第3 天與JP 組之間有明顯差異(P<0.01);在實驗第4、5 天,BS 組、JP 組、KX 組3 組大鼠逃避潛伏期較長,且與之有明顯差異(P<0.01)。
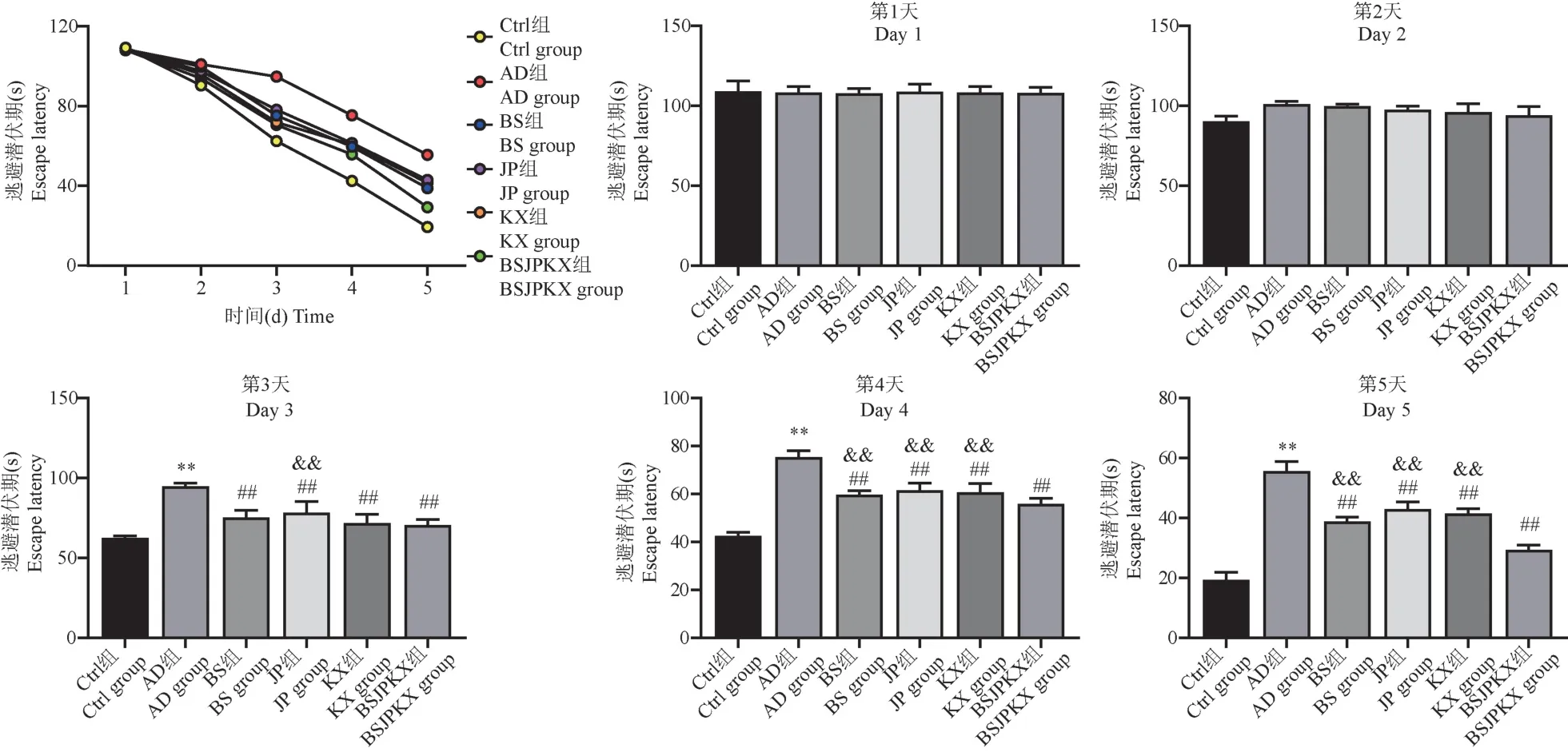
注:與Ctrl 組比較,**P<0.01;與AD 組比較, ##P<0.01;與BSJPKX 組比較, &&P<0.01。圖1 各組大鼠定位航行實驗逃避潛伏期(n=10)Note.Compared with Ctrl group, **P<0.01.Compared with AD group, ##P<0.01.Compared with BSJPKX group, &&P<0.01.Figure 1 Incubation period of experimental evasion by positioning navigation for each group of rats
如圖2 所示,在空間探索實驗中,與Ctrl 組比較,AD 組大鼠在水池中隱藏平臺撤除后,找到并穿越原平臺象限的次數明顯減少(P<0.01);與AD 組比較,BS 組、JP 組、KX 組、BSJPKX 組跨越原平臺次數明顯升高(P<0.01);與BSJPKX 組比較,BS 組找到并穿越原平臺象限的次數與之有明顯差異(P<0.01),JP 組、KX 組找到并穿越原平臺象限的次數與之無明顯差異(P>0.05)。
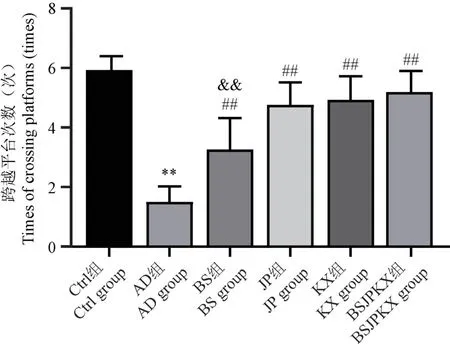
注:與Ctrl 組比較,**P<0.01;與AD 組比較,##P<0.01;與BSJPKX組比較,&&P<0.01。圖2 各組大鼠空間探索實驗跨越平臺次數(n=10)Note.Compared with Ctrl group, **P<0.01.Compared with AD group,# #P<0.01.Compared with BSJPKX group,&&P<0.01.Figure 2 Number of spatial exploration experiments across platforms for each group of rats
2.2 各組大鼠認知功能比較
如圖3 所示,與Ctrl 比較,發現AD 組大鼠其曠場實驗測試數據中總運動距離以及大鼠于中心區域運動時間的比率明顯下降(P<0.01)。與AD 組比較,BS 組、JP 組、KX 組、BSJPKX 組各組大鼠曠場實驗測試數據中運動距離和中心區域運動時間比率上調(P<0.05)。與BSJPKX 組比較,BS 組大鼠曠場實驗測試數據中運動距離和中心區域運動時間比率無明顯差異(P>0.05);JP 組大鼠運動距離和中心區域運動時間比率有明顯差異(P<0.01);KX 組大鼠運動距離有明顯差異(P<0.05),中心區域運動時間比率無明顯差異(P>0.05)。
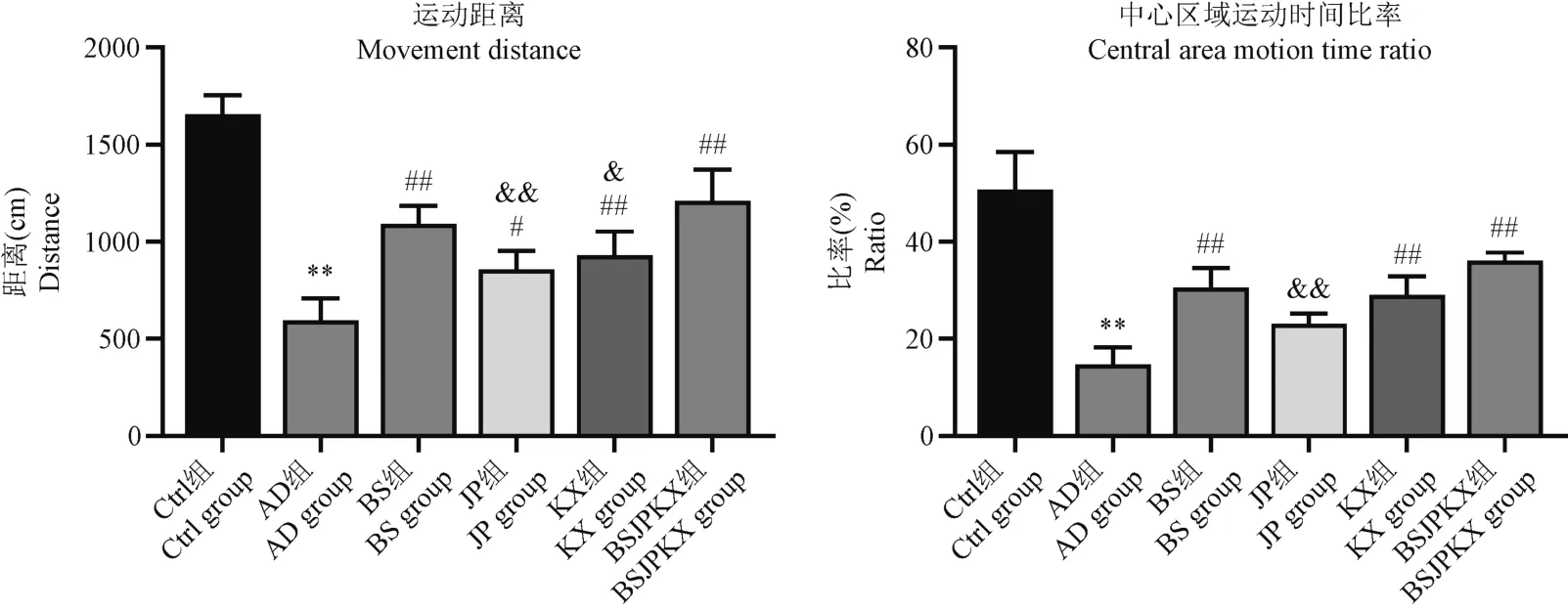
注:與Ctrl 組比較,**P<0.01;與AD 組比較,#P<0.05,##P<0.01;與BSJPKX 組比較,&P<0.05,&&P<0.01。圖3 各組大鼠曠場試驗比較(n=4)Note.Compared with Ctrl group,**P<0.01.Compared with AD group,# P<0.05,##P<0.01.Compared with BSJPKX group,& P<0.05,&&P<0.01.Figure 3 Comparison of open-field tests for each group of rats
2.3 各組大鼠腦皮質Beclin1、LC3-I、LC3-II 蛋白表達比較
如圖4 所示,與Ctrl 組相比,AD 組Beclin1、LC3-I/LC3-II 比值顯著下調(P<0.01)。與AD 組比較,BS 組、JP 組Beclin1 上調(P<0.01),LC3-I/LC3-II 比值無明顯回升(P>0.05);KX 組、BSJPKX 組Beclin1、LC3-I/LC3-II 比 值 增 加(P<0.01)。與BSJPKX 組比較,BS 組、JP 組、KX 組Beclin1、LC3-I/LC3-II 比值表達量有明顯差異(P<0.01)。
2.4 各組大鼠腦皮質Bax、Bcl-2 蛋白表達比較
如圖5 所示,與Ctrl 組相比,AD 組Bax 增多(P<0.01),Bcl-2 及Bcl-2/Bax 比 值 明 顯 降 低(P<0.01)。與AD 組比較,BS 組、JP 組、KX 組、BSJPKX組Bax 下調(P<0.01),Bcl-2 及Bcl-2/Bax 比值上調(P<0.01)。與BSJPKX 組比較,BS 組Bax、Bcl-2 及Bcl-2/Bax 比值無明顯差異(P>0.05);JP 組Bax、Bcl-2 及Bcl-2/Bax 比值有明顯變化(P<0.01);KX組Bax 無明顯差異(P>0.05),Bcl-2 及Bcl-2/Bax 比值有顯著差異(P<0.01)。
2.5 各組大鼠腦皮質Beclin1、P62、Bax、Bcl-2 基因表達比較
如圖6 所示,與Ctrl 組相比,AD 組Beclin1、Bcl-2 明顯降低(P<0.01),P62、Bax增多(P<0.01)。與AD 組比較,BS 組、JP 組、KX 組、BSJPKX 組Beclin1、Bcl-2 比值上調(P<0.05),P62、Bax下調(P<0.05)。與BSJPKX 組比較,BS 組Beclin1、Bax、Bcl-2 無明顯差異(P>0.05),P62 有明顯差異(P<0.05);JP 組Beclin1 無明顯差異(P>0.05),P62、Bax、Bcl-2 有明顯變化(P<0.05);KX 組Beclin1、P62 無明顯差異(P>0.05),Bax、Bcl-2 有明顯差異(P<0.01)。
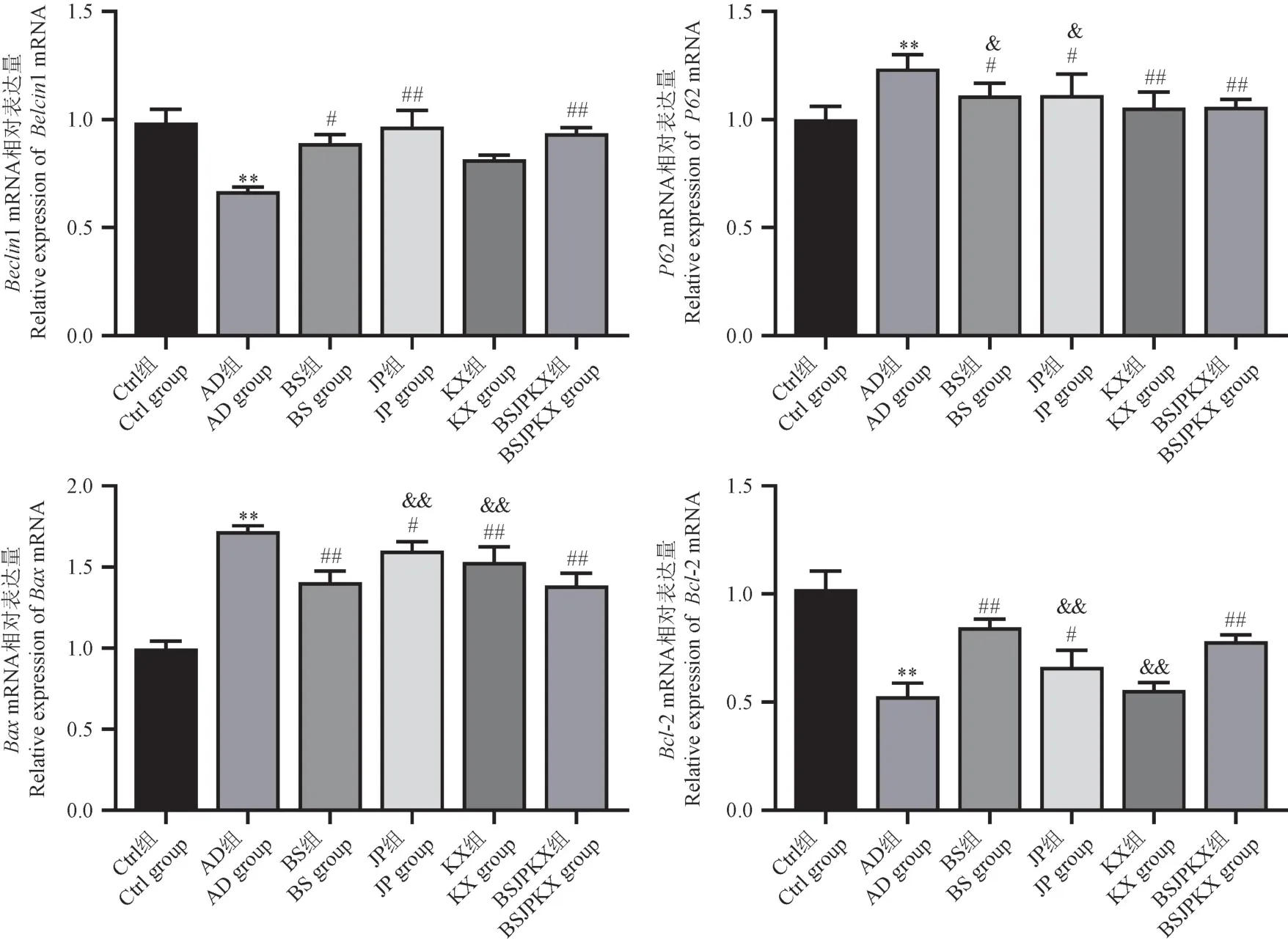
注:與Ctrl 組比較,**P<0.01;與AD 組比較,#P<0.05,##P<0.01;與BSJPKX 組比較,&P<0.05,&&P<0.01。圖6 各組AD 大鼠腦皮質Beclin1、P62、Bax、Bcl-2 mRNA 水平(n=7)Note.Compared with Ctrl group,**P<0.01.Compared with AD group, #P<0.05,##P<0.01.Compared with BSJPKX group, &P<0.05,&&P<0.01.Figure 6 Cortical relative mRNA levels of Beclin1, P62, Bax and Bcl-2 in AD rats of all groups
3 討論
AD 目前治療方法有限,多數為緩解其臨床癥狀,延緩病理進展。中醫藥防治AD 有其獨特的優勢,多種單藥提取物或多藥聯合運用可以延緩AD病理進展,防治癡呆[10-12]。本課題組從《本草綱目》益智及輕身延年藥物中發現,歸心、脾、腎三經的藥物占重要比例。選取其中開心散的組成藥物石菖蒲、遠志、人參、茯苓及六味地黃丸三補藥物熟地、山藥、山茱萸組成自擬方,依據其功效取名為補腎健脾開心方。石菖蒲補腎健腦益智開竅,遠志補腎通心,人參補五臟首入脾,茯苓補心通腎,熟地滋陰補腎,山茱萸以補養肝腎,山藥以補益脾陰固腎。補腎健脾開心方,補腎健脾,取先天后天互滋互用,滋脾腎、開心腦、益神智。本課題組前期研究表明,補腎健脾開心方可有效改善AD 模型大鼠學習、記憶、認知能力[4],證實該方可明顯下調AD 大鼠海馬PI3K、Akt 的表達[5-6],影響腦皮質區凋亡[7]。但本方中何種治法影響自噬和凋亡尚不明確,因此依據藥物歸經及功效,對補腎健脾開心方進行拆分,將同歸于肝、腎兩經的熟地、山茱萸組成補腎方;將同歸于脾經的山藥、人參、茯苓組成健脾方;將同歸于心經的遠志、石菖蒲組成開心方,以觀察補腎、健脾、益智治法及補腎健脾開心方全方對AD 的治療作用,并探討其可能的作用機制。
細胞凋亡和自噬是維持生物體穩態和促進生存的重要細胞內過程。細胞凋亡和自噬的不平衡與神經退行性疾病有關[13]。恢復自噬和細胞凋亡之間的平衡是治療AD 的有希望的策略。現代研究表明,補腎健脾開心方中多味藥物的活性成分可影響細胞自噬、抑制凋亡[14-17],但是目前尚未有報道研究補腎健脾開心方全方合用及其拆方對腦皮質區自噬及凋亡的影響。本研究利用D-gal 誘導的AD 大鼠模型,研究補腎健脾開心方對AD 的作用及其機制。結果表明,AD 組大鼠學習記憶能力明顯下降,微管相關蛋白1 輕鏈3II(LC3-II)、Beclin1、Bcl-2 表達減少,Bax 表達增加,提示AD 大鼠模型建立成功。
自噬是由溶酶體介導,可以清除細胞內異常折疊的蛋白質和衰老或受損的細胞器,從而維持細胞穩態的一個高度保守的分解過程,[18]。AD 動物模型研究發現,自噬可以清除神經元細胞內Aβ 沉積和可溶性Tau 蛋白以及NFTs 聚合物[19]。LC3 被廣泛用于監測自噬。在自噬開始時,LC3-I 轉化為LC3-II,并且LC3-II 隨著自噬的進展而消失,LC3-II的數量與自噬囊體的數量明顯相關[20]。此外,自噬誘導的一個關鍵因素是Beclin1 蛋白,亦在自噬的啟動中起著核心作用[21]。本研究發現補腎健脾開心方可明顯提高AD 大鼠腦皮質區LC3-II、Beclin1 表達,提示補腎健脾開心方可能通過激活腦神經元細胞自噬,緩解D-gal 誘導的AD 大鼠減輕學習記憶能力障礙和認知行為缺陷。拆方實驗結果顯示,開心組較補腎組及健脾組更明顯地激活自噬,提示補腎健脾開心方中對影響細胞自噬起重要作用的藥物可能為遠志和石菖蒲。
細胞凋亡涉及到多種分子和細胞機制,是細胞死亡的機制之一[22]。在AD 早期階段發現了神經元凋亡,并且在AD 患者的尸檢中也顯示出大量腦凋亡神經元[23-25]。Bcl-2、Bax 是一對經典的凋亡靶蛋白,二者在被激活或抑制的不同情況下發揮其相應的生物學效應。具體來說,Bax 增強線粒體的通透性,激活細胞凋亡;Bcl-2 通過結合Bax 形成復合物,降低Bax 誘導的線粒體通透性,抑制細胞凋亡[23]。因此,Bcl-2/Bax 值的動態改變反映細胞凋亡狀態變化,若Bcl-2/Bax 值增大,則表明細胞凋亡的抑制作用明顯;反之,則促進凋亡。本研究發現補腎健脾開心方可明顯逆轉Bcl-2、Bax 水平的失調,引發Bcl-2/Bax 值變化,提示補腎健脾開心方可以抑制AD 大鼠腦皮質區細胞凋亡。此外,拆方實驗結果顯示,補腎組較健脾組及開心組更明顯地抑制凋亡,提示補腎健脾開心方中對影響細胞凋亡起重要作用的藥物可能為熟地和山茱萸。
自噬和凋亡在發育和細胞穩態中起重要作用[25]。異常的自噬和凋亡是神經元細胞損傷的先決條件因素[26]。因此,保持自噬和細胞凋亡之間的平衡對于細胞至關重要,特別是對于神經元等細胞。研究表明自噬和細胞凋亡之間存在相互作用的分子機制,如Bcl-2[13]。Bcl-2 是一種公認的抗凋亡因子,通過與Beclin1 結合來抑制自噬[27]。此外,Bcl-2 可以與Bax 相互作用以抑制細胞凋亡[28]。Bcl-2 在Ser70 上的磷酸化可破壞Bcl-2-Beclin-1 復合物以促進自噬,并穩定Bcl-2-Bax 相互作用以抑制細胞凋亡[29]。本研究發現補腎健脾開心方可明顯促進Beclin1 和Bcl-2 的表達,抑制Bax,提示補腎健脾開心方可以維持自噬和細胞凋亡之間的平衡。此外,拆方實驗結果顯示,開心組較補腎組及健脾組更明顯地激活自噬,而補腎組較健脾組及開心組更明顯地抑制凋亡,提示補腎健脾開心方合方使用才是維持細胞自噬和凋亡平衡的關鍵。
綜上所述,補腎健脾開心方配伍使用可以明顯改善D-gal 誘導的AD 大鼠的學習記憶能力,其機制可能與激活神經自噬、抑制細胞凋亡有關。

