紫朱軟膏對糖尿病潰瘍小鼠創面炎癥反應及上皮-間充質轉化的影響
黃仁燕,王宏飛,王徐紅,柳國斌
(上海中醫藥大學附屬曙光醫院血管外科,上海 201203)
糖尿病足潰瘍是糖尿病患者截肢的主要原因,同時也是糖尿病患者死亡的重要原因之一[1-2]。糖尿病足潰瘍發病率約19%~34%,截肢率達52%以上,5年內再次截肢率約45.72%[3]。此外,糖尿病足潰瘍患者5年內病死率高達30.5%[4]。糖尿病足潰瘍治愈率低、復發率較高、預后不良,嚴重影響糖尿病患者的生活質量[5-6]。再上皮化障礙是糖尿病足潰瘍難愈合的主要原因之一[7-8]。糖尿病足潰瘍在愈合早期常出現過度的炎癥反應,愈合中晚期常出現再上皮化障礙,從而延緩整個愈合進程[9]。再上皮化是上皮細胞在肉芽組織上通過遷移和增殖覆蓋創面使其完全愈合的過程,而糖尿病足潰瘍因長期處于高糖環境,成纖維細胞、上皮細胞等細胞的遷移減少,導致再上皮化障礙,使創面經久難愈[10-11]。糖尿病足潰瘍屬于中醫“脫疽”“筋疽”范疇,邪氣致瘀為本病基本病因病機,因此治療應“扶正祛邪”并用。紫朱軟膏是上海中醫藥大學附屬曙光醫院研制的治療糖尿病足潰瘍的外用藥膏,由朱砂、紫草、阿膠、冰片、龍血竭、黃芪等組成,具有清熱解毒、祛腐生肌之效。研究顯示,紫朱軟膏能有效提高糖尿病足潰瘍臨床療效[12],但其具體作用機制尚未明確。因此,本研究通過觀察紫朱軟膏對糖尿病潰瘍小鼠炎癥反應、上皮-間充質轉化的影響,為中醫藥治療糖尿病足潰瘍提供一定理論依據。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物:C57B/L小鼠由上海中醫藥大學實驗中心提供,倫理編號:PZSHUTCM190308012,體重(27±8.0)g,12 h∶12 h的光-暗循環飼養,濕度(60±3)%,溫度(25±2)℃,自由飲水和進食。
1.1.2 實驗藥物與試劑:紫朱軟膏(批號130301,規格30 g)由朱砂、紫草、阿膠、冰片、龍血竭、黃芪等組成。白介素(Interleukin,IL)-6抗體(批號CSBE04639,美國Proteintech公司);腫瘤壞死因子-α(Tumor necrosis factor-α,TNF-α)抗體(批號CSBE04741,美國Proteintech公司);IL-4抗體(批號M201804,蘇州卡爾文生物);IL-10抗體(批號M201807,蘇州卡爾文生物);一氧化氮合酶(Nitric oxide synthase,iNOS)抗體(批號AF0199,美國Affinity公司);Snail抗體(批號AF6032,江蘇親科生物);α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)抗體(批號23081-AP,武漢三鷹生物);β-連環蛋白(β-catenin)抗體(批號8480T,美國Cell Signal公司);上皮細胞鈣黏蛋白(Epithelial cadherin,E-cadherin)抗體(批號ab185335,美國Abcam公司);Western一抗稀釋液(批號P0023A,上海碧云天);辣根過氧化物酶標記山羊抗小鼠IgG(H+L)(批號ANT30002,上海碧云天)。
1.1.3 主要實驗儀器:燙傷儀(型號SQL-5Q,上海欣軟信息科技有限公司);電泳儀(型號EPS300,上海天能);低溫高速離心機(型號MIKRO220R,Hettich公司);熒光定量PCR儀(型號LightCycler 96,羅氏公司)。
1.2 實驗方法
1.2.1 實驗模型的建立:糖尿病潰瘍模型的制備:將C57B/L小鼠高脂飼料連續飼養3周后,腹腔注射40 mg/(kg·d)鏈脲佐菌素,連續7 d。當空腹血糖≥250 mg/dl時,糖尿病模型制備成功。模型制備成功后改為普通飼養喂養3周,采用燙傷儀燙傷小鼠背部,燙傷第2天燙傷組織病理示深Ⅱ度燙傷即模型制備成功。普通潰瘍模型制備:小鼠予普通飼料連續飼養3周后,采用SQL-5Q燙傷儀燙傷小鼠背部,燙傷第2天取燙傷組織病理示深Ⅱ度燙傷即為模型制備成功。
1.2.2 實驗分組及干預措施:將糖尿病潰瘍模型小鼠隨機分為模型組和紫朱軟膏組,每組各4只。制備的普通潰瘍模型小鼠分為對照組。對照組和模型組小鼠給予0.9%氯化鈉溶液外用換藥,1次/d;紫朱軟膏組予紫朱軟膏換藥,0.032 g/cm2,1次/d。三組均干預14 d。
1.2.3 qRT-PCR檢測炎癥指標及上皮-間充質轉化相關因子mRNA表達:利用超純RNA提取試劑盒提取小鼠潰瘍組織樣本總RNA,用反轉錄試劑盒反轉錄為cDNA,擴增后進行溶解曲線分析。按照2-ΔΔCt相對定量計算公式,計算各樣品組織中炎癥指標IL-6、TNF-α、IL-4、IL-10、iNOS及上皮-間充質轉化相關細胞因子snail、β-catenin、α-SMA、E-cadherin的mRNA相對表達量。目的基因引物序列見表1。

表1 目的基因引物序列
1.2.4 Western blot檢測上皮-間充質轉化相關因子蛋白表達:利用十二烷基硫酸鈉裂解小鼠潰瘍組織,提取總蛋白。用考馬斯亮藍法測定各組小鼠潰瘍肉芽組織樣本蛋白含量,電泳后將蛋白轉移到PVDF膜上,半干轉膜后封閉,先后加入各觀察指標相關的一抗、二抗,然后洗膜、曝光、顯影,應用Image J分析灰度值。
1.3 統計學方法 本研究所有數據采用SPSS 26.0統計學軟件進行分析。計量資料以均數±標準差進行描述,比較采用方差分析,兩兩比較采用LSD-t檢驗;P<0.05表示差異具有統計學意義。
2 結 果
2.1 各組小鼠潰瘍愈合情況及創面愈合率比較 見圖1。各組小鼠創面面積隨觀察天數增加均趨于縮小、愈合。對照組小鼠創面愈合速度較其他兩組快。對照組小鼠在干預開始至7 d愈合速度較快,其他兩組在干預7~11 d的愈合速度較快。干預14 d,對照組小鼠創面基本愈合,其他兩組尚未完全愈合。干預11、14 d,紫朱軟膏組小鼠愈合情況較模型組好。

圖1 各組小鼠潰瘍愈合情況
如圖2所示,干預3 d,與對照組比較,模型組小鼠創面愈合率偏低(P<0.05);干預7、11、14 d,對照組小鼠的創面愈合率高于模型組(均P<0.01)。干預3、7 d,模型組、紫朱軟膏組小鼠的創面愈合率比較差異無統計學意義(均P>0.05);干預11、14 d,紫朱軟膏組小鼠的創面愈合率較模型組高(均P<0.01)。表明紫朱軟膏能有效促進糖尿病潰瘍小鼠創面愈合。

圖2 各組小鼠創面愈合率比較
2.2 各組小鼠潰瘍組織病理學改變 各組小鼠潰瘍組織HE染色見圖3。干預3 d,各組小鼠潰瘍組織炎性細胞浸潤明顯。干預7 d,各組均見新生肉芽組織,上皮組織開始由創緣向創面中心遷移,偶見新生毛細血管,新生組織中皮脂腺等附屬結構發育不完全。干預14 d,對照組小鼠創面完全被上皮細胞覆蓋,肉芽平整,新生皮膚組織結構排列整齊;模型組小鼠潰瘍未愈合,上皮組織未完全覆蓋創面,炎性細胞浸潤明顯,缺乏正常排列結構和附屬結構;紫朱軟膏組潰瘍愈合優于模型組,創面上皮組織覆蓋更明顯,結構更平整。
2.3 各組小鼠潰瘍組織炎癥因子mRNA表達比較 見表2。與對照組比較,模型組小鼠潰瘍組織IL-6、TNF-α、iNOS mRNA表達較高,IL-4、IL-10 mRNA表達較低(均P<0.05);與模型組比較,紫朱軟膏組小鼠潰瘍組織IL-6、TNF-α、iNOS mRNA表達降低,IL-4、IL-10 mRNA表達升高(均P<0.05)。

表2 各組小鼠潰瘍組織炎癥因子mRNA表達比較
2.4 各組小鼠潰瘍組織上皮-間充質轉化相關細胞因子mRNA和蛋白表達比較 見表3(圖4)。與對照組比較,模型組小鼠潰瘍組織snail、β-catenin、α-SMA mRNA和蛋白表達下調,E-cadherin mRNA和蛋白表達上調(均P<0.05);與模型組比較,紫朱軟膏組潰瘍組織snail、β-catenin、α-SMA mRNA和蛋白表達上調,E-cadherin mRNA和蛋白表達下調(均P<0.05)。

圖4 各組小鼠上皮-間充質轉化標志物蛋白表達電泳圖
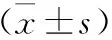
表3 各組小鼠潰瘍組織上皮-間充質轉化相關細胞因子mRNA表達比較
3 討 論
糖尿病足潰瘍中醫病名主要有“脫疽”“筋疽”等[13]。“脫疽”在《黃帝內經》中被稱為“脫癰”,其曰:“發于足趾,名脫癰,其狀赤黑”,記載了脫疽者局部病變特點[14]。至晉代,《針灸甲乙經》將《內經》中的“脫癰”改名為“脫疽”,這也是首次提出“脫疽”病名[15]。在后代眾多醫書中亦有對脫疽的記載,如《外科理例》中記載:“丁生手足,或足潰而自脫,故名脫疽”。陰虛為本病的基本病因病機,局部潰瘍主要表現為瘀血、痰濁、熱毒。中藥油膏在糖尿病足潰瘍治療中已廣泛應用,且組方以清熱、活血化瘀、補虛藥物為主[16-17]。紫朱軟膏是通過長期臨床實踐總結的治療糖尿病足潰瘍的外用油膏制劑。該方由朱砂、紫草、黃芪、血竭、阿膠、冰片等組成,具有清熱解毒、祛腐生肌、補益氣血之效。糖尿病足潰瘍早中期局部以腐肉、炎性滲出多見,治療以“祛腐”為主,紫朱軟膏具有清熱解毒、祛腐生肌的作用,在祛除局部濕熱毒邪同時還可祛除創面腐肉組織,改善創面炎癥反應[18]。糖尿病足潰瘍中后期治療以“生肌”為主,紫朱軟膏能補益氣血,為創面提供營養,促進肉芽組織形成及再上皮化[12]。
上皮-間充質轉化是上皮細胞轉變為間充質細胞并獲得增殖、遷移等表型的過程[19-20]。上皮-間充質轉化目前被劃分為3種亞型,其中2型上皮-間充質轉化在傷口愈合、組織再生和器官纖維化發揮著重要作用[21]。在2型上皮-間充質轉化中細胞骨架會重新排列,細胞間連接和頂-底極性喪失,細胞遷移、侵襲能力增強,通過快速遷移覆蓋創口表面,促使創面上皮化形成表皮屏障,最終促進創面愈合[22-23]。多項研究通過檢測上皮分子標志物表達如β-catenin、E-cadherin、Occludin、ZO-1等和間充質分子標志物表達如FSP1、α-SMA、N-cadherin和Vimentin等,從分子水平上證明細胞發生上皮-間充質轉化改變[24-25]。上皮-間充質轉化受到多種轉錄因子調控,如Snai1、Zeb2和Twist對EMT均具有誘導作用[26-27]。因此,促進上皮-間充質轉化可能成為糖尿病足潰瘍治療的研究方向。本課題組通過在糖尿病潰瘍模型上加用紫朱軟膏干預,觀察糖尿病潰瘍愈合情況的同時,觀察其對炎癥細胞因子及上皮-間充質轉化相關細胞因子的影響,結果發現干預11、14 d,紫朱軟膏組小鼠的創面愈合率較模型組高。干預14 d,紫朱軟膏組潰瘍愈合優于模型組,創面上皮組織覆蓋更明顯,結構更平整。與模型組比較,紫朱軟膏組小鼠潰瘍組織IL-6、TNF-α、iNOS mRNA表達降低,IL-4、IL-10 RNA表達升高。與模型組比較,紫朱軟膏組潰瘍組織snail、β-catenin、α-SMA表達上調,E-cadherin表達下調。以上結果提示紫朱軟膏能減輕炎癥反應,促進上皮-間充質轉化的發生,促進糖尿病潰瘍愈合。
綜上所述,紫朱軟膏可能通過改善創面炎癥反應,誘導上皮-間充質轉化,從而促進糖尿病潰瘍愈合。但本課題僅觀察了紫朱軟膏對炎癥反應及上皮-間充質轉化的影響,未進一步探討其作用機制,后期將圍繞上皮-間充質轉化深入探索紫朱軟膏干預糖尿病潰瘍的作用機制。

