N7-甲基鳥苷(m7G)在肝細胞癌中的作用機制
高 春, 江晶晶, 陳玉春, 于曉輝, 張久聰, 鄭曉鳳
1 甘肅中醫藥大學第一臨床醫學院, 蘭州 730000; 2 中國人民解放軍聯勤保障部隊第九四〇醫院消化內科, 蘭州 730050; 3 蘭州大學第二醫院消化內科, 蘭州 730030
肝癌是癌癥相關死亡的主要原因,肝細胞癌(HCC)約占肝癌相關死亡的90%[1],手術切除、消融治療、經動脈化療栓塞、免疫治療和全身化療藥物已經用于早期至晚期HCC 的治療[2]。盡管近年來HCC的治療已經取得了一些進展,但由于其發病機制的高度復雜性和靶點的單一性,使得患者的預后仍然相對較差[3]。此外,生物分子研究的最新進展在疾病分子機制、診斷生物標志物和預后生物標志物的鑒定中起重要作用。然而,目前還沒有確定的可以預測治療效果的生物標志物。因此,尋找有效的生物標志物可以幫助臨床醫生為患者制訂精準的治療方案。
由于高通量測序技術的不斷發展,已發現轉錄后修飾在多種生理和病理過程中發揮著關鍵作用。迄今為止,已經在不同分子中發現了170 多種類型的RNA修飾,包括信使RNA(mRNA)、核糖體RNA(rRNA)、轉移RNA(tRNA)和長鏈非編碼RNA(lncRNA)[4-5]。N7-甲基鳥苷(N7-methylguanosine,m7G)修飾是最常見的RNA修飾之一,通常位于真核細胞mRNA的5′帽和內部區域,或所有物種的rRNA 和tRNA 內部區域,且是一種帶正電荷的RNA 修飾[6-8]。先前的研究[9]表明,有100 多個基因與m7G 甲基化及其位點相關。此外,文獻[10-12]報道m7G 甲基化修飾與部分癌癥發展密切相關,并參與多種癌癥相關的生物學活動,但m7G甲基化與HCC發生發展的具體機制尚未闡明。因此,本文就m7G 甲基化修飾在HCC 發病機制中的潛在作用及與m7G 相關的診斷技術和治療策略進行簡要綜述,為深入研究HCC的分子機制及治療提供新的理論支持。
1 m7G概述
tRNA 是蛋白質翻譯的銜接分子,用于識別mRNA密碼子并產生相應的氨基酸。tRNA 的修飾對tRNA穩定性、密碼子識別和有效的蛋白質合成至關重要,研究[13]表明tRNA 修飾的失調與線粒體疾病、神經系統疾病和癌癥的發展密切相關。m7G 是位于tRNA 可變環中第46 位核苷酸上的最常見的一種高度保守的tRNA 修飾,存在于原核生物、真核生物以及一些古細菌中,可促進細胞周期調控和致癌mRNA 的翻譯,并最終推動細胞轉化和癌癥進展[12]。m7G tRNA 修飾由酵母中的Trm8p/Trm82p 異二聚體復合物和人類中相應的鄰位甲基轉移酶樣蛋白1(methyltransferase-like 1,METTL1)和WD 重 復 結 構 域4(WD repeat domain 4,WDR4)蛋白催化(圖1)[14]。m7G tRNA 修飾在酵母中是一種不必要的修飾,但在哺乳動物中,它決定著受損的干細胞的命運,并且與發育畸形等疾病密切相關。在人類中,編碼WDR4 的突變導致tRNA m7G 修飾受損,并導致一種以面部畸形、腦畸形、大腦發育異常,以及伴有癲癇發作的嚴重腦病[15-17]。位于人類染色體21q22.3的WDR4也是一些唐氏綜合征表型的候選基因,包括由人類患者染色體區域三體性導致的智力低下[18]。這表明與酵母相比,m7G tRNA 修飾在哺乳動物中可能具有更重要的生理功能。此外,據報道[19]在生長因子刺激下,METTL1 受蛋白激酶B 和核糖體S6激酶調節,并影響癌癥細胞的存活率和對5-氟尿嘧啶的敏感性。這與Liu 等[20]、Okamoto 等[21]的研究結果類似,METTL1在癌癥組織中上調,并可調節5-氟尿嘧啶的敏感性。然而,尚未在哺乳動物中檢測到m7G tRNA 修飾的全部程度,并且由于METTL1/WDR4缺陷介導的缺陷m7G tRNA 修飾所導致的不良發育后果或相關疾病的分子和細胞機制尚不明確。
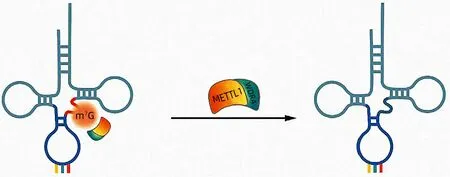
圖1 m7G的結構及修飾Figure 1 Structure and modification of m7G
此外,Pandolfini 等[22]發現,由METTL1/WDR4 復合物介導的m7G 也可以發生于miRNA,進而調節miRNA 結構并促進細胞遷移。Zhang 等[23]通過對哺乳動物mRNA 內部m7G 位點進行m7G MeRIP 測序后,發現m7G 甲基化可能影響mRNA 翻譯。同時,Zhao等[24]也證明了m7G 在mRNA 中的作用,該研究發現METTL1是導致缺血組織mRNA 內m7G 減少的主要潛在原因,并通過促進VEGFA mRNA 翻譯以促進缺血后血管生成。
2 m7G檢測方法
自m7G 首次被發現以來,眾多國內外學者認為m7G 在生物學過程中起著至關重要的調節作用,但具體的調控機制尚不明朗[25]。此外,由于m7G 不影響Watson-Crick 堿基雜交,且在RNA 中相對含量較低,準確靈敏地檢測m7G 存在一定困難。因此,尋找一種高效的m7G 檢測方法迫在眉睫。目前檢測m7G 甲基化的方法包括定量檢測和位點檢測。最先用于甲基化測序的檢測方法是高效液相色譜法、液相色譜-串聯質譜,它們通過核苷的極性不同,使用UV、質譜分離得到的核苷進行檢測[26]。基于液相色譜-串聯質譜的液相色譜-電噴霧電離串聯質譜法具有高度特異性和極高的靈敏度,檢測限值為0.2 fmol[27]。雖然這些方法可實現m7G tRNA 定量檢測,但成本均較昂貴且操作不當易出現假陰性或假陽性結果。
隨著高通量測序的出現,對m7G 進行位點的檢測成為了可能[28],目前相關檢測方法包括m7G MeRIP seq、m7G seq 和m7G miCLIP seq 技 術。傳 統 的m7G MeRIP seq 方法依賴于抗體免疫沉淀,分辨率有限(~80 bp)[29]。基于逆轉錄終止,m7G seq 在檢測人mRNA和tRNA中的m7G修飾時實現了堿基解析(圖2)。Zhang 等[23]研發的m7G seq 可以在沒有抗體富集的情況下,在人類細胞中以單核苷酸分辨率實現內部m7G的轉錄組范圍映射。同時,他們在METTL1 敲除細胞中進行了m7G seq,并證實了METTL1 的tRNA m7G 甲基化功能。這種新方法使人們能夠以高特異性和保真度繪制內部m7G 修飾的精確位置和序列基序,但會影響單個m7G 位點修飾水平的準確檢測,因為只有一部分位點轉化為可以被檢測到的堿性位點。Lin等[30]使用了m7G seq 和tRNA 還原和切割測序(TRAC seq),以揭示小鼠胚胎干細胞中的m7G tRNA甲基化,最終發現Mettl1敲除的小鼠胚胎干細胞中相應密碼子的核糖體表達增加。m7G seq 和TRAC seq 在m7G 甲基化的檢測中具有高度特異性,因為這兩種方法可以增加m7G的位點特異性切割分數,使研究者能夠以單核苷酸分辨率識別tRNA 中的全局m7G 修飾。新的m7G miCLIP seq在通過修改的miCLIP方案繪制m7G修飾圖中具有更高的靈敏度和特異度[7],但是該方法的應用還有待繼續探索。
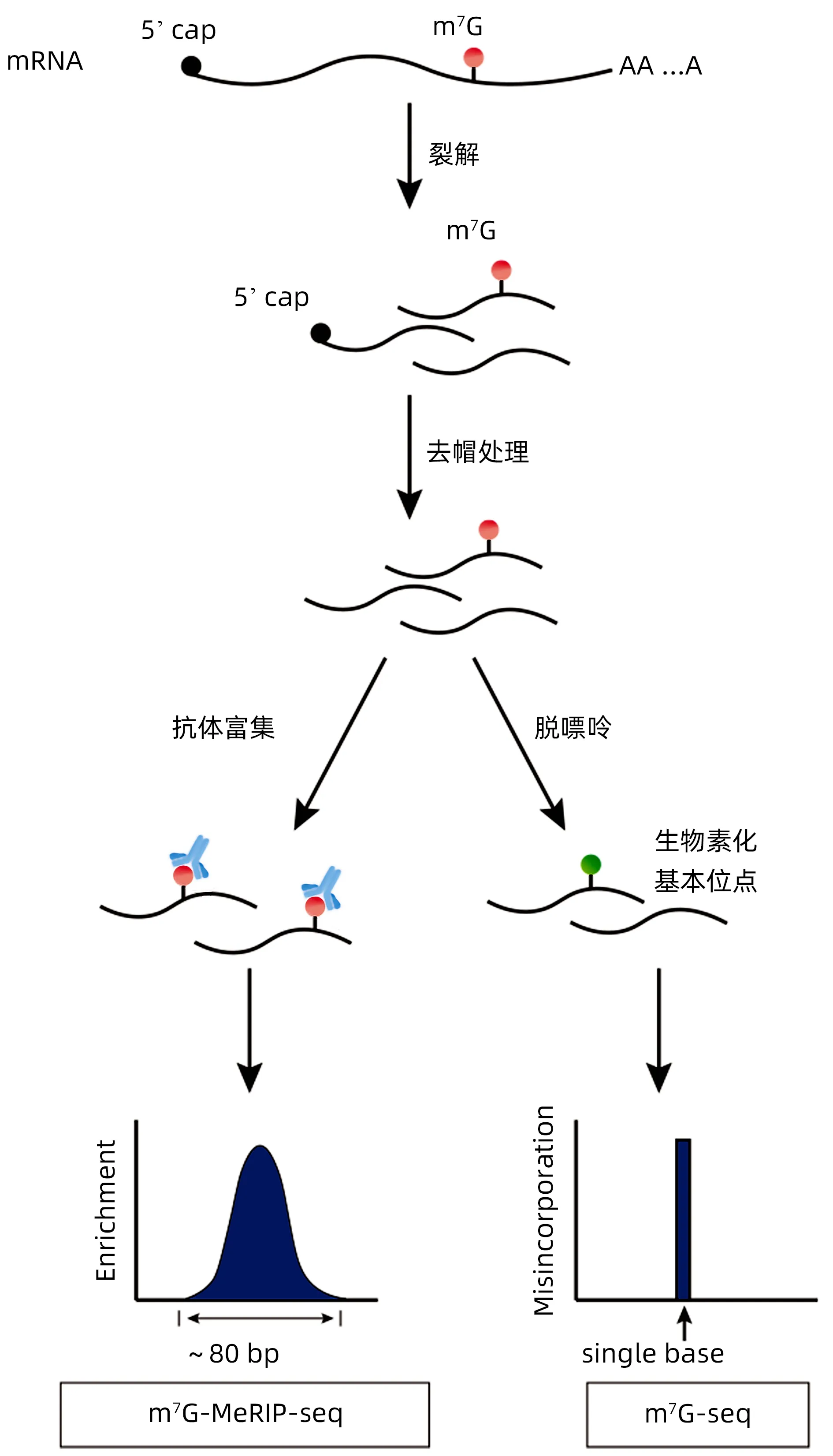
圖2 m7G MeRIP seq、m7G seq檢測技術的比較Figure 2 Comparison of m7G MeRIP seq and m7G seq detection techniques
3 m7G與HCC
3.1 METTL1/WDR4 復合物與HCC 相關 HCC 為全球第六大最流行的腫瘤,每年約有84.1萬例新發病例和78.2 萬 例 死 亡 病 例[31]。然 而,METTL1 和m7G tRNA 修飾在HCC 發生發展中的確切作用和調節機制仍不清楚。但m7G 為HCC 不明確的分子機制提供了新的線索,并可能指導新的治療策略。一些研究基于公共數據庫中的數據分析了METTL1和WDR4的表達水平,并報告了與正常肝組織相比,在HCC 樣本中表達上調。Chen等[32]發現,在組織層面上,m7G tRNA修飾及其催化酶METTL1/WDR4 復合物在HCC 中升高,并與HCC患者生存率呈負相關。在細胞層面上,沉默METTL1 或WDR4 可以抑制HCC 細胞增殖、遷移和侵襲,而強制性表達野生型METTL1 可催化死亡突變體的形成,進而促進HCC 進展。這可能是因為METTL1介導的m7G 修飾增強了mRNA 翻譯,并在體內外加速了HCC 的發生和進展,而METTL1 的敲除可使mRNA的翻譯降低[10]。這表明靶向METTL1 和調節不當的tRNA 修飾可能是HCC 治療的一種有前途的策略。Xia 等[33]首 次 發 現MYC/WDR4/CCNB1 信 號 通 路 在HCC 侵襲遷移中具有一定地位。轉錄調節因子MYC可以激活WDR4 轉錄,WDR4 通過促進真核翻譯起始因子1A 與CCNB1 mRNA 的結合來增強CCNB1 翻譯,而WDR4本身也受MYC 的調節。CCNB1通過促進P3泛素化影響HCC 中的PI53K 和AKT 磷酸化并降低P53 蛋白表達。此外,WDR4 通過誘導細胞向G2/M 周期轉變和抑制細胞凋亡以減少HCC 細胞的凋亡。因此,WDR4 可作為HCC 發生和進展中的腫瘤啟動子,可 能 作 為HCC 的 候 選 治 療 靶 點。Tian 等[34]發 現METTL1 在HCC 中顯著上調,并通過PTEN/AKT 信號通路表現出致癌活性。PTEN 在METTL1 低表達的患者中被激活,PTEN 的異位表達或AKT 活性的抑制可以顯著減弱METTL1 介導的惡性表型。在臨床樣本中,METTL1 表達與PTEN 表達相反。METTL1 低表達和PTEN 高表達同時發生與總生存期延長顯著相關,而單獨表達METTL1 或PTEN 更與不良總生存期相關。這就提示靶向METTL1/PTEN 信號軸可能在HCC的治療中具有潛在作用。
3.2 METTL1 介導的Arg-TCT-tRNA m7G 修飾與HCC相關 目前,關于METTL1 在癌癥中的整體相關性基本未知。但研究發現,METTL1/WDR4在HCC中負性介導m7G tRNA的密碼子依賴性核糖體停滯。METTL1功能增強導致m7G tRNA 修飾的增加,進而引起tRNA 亞群的豐度增加,包括Arg-TCT-4-1(5個負責解碼AGA密碼子的同解碼器tRNA 之一),以及富含AGA 密碼的mRNA(包括與細胞周期相關的密碼子)的翻譯相應增加。報告[35]分析表明,METTL1 或Arg-TCT-4-1 的過表達促進富含AGA 密碼子的轉錄物的表達。這說明tRNA-Arg-TCT-4-1 上調表型復制METTL1/WDR4 過表達表型,并導致惡性轉化和致癌。這與Dai 等[36]的研究結果一致,兩者都表明細胞周期進展mRNA(如Cdk4)和某些致癌mRNA(例如Hmga2、Ash2l、Setdb1、Ube2t)富含與Arg-TCT-4-1 同源tRNA 相對應的AGA 密碼子,因此其翻譯增加(圖3)。此外,Orellana等[35]研究表明,在沒有增加METTL1/WDR4 活性或水平的情況下,僅僅過度表達m7G-tRNA Arg-TCT-4-1,就會出現METTL1/WDR4 過度表達現象,并且本身就是惡性轉化。這些發現增加了一個重要的新概念,即翻譯調控作為驅動因素而不僅僅是腫瘤發生的參與者,并且這一過程極為復雜且經常被低估。
4 前景與挑戰
m7G 修飾在各種腫瘤中的作用已被廣泛探討[37]。METTL1/WDR4 作為m7G 修飾的最核心調節因子在HCC 中發揮重要作用,在臨床診斷和治療中顯示出巨大潛力。據報道,METTL1和WDR4還與免疫抑制腫瘤微環境相關,并參與調節各種免疫細胞的浸潤和癌癥細胞與腫瘤細胞或免疫細胞之間的促腫瘤相互作用,這可能為未來的免疫治療方法提供潛在的思路[38]。Huang 等[39]認為,METTL1 和WDR4 的上調可促進HCC 中侖伐替尼的耐藥性,并賦予對METTL1 靶向的敏感性,從而為解決化療藥物耐藥這一臨床難題提供了一種有希望的理論依據。此外,通過轉錄后編輯靶向調節失調的METTL1/WDR4 或功能失調的m7G 位點可能是治愈HCC的一種潛在方法,并且可以與化療或免疫療法相結合,以在未來獲得更好的治療效果。但是迄今為止,尚未報道METTL1/WDR4 抑制劑或潛在的m7G 相關轉錄后編輯系統。與其他RNA 修飾類似,m7G 調節因子的小分子抑制劑可能是最有前途和最有效的腫瘤治療方法。因此,有必要對ETTL1、WDR4 兩種酶的詳細結構進行探討,為更早地研發有效的靶向藥物做準備。
5 小結與展望
m7G 甲基化是RNA 修飾研究中的一個新興熱點,目前已被證明參與多種細胞過程,并與mRNA、tRNA和rRNA 的失調密切相關。盡管與m7G 相關的研究仍處于初步階段,但現有的研究足以表明m7G在HCC發展過程中的關鍵作用。m7G 甲基轉移酶METTL1 和WDR4 的功能是在靶向RNA 中的特定位置安裝m7G修飾,從而影響RNA 分子(包括mRNA、miRNA 和rRNA)的生產、結構和成熟,最終調節翻譯過程。目前有研究表明m7G 修飾的相關基因在HCC 中異常表達,可能作為診斷和預后預測的新生物標志物。因此,靶向m7G tRNA 修飾有望成為治療HCC 患者的一種有前景的策略。目前,對于m7G 修飾這一復雜過程仍然具有太多的未知性和不確定性,尤其在HCC 中m7G 和其他轉錄后修飾是否存在相互協同或者拮抗影響等更多作用,有必要進一步研究以更全面地闡明m7G修飾在HCC中的分子機制。
利益沖突聲明: 本文不存在任何利益沖突。
作者貢獻聲明:高春負責論文撰寫與修改;江晶晶、陳玉春等負責論文修改和審閱;鄭曉鳳負責數據收集;張久聰、于曉輝等負責擬定寫作思路,指導撰寫文章并最后定稿。

