綠色化教育理念下學生創新能力培養的實踐研究*
陳新峰 柳文敏 蘭青
南陽師范學院化學與制藥工程學院 河南南陽 473061
0 引言
《義務教育化學課程標準(2022 年版)》要求“引導學生‘做中學’‘用中學’‘創中學’,促進學生核心素養的發展”。高中化學課程標準把“科學探究與創新意識”作為化學學科的五大重要核心素養之一,所以說“創新教育”是當前中學化學教學的一個重要理念,開發課程資源,挖掘創新教育素材應是化學教育工作者重要的教學研究工作之一。我們知道,實驗是化學學科的一個明顯且重要的特征,實驗設計特別是實驗的綠色化設計涉及的因素比較多,很多時候還存在各條件相互制約、相互影響的情況,這就要求在對實驗條件篩選、實驗現象觀察、實驗數據分析的基礎上不斷地優選優化,才能確定最終的實驗方案。在這個過程中,學生的創新精神、意識和能力等方面的素養才能得以逐步提升。
1 創新基礎——觀察能力的培養
在化學教學中,觀察能力是指通過感覺器官獲取化學反應中那些具有典型代表性的、能夠反映化學世界本質特征的外部表象的能力,是準確把握實驗本質、解決實驗問題的基礎。在實驗綠色化教學中,要著重培養學生以下幾個方面的觀察能力。
1.1 觀察的敏銳性
敏銳的觀察力能夠及時準確地捕捉那些稍縱即逝或者“觀察目標以外”的化學現象。如FeSO4和NaOH 的反應,生成的Fe(OH)2沉淀剛開始是白色的,但很快就會轉化為灰綠色,直至完全生成紅褐色的Fe(OH)3沉淀,我們可以利用這些稍縱即逝的反應現象對學生進行觀察敏銳度的培養。再如KClO3加熱催化制取氧氣時,產物是KCl 和O2,收集氧氣的方法有向上排空氣法和排水法兩種,但排空氣法收集的氧氣總混有一股刺激性的味道,而排水法收集的氧氣卻不存在這種意料之外的情況,而這意外之處正是培養學生觀察敏銳度的好素材,同時也為處理污染性氣體提供了一種行之有效的解決方法。
1.2 觀察的全面性
觀察的全面性是指利用多種感官(視覺、嗅覺、觸覺、聽覺等)對物質的表象進行全方位的觀察,以獲取反映物質性質的實驗現象和數據。例如在金屬鈉的教學過程中,當用小刀切開一小塊金屬鈉時,學生可以觀察到切面處明亮的金屬光澤,但是切面處的明亮光澤很快就會暗淡下去,由此可以得出鈉的硬度比較小且在空氣中不穩定的性質。把小鈉塊放入盛水的燒杯中,并加入酚酞指示劑,可以看到鈉塊浮于水面之上,熔成一個光亮的小球,不停地快速游動并伴有小氣泡生成,逐漸減小直至消失,同時酚酞試液變為紅色;可以聽到反應中的嘶嘶響聲;手觸燒杯外壁發熱;等等。從而知道,鈉與水劇烈反應生成氣體和堿性物質,并伴有大量的放熱現象。
再如在學習乙烯的C=C 雙鍵不飽和性時,我們通常是用無水乙醇與濃硫酸為反應原料來制取乙烯,把乙烯通入酸性高錳酸鉀和溴水溶液中,高錳酸鉀和溴水溶液褪色現象非常明顯。這時學生會把注意力大部分或全部都集中在獲得的這一現象上,并以此驗證和解釋乙烯的不飽和性,而實驗的另一個現象往往會被忽視,那就是混合溶液的變黑和生成的氣體會帶有一股刺激性的氣味。事實上這股有刺激性氣味是濃硫酸被還原所生成的SO2氣體,它同樣能使酸性高錳酸鉀和溴水溶液褪色。假如說我們在實驗過程中因操作溫度不當生成的不是乙烯而是乙醚,那么因SO2的存在,同樣也可以使酸性高錳酸鉀和溴水溶液褪色。若把其通入品紅溶液中,還會得出使品紅溶液褪色的結論。這顯然是錯誤的。因此在實驗過程中要引導學生全面觀察,先凈化去除SO2,再進行相關實驗,才能得出既正確而又準確的結論。教學過程中我們可以利用諸如此類的實例來培養學生全面觀察實驗的意識及能力。
1.3 觀察的準確性
觀察的準確性是科學實驗的前提和根本,否則實驗就會得出“偽科學”的結論。影響觀察準確性的因素總的說來有主觀(觀察的態度與能力)和客觀(干擾因素)兩類。對觀察準確性的要求不僅能培養學生嚴謹細致的觀察態度,同時還可以培養學生消除干擾因素的能力。例如在銅與稀硝酸反應的實驗中,常因試管中空氣排除不完全而殘留了部分氧氣,致使生成的無色NO 部分被其氧化,轉變為紅棕色的NO2,不但污染了教室的空氣,還會導致學生的誤觀察。為消除假象并無害化處理尾氣,我們可以選取一個青霉素瓶和一套一次性輸液管進行如圖1 所示的實驗改進:用夾子夾緊1、2 兩處,把銅絲(銅片)放入瓶內,充滿稀硝酸并蓋緊瓶蓋,倒置并固定在鐵架臺上,可以看到,隨著反應的進行,瓶內由無色的稀硝酸溶液變為藍色的硝酸銅溶液,并被無色氣體(NO)排入輸液器滴壺內,待瓶內稀硝酸即將流出完畢時,夾子夾緊3處,打開1處,瓶內無色的NO 氣體隨即轉變為紅棕色的NO2氣體。此設計不但方便尾氣處理,而且可以反復進行實驗操作,便于學生多次觀察。
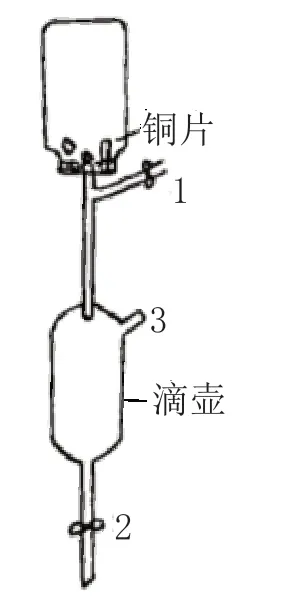
圖1 銅與稀硝酸反應實驗改進裝置
1.4 觀察的深刻性
物質的性質往往包含多個方面,實驗中會產生不同的反應現象,比如,有的反應劇烈甚至伴隨著爆炸和聲響,有的反應平緩甚至需要加壓、加熱以及催化等條件才能順利完成,有些反應在形態、顏色等方面變化明顯,有的較難觀察到明顯變化,而這些正是其本質屬性的反映。但對于學生來說,實驗現象的顯現度不同,觀察時引起注意的程度也不同,可能會導致一些反映深層次問題的實驗現象被忽視,因此觀察的深刻性也是培養觀察能力的一個重要方面。比如NH3與HCl 氣體的反應,在進行綠色化設計時,可以將它們分別用導管引入密封的玻璃容器中進行,生成白煙的實驗現象非常明顯,但是如果我們仔細觀察,特別是反應剛開始時,會發現白煙在容器內的分布是不均勻的,而正是這個現象揭示著NH3與HCl 氣體的深層問題,即雖然它們都是揮發性氣體,但揮發的速度卻不相同,也就是兩種分子的運動速度不同,而這又與它們不同的分子質量有關。通過對這些現象的觀察和思考,學生能夠順利理解這部分內容并使知識系統化。
2 創新性問題思維能力的培養
2.1 打破思維定式
思維定式有時候能幫助我們快速找到解決問題的辦法,提高解決問題的速度和效率,卻會固化我們的思維,讓我們解決問題時囿于已有模式和方法,思路狹隘不開闊,甚至鉆牛角尖。當遇到新事物、新現象,需要我們用創新性思維去解決問題時,容易進入思維的死胡同。化學實驗中的思維定式主要表現在對實驗原理理解的定式思維和對實驗儀器、實驗藥品、實驗操作方法選擇的定式思維。思維定式不利于實驗問題得到更好的解決,不利于學生創新性思維能力的發展。因此,在實驗的綠色化設計中,要注意打破定式的阻礙,另辟蹊徑解決問題。如對于有害實驗尾氣的處理,一般都采用能化學處理就化學處理,不能化學處理就物理收集的方法。打破這種定式,我們可以考慮先進行回收再利用,既消除污染又廢物利用,一舉兩得。例如CO 還原CuO 的實驗,尾氣中的CO 不再點燃轉換為CO2后釋放到空氣中,而是將其導引至酒精燈上進行燃燒,既可獲取部分反應熱源,又能夠消除對實驗室的氣體污染[1],還可以對學生進行責任意識、環保意識和初步的可持續發展觀教育。
2.2 思維的靈活性
思維靈活性是思維的重要品質之一,是指能夠根據具體情況靈活改變解決問題的思路,當在某一方向上解決問題卡殼時,能夠靈活地變換思考的角度,改變解決問題的方式方法去靈活地解決問題。例如教材中對電解質導電能力的教學內容編排,電解質的選擇包含HCl 和NaCl 溶液,但通電時它們都會電解生成氯氣而污染教室環境,我們可以選擇不易發生電解的陰離子(如SO42-)物質來替代,用硫酸鈉溶液代替氯化鈉溶液、稀硫酸代替鹽酸同樣可以很好地達到教學效果,且避免了氯氣的環境污染。
2.3 思維的發散性
發散思維是指對于一個待解問題,從不同的方向、不同的角度去思考并提出相應的解決方案的思維形式。它可以有效地訓練學生思維的獨特性、變通性和流暢性,破除認識事物的思維惰性,激發創新精神。如在SO2的褪色漂白、加熱復色實驗中,放出的SO2是一種污染性氣體,我們知道,SO2這種污染性氣體不僅常常產生于實驗室,并且在工農業生產中也會大量地產生,污染著我們的大氣環境,它是酸雨形成的重要因素之一,這對我們具有強烈的環境警示作用。這時可引導學生進行發散性思維,尋找能用于實驗室的快捷、易操作的處置辦法,比如物理收集、化學反應去除等。物理收集還可以選擇不同的收集方法,化學去除可以選擇與堿反應、與氧化性溶液(如KMnO4)反應等。通過對這些方法的可行性、操作性、SO2去除的有效性進行對比分析,進行異中選優最佳解決方案的選擇。
3 創新性實驗設計能力的培養
3.1 實驗原理創新
在化學制備和合成反應中,可以通過實驗原理創新,在反應物的篩選、副產物、原料雜質中的生成物、反應條件等方面實現綠色化處理。比如中學化學教材中利用電石制備乙炔的實驗,由于電石中雜質的存在,會生成H2S、PH3、AsH3等有毒氣體,雖然實驗中設計了用CuSO4溶液進行除雜,但實際上去除并不完全,況且Cu2+屬于重金屬離子,也會污染環境。若改用電石與16%的NaOH 反應,實驗表明效果比較理想[2]。再如以往實驗室制備氧氣時常常采用加熱分解KMnO4或加熱催化分解KClO3的方法,但是KMnO4加熱制備氧氣產率較低,不太符合綠色化實驗的原子利用經濟性原則,KClO3加熱催化分解不但催化劑MnO2難以回收利用,而且反應過程中還會伴有副反應的發生,生成諸如氯氣、二氧化氯等一些有毒有刺激性的氣體。那么是否還有其他制備方法呢?這時教師可引導并提出幾種可供選擇的制備方法,如HgO、Na2O2、H2O2等為原料都可以有氧氣的生成,但HgO 分解產生的Hg 是嚴重的污染物,而Na2O2價格貴成本高,H2O2分解的產物為氧氣和水,價格又便宜產物又清潔,是最優選的實驗室氧氣獲得的途徑。還有我們前面提到用乙醇和濃硫酸制取乙烯,會有有毒氣體SO2生成,并且干擾乙烯的褪色現象,這時我們可以從反應原理入手,乙醇反應生成乙烯,實際上是在催化劑H+作用下的分子內脫水反應,那么我們只要能夠找到合適的H+提供者和脫水劑提供者即可取得相同的效果,像實驗室常用的非氧化性強酸與五氧化二磷或焦磷酸就是比較好的替代方案。
3.2 實驗方案創新
原理創新為方案創新提供了理論支撐,對于一個化學實驗的綠色化方案設計,我們可以根據反應原理,引導學生對不同反應路線進行分析比較,從而篩選出原子利用率最高、污染最小的反應(合成)路線,以實現方案創新。如硝酸銅的制備方案可以有以下三種:
1) Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O
2) 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO ↑+4H2O
3) 2Cu+O2=2CuO, CuO+2HNO3(濃)=Cu(NO3)2+H2O
通過有無污染物的生成、原子利用率的高低等條件判斷可知,最后一個制備方案是最佳的選擇。
3.3 實驗操作裝置創新
實驗操作裝置的創新優化是實驗綠色化設計的重要途徑之一,也是培養學生創新能力的又一重要途徑。以下介紹幾類有代表性的例子。
排液法收集氣體。當遇到一些具有潛在污染性的實驗而常用裝置又不能很好地解決問題時,我們可以考慮進行操作裝置的創新。例如排水法是常用的氣體收集方法之一,其特點之一是容易觀察氣體收集的進度,能夠掌控收集操作的時間和氣體收集的多少。但對于易溶于水的污染性氣體如氨氣和氯化氫氣體,排水法就解決不了這些問題,這時我們可以考慮把水換成其他液體(如CCl4),但CCl4又不能用手直接觸,這就需要實驗裝置的創新和改造,比如圖2 所示的裝置就能很好地解決這一問題。
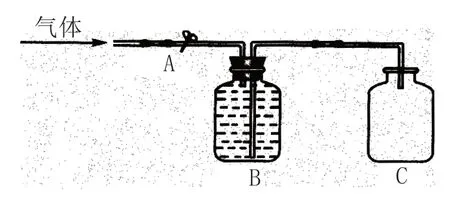
圖2 自動排液集氣裝置
臨時儲氣。在制取多份氣體時,為了不使連續反應生成的氣體在更換集氣瓶時散入實驗室內,我們可以給實驗裝置加裝一個氣體緩存裝置,如在氣體發生裝置的氣體導出管道中加裝一個帶有儲氣囊(也可以用氣球代替)的三通玻璃管,靠近氣體收集裝置端再加裝一截帶止氣夾橡膠管,利用氣囊臨時儲氣,避免氣體外溢。
氣體隨用隨制。我們平常所用的啟普發生器的主要功能就是方便氣體的隨用隨制,其操作原理是能夠把反應物隨時分隔開來,利用這一原理我們還可以把它改進。例如銅與硝酸制備NO 或NO2,我們選取細銅絲代替銅片,把銅絲的一端纏繞成團狀伸入反應容器中,另一端通過橡皮塞穿出至反應容器外部,當要進行反應時,可通過外伸的銅絲把團狀銅絲推入HNO3溶液中,當要停止反應時,將銅絲提拉出硝酸液面即可。原理如此,可擴展到其他相似的實驗中,同時它還有一個不同于啟普發生器的好處是可以應用于需要加熱的一些反應。
實驗的綜合利用。學習濃硫酸性質時,通常都要證明它的脫水性和氧化性,反應時還會放出大量的刺激性氣體污染學習環境。這時我們可以把“黑面包”實驗改在燒瓶內進行,通過分液漏斗向燒瓶中的蔗糖滴加濃硫酸,反應生成的氣體通過品紅溶液(驗證SO2的生成)和堿溶液處理,既證明了濃硫酸的脫水性、氧化性,又完美地處理了有毒尾氣,提升了實驗的綜合效果。

