融入課程思政的高中化學情境式教學設計
丁永梅
寧夏大學化學化工學院 銀川 750021
0 引言
《普通高中化學課程標準(2017 年版)》中明確提出要落實立德樹人根本任務,引導學生形成正確的世界觀、人生觀和價值觀[1]。中學化學教學的根本任務是圍繞立德樹人的總目標,實現化學學科的育人價值[2],因此,在高中化學教學中滲透課程思政元素是非常有必要的。生活中有許多涉及氧化還原反應的實例,在教學中設計相關的生活情境,引領教學,不僅能夠激發學生求知欲,而且能夠讓學生學會利用科學知識解決生活問題,樹立正確的“三觀”。筆者在“配平氧化還原反應方程式”課程中設置情境引領教學,并融入課程思政元素,對當前如何改善高中化學教學模式進行了探討。
1 教學目標
本節課的課程思政目標有以下幾點。
1)通過回顧氧化還原反應的相關概念,引導學生學會透過現象看本質,從宏觀和微觀兩個視角分析事物。
2)通過類比警察破案的情境,總結升降法配平氧化還原反應方程式的“五步法”,學會類比和總結的科學思維方法。
3)通過“五步法”配平不同類型氧化還原反應方程式,明白需要抓住的重點不同,采用的方法則不同,明確具體問題要具體分析的道理。
4)通過書寫黑火藥等相關氧化還原反應方程式,感受科技、生活與學科知識之間的密切關聯,樹立愛國情懷。
5)通過學習配平氧化還原反應方程式,進一步加深對氧化還原反應的理解,初步形成用辯證的觀點認識事物的思維方式。
2 教學設計
2.1 教學思路
本教學設計在情境的引領下,融合課程思政,達到學科育人的目的。以生活中的情境引入氧化還原反應的概念,學習完氧化還原反應方程式的配平后,用方程式揭示情境中氧化還原反應發生的原理,前后呼應,讓學生深刻感受到科技、生活等與學科知識之間密不可分的關系,明白要學以致用的道理,自覺樹立正確的世界觀、人生觀和價值觀。本節課新知識的學習,主要包含兩個部分:第一部分是通過類比警察破案的情境,總結配平氧化還原反應方程式的“五步法”,形成類比歸納的思維方式;第二部分是根據“五步法”配平不同類型的氧化還原反應方程式時,側重不同,所采用的配平技巧不同,讓學生學會具體問題具體分析的方法。總體上來看,本教學設計是在兩大情境的引領下,讓學生學習新知識,并融入辯證唯物主義思想的各類要素,很好地將情境式教學與課程思政相融合。具體的情境線、知識線以及課程思政目標的體現如圖1 所示。
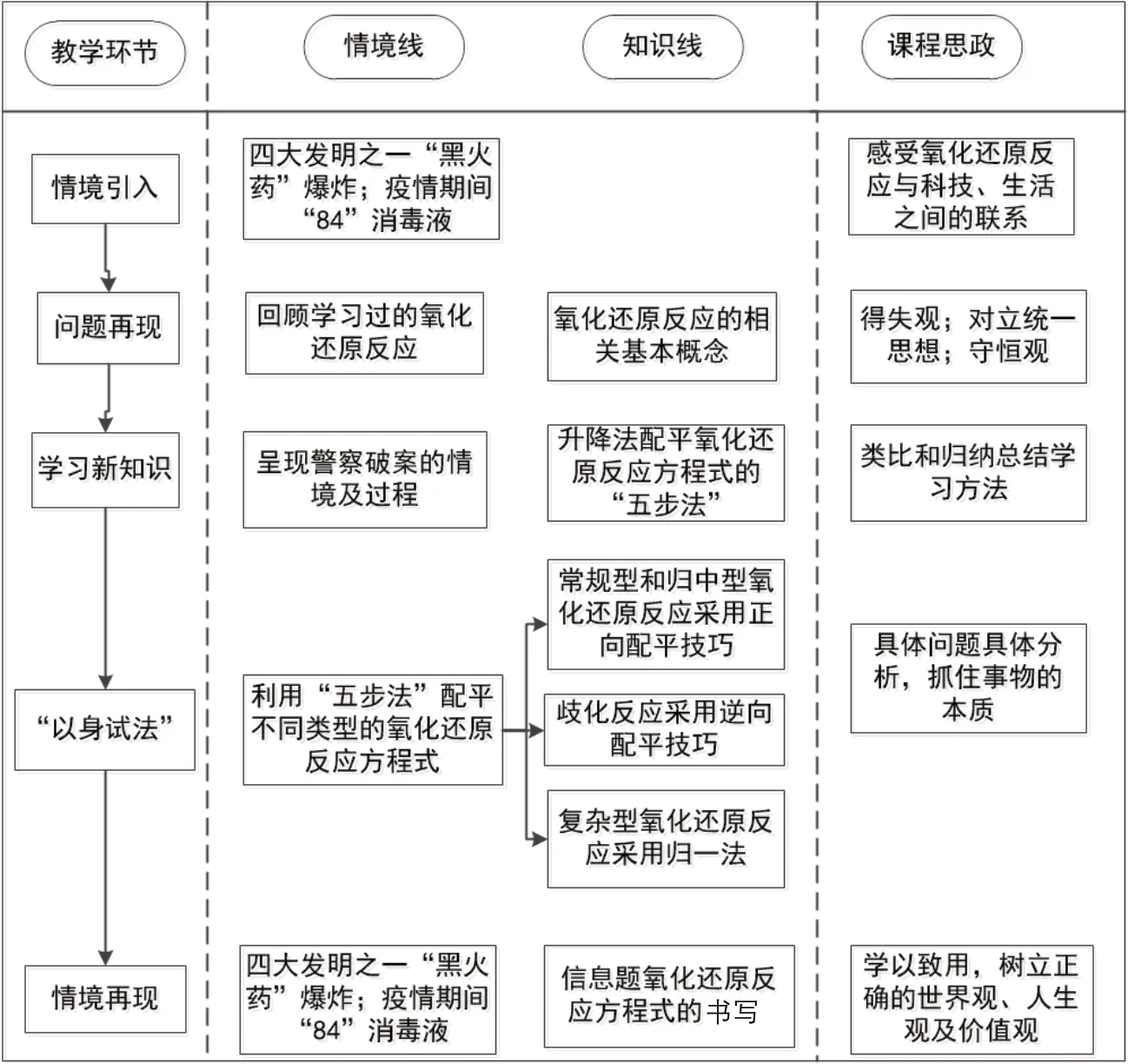
圖1 教學設計思路
2.2 教學過程
2.2.1 復習回顧,導入新課
教師通過多媒體展示中國古代四大發明之一“黑火藥”、新冠疫情期間使用的“84”消毒液等實例,引出氧化還原反應。實際生產生活中有許多氧化還原反應的例子,以生活中的情境或者歷史故事作為引入,這樣做可以更好地吸引學生的注意力。通過介紹中國古代四大發明,學生深刻感受中國古代勞動人民的智慧結晶及我國深厚的科技底蘊;通過介紹抗疫過程中大顯身手的“84”消毒液,學生深刻感受到我國科研人員的刻苦鉆研精神和對科學事業的執著追求。
學生思考并回答教師提出的問題,回顧復習氧化還原反應相關的概念。問題1:氧化還原反應的特征是什么?問題2:氧化還原反應的實質是什么?問題3:什么是氧化劑和還原劑,氧化產物和還原產物?通過回答問題1 和問題2,即失去電子指化合價升高、得到電子指化合價降低,讓學生明白失去并不意味著失敗,得到并不意味著成功,以此樹立正確的得失觀[3]。通過回答問題3,讓學生明白氧化還原反應從微觀上表現為電子得失,宏觀上表現為元素化合價的變化,明白站在不同角度分析問題時,所看到的事物不同,要學會透過現象看本質。氧化還原反應是氧化反應和還原反應同時存在的反應,并且是對立雙方,但是二者仍能夠共存,使學生樹立對立統一的思想。
2.2.2 情境類比,學習新知
氧化還原反應實質是電子轉移,包括電子得失和電子對偏移兩部分,其中,電子不會憑空產生和消失,所以一個氧化還原反應滿足得失電子守恒;氧化還原反應也是一個化學反應,滿足質量守恒定律;如果將氧化還原反應方程式書寫為離子反應方程式時,還需滿足電荷守恒規律。因此,配平氧化還原反應方程式時,需要滿足“三大守恒”:質量守恒、電荷守恒以及電子守恒。接下來根據這三大守恒,學習用升降法配平氧化還原反應方程式。具體的情境類比和知識線見表1。

表1 情境類比與學習新知的內容
氧化還原反應方程式的配平是學生必須掌握的知識點,也是配平不同類型氧化還原反應方程式的基礎,教師需要向學生闡述清楚配平中各個步驟的含義。通常情況下,教師直接告訴學生配平氧化還原方程式的“五步法”,學生機械記憶,接著“套公式”配平氧化還原反應方程式。這種“套公式”的方法,適用于理解能力較好的同學,但是,一些理解力較差的學生不理解配平中具體每一步驟的含義,碰到不同類型的氧化還原反應方程式時,仍不會配平。類比是學習科學知識的重要思維方式,學科與學科之間、學科與生活之間等都有相似的元素,結合類比的思維方式,往往可以利用已知解決未知。基于上述分析,教學過程中,為了更好地讓學生理解配平氧化還原反應方程式的方法,選擇警察破案的過程,類比總結出“五步法”。此時,學生不是簡單地機械記憶,而是通過自己的理解總結出方法,整個學習氛圍是輕松愉悅的。
2.2.3 具體問題具體對待,學習配平技巧
依據“五步法”配平氧化還原反應方程式時,重點是第二步“找”,要正確找到方程式中化合價升降的關系數,即得失電子數,才能順利進行后面幾步驟,正確配平氧化還原反應方程式。例如配平Na2O2+ CO2— Na2CO3+ O2時,Na2O2中氧元素的化合價既升高又降低,升高至O2中的0 價,降低至Na2CO3中氧的-2 價。因為化合價升降總數=化合價的變化數×變化的原子個數,所以要準確判斷原子個數。為了能夠準確判斷原子個數,第一步“標”的時候,要分別標兩個生成物中的氧元素。綜上所述,在配平不同類型的氧化還原反應方程式時,需要考慮以生成物為基準物,還是反應物為基準物,計算化合價升降總數。
根據配平氧化還原反應方程式的“五步法”,分別配平以下方程式:
方程1:Cu + HNO3(稀) — Cu(NO3)2+ NO +H2O
方程2:SO2+ H2S — S + H2O
方程3:Cl2+ NaOH — NaCl + NaClO + H2O
方程4:FeS2+ O2— Fe2O3+ SO2
以上三類氧化還原反應方程式,方程式1 屬于常規型氧化還原反應,方程式2 屬于氧化還原反應中的一種“歸中反應”類型,即被氧化、被還原的元素分別在不同物質中的氧化還原反應。在配平常規型以及歸中型這兩類氧化還原反應方程式時,從左邊反應物著手配平,也就是選擇反應物為基準物質,分別列得失,計算化合價升降總數,即采用的方法是“正向配平法”。方程式3 屬于“歧化反應”,即被氧化、被還原的元素在同一物質中的氧化還原反應,配平時從右邊生成物著手配平,即選擇氧化產物、還原產物為基準物質,分別列得失,計算化合價升降總數,所采用的方法叫作逆向配平法[4]。方程式4 中,FeS2中Fe 和S 的化合價,以及O2中O 的化合價都發生了變化。當一個氧化還原反應方程式中,存在三種及三種以上元素化合價發生變化時,并且同一物質中存在兩種或兩種以上元素化合價發生變化,分別計算各個元素化合價發生變化的總數,接著計算化合價升的總數和化合價降的總數。FeS2中Fe 的化合價總共升高了2,S 的化合價總共升高了12,O2中O 的化合價總共降低了4,因此在該方程式中,化合價總共升高了14,化合價總共降低了4。由此,可準確計算出化合價升降的總數。
設計的意圖:氧化還原反應方程式分為常規型、歸中反應類型、歧化反應類型以及復雜型等幾種類型。為了準確計算不同類型氧化還原反應方程式的化合價升降總數,所選取的基準物是不同的,即要分清主要內容與次要內容,抓住重點。因此,在配平氧化還原反應方程式時,也向學生滲透了在對待不同類型的事物時,要學會抓住重點,分清主次,具體問題具體分析的哲理。
2.2.4 情境再現,學以致用
學習完本節課的內容后再給出導入時的兩個情境。情境1:火藥是中國古代的“四大發明”之一,永遠值得中華兒女驕傲,對其的學習能夠激勵我們奮發圖強。黑火藥的主要成分有KNO3、木炭、硫磺等,在發生爆炸時,會產生氮氣、二氧化碳等氣體,同時還有K2S 生成,請根據上述表述,寫出相關的氧化還原反應方程式。情境2:“84”消毒液(主要成分是NaClO)和潔廁靈(主要成分是濃鹽酸)不能混用,這是因為二者反應會生成一種有刺激性氣味的氣體(氯氣),請用氧化還原反應方程式解釋。
設計的意圖:本部分為配平信息型氧化還原反應方程式,是本節課的拓展與應用。高考題中通常以信息題的形式讓學生書寫氧化還原反應方程式,因此,日常練習應注重信息型氧化還原反應方程式的配平。本節課的開始以黑火藥的爆炸以及疫情期間使用的“84”消毒液為情境導入課堂,在本節課的結尾揭示情境中的化學原理,學生可以感受到化學與生活之間的關聯,明白學習的重要性,從而樹立正確的學習觀。
3 結束語
本文嘗試將情境與課程思政教育融合在一起,進行關于“氧化還原反應方程式的配平”的教學設計,這不僅能夠調動學生的學習積極性、激發學生的學習興趣,還有助于培養學生的思想道德素質和科學的思維。配平氧化還原反應方程式最重要的是掌握配平方法和技巧,本文通過類比警察破案的步驟,讓學生學習配平方法,不是機械地向學生傳授知識,而是讓學生自己總結“五步法”,有利于形成情境—知識之間的聯系,并且掌握類比的科學思維方法。整個教學設計向學生滲透了辯證唯物主義思想。為落實立德樹人的根本任務,培育全面發展的社會主義建設者和接班人,化學教師在日常教學中要有滲透課程思政元素、做到學科育人的意識。

