CYP2C19基因型檢測指導抗血小板治療缺血性腦卒中的療效及對預后的影響
楊華榮, 鄭江環
(貴州醫科大學第二附屬醫院, 1. 神經內二科, 2. 神經內科, 貴州 凱里, 556000)
缺血性腦卒中(IS)是臨床較為常見的腦血管疾病,致殘率和病死率較高。目前,臨床對IS的治療以抗血小板藥物為主,但患者需長期服用,才能維持良好的效果[1]。臨床常用藥物以氯吡格雷為主,雖然可獲得良好治療效果,但療效穩定性較差[2]。研究[3-4]發現,對于長期服用氯吡格雷患者而言, 50%以上可能會出現療效降低情況,且用藥后出血發生率較高,說明患者出現了氯吡格雷抵抗,提示臨床對藥物劑量應加以調整。對于攜帶CYP2C19功能缺失型基因的IS患者而言,服用氯吡格雷藥物后血小板聚集率將明顯增高[5]。受到自身疾病和治療的影響,患者主要心腦血管不良事件(MACCE)發生率也明顯升高[6]。本研究通過對IS患者行CYP2C19基因型檢測以指導用藥,分析治療效果及患者MACCE發生的影響因素,旨在為IS臨床治療和預后改善提供理論依據,現報告如下。
1 資料與方法
1.1 一般資料
選取2020年1月—2022年1月入院接受治療的130例IS患者為研究對象,采用隨機數字表法將其分為對照組(n=65)和觀察組(n=65)。對照組男42例,女23例; 年齡47~76歲,平均(63.45±7.91)歲; 合并糖尿病9例,合并高血壓16例。觀察組男43例,女22例; 年齡47~76歲,平均(63.45±7.91)歲; 合并糖尿病11例,合并高血壓14例。2組相關資料比較,差異無統計學意義(P>0.05)。本研究經醫院醫學倫理委員會審核批準(倫理批號TJIRB20191126)。 納入標準: ① 符合《急性冠狀動脈綜合征急診快速診治指南(2019)》[7]診斷標準者; ② 經影像學檢查確診為IS者; ③ 發病72 h內入院治療者; ④ 臨床資料完整且簽署知情同意書者。排除標準: ① 對本研究選用藥物過敏者; ② 近期有腦出血或其他出血性疾病者; ③ 肝功能或凝血功能異常者; ④ 處于妊娠期或哺乳期者; ⑤ 造血功能異常者; ⑥ 慢性炎性疾病者; ⑦ 存在自身免疫功能障礙者; ⑧ 合并惡性腫瘤者。
1.2 方法
對照組患者接受阿司匹林(河北敬業醫藥,國藥準字H20171021, 規格75 mg/片)和氯吡格雷(樂普藥業股份有限公司,國藥準字H20123115, 規格100 mg/片)治療,首日劑量均為300 mg/d, 后續的維持劑量分別為100 mg/d和75 mg/d。
觀察組患者首先行CYP2C19基因型檢測,采用Mutation Surveyor 4.0軟件進行基因序列比對分析。序列:CYP2C19基因上游引物5′-AGATGGTGGAGAGTGAGGGGATC-3′, 下游引物5′-GCGTCGTCCGAGTTATTC-3′。根據CYP2C19基因型檢測結果分為快代謝(CYP2C19*1/*1)組(n=30)、中代謝(CYP2C19*1/*2、CYP2C19*1/*3)組(n=20)、慢代謝(CYP2C19*2/*2、CYP2C19*3/*3、CYP2C19*2/*3)組(n=15)。根據基因檢測結果給予患者對應治療,快代謝組患者給予氯吡格雷治療,首日劑量為300 mg/d, 維持劑量為75 mg/d; 中代謝組患者仍采用氯吡格雷治療,首日劑量300 mg/d, 維持劑量150 mg/d; 慢代謝組首日采用阿司匹林和氯吡格雷治療,首日劑量均為300 mg/d, 維持劑量分別為100 mg/d和75 mg/d。
所有患者均隨訪1年,記錄患者MACCE發生情況; 根據是否發生MACCE, 將其分為MACCE組(n=28)和非MACCE組(n=102)。
1.3 觀察指標
① 比較對照組和觀察組(不同代謝組)血小板聚集情況。臨床上采集患者靜脈血2 mL, 分裝于2管EDTA抗凝管中,每管1 mL。取其中1管進行血小板聚集率檢測。采用0.3 mL濃度為3.8%枸櫞酸鈉抗凝置于硅化離心管。1 000轉/min離心10 min, 離心半徑為5 cm, 取上層血漿制得富含血小板血漿(PRP)待測。剩余血液按3 000轉/min離心20 min, 取上層血漿制得血小板血漿。使用比濁法測量血小板的聚集功能。血小板聚集抑制率=(服藥前聚集率-服藥后聚集率)/服藥前聚集率×100%。② 采用改良RANKIN量表(mRS)[8]評估對照組和觀察組(不同代謝組)患者治療前和治療1個月的mRS評分。mRS評分為0~6分,分數越高表示殘疾程度越嚴重。③ 比較對照組和觀察組(不同代謝組)患者MACCE發生率,包括死亡、心力衰竭、心肌梗死、再發腦卒中事件。④ 采用單因素分析MACCE組和非MACCE組臨床資料的差異; 采用多因素Logistic回歸分析探討影響IS患者MACCE發生的獨立危險因素。
1.4 統計學方法
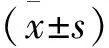
2 結 果
2.1 對照組和觀察組血小板聚集率和抑制率比較
對照組和觀察組治療前血小板聚集率比較,差異無統計學意義(P>0.05); 治療1個月后,對照組、觀察組的血小板聚集率均低于治療前,快代謝組和中代謝組患者治療1個月后血小板聚集率低于對照組,血小板抑制率均高于對照組,差異有統計學意義(P<0.05); 慢代謝組和對照組治療1個月后血小板抑制率、血小板聚集率差異均無統計學意義(P>0.05), 見表1。
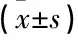
表1 對照組和觀察組血小板聚集率和抑制率比較
2.2 對照組和觀察組治療前后mRS評分比較
治療前, 2組mRS評分比較,差異無統計學意義(P>0.05); 治療1個月后, 2組mRS評分均降低,且觀察組mRS評分較對照組更低,差異有統計學意義(P<0.05), 見表2。
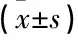
表2 2組治療前后mRS評分比較 分
2.3 對照組和觀察組MACCE發生情況比較
觀察組MACCE發生率低于對照組,且中代謝組MACCE發生率最低,差異有統計學意義(P<0.05), 見表3。

表3 對照組和觀察組MACCE發生率比較[n(%)]
2.4 單因素分析MACCE組和非MACCE組臨床資料差異
MACCE組年齡、高血壓、糖尿病患者占比高于非MACCE組,左心室射血分數(LVEF)<50%患者占比高于非MACCE組,差異有統計學意義(P<0.05), 2組其他資料差異無統計學意義(P>0.05), 見表4。
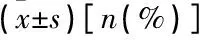
表4 MACCE組和非MACCE組臨床資料的單因素分析
2.5 IS患者MACCE發生的危險因素Logistic回歸分析
將MACCE作為因變量(未發生=0; 發生=1),將年齡、高血壓(無=0; 有=1)、糖尿病(無=0; 有=1)和LVEF(≥50%=0; <50%=1)作為自變量建立Logistic回歸模型。結果發現,年齡大、高血壓、糖尿病和LVEF<50%是MACCE發生的獨立危險因素(P<0.05), 見表5。

表5 IS患者MACCE發生的危險因素的多因素Logistic回歸分析
3 討 論
目前, IS患者可通過多種方式進行治療,以提升患者臨床治療效果,改善預后。血小板活化是血栓性疾病的病理基礎,其中氯吡格雷藥物可有效控制血栓形成,無論是臨床治療還是預防,均可達到良好效果[9]。臨床研究[10]發現,長期服用氯吡格雷藥物治療的腦血管事件發生率較高,主要原因與個體氯吡格雷抵抗的發生存在密切聯系,其中主要作用基因為CYP2C19基因多態性,中國約有50%以上人口攜帶CYP2C19功能缺陷基因。因此通過對患者行CYP2C19基因型檢測,分析其藥物抵抗情況,為患者提供個性化治療,保證臨床治療效果和預后。
IS治療過程中,患者服用氯吡格雷后,主要代謝作用由CYP2C19完成,其可促進活性產物生成并發揮作用,臨床對于CYP2C19基因型檢測發現,根據其代謝效率可分為快代謝型、中等代謝和慢代謝型,應根據患者實際情況,為其適當增加或減少用藥劑量,以達到良好治療效果[11]。TATARUNAS V等[12]證實,CYP2C19*2與CYP2C19*3突變均導致氯吡格雷在肝臟的代謝能力降低,從而使其氯吡格雷抗血小板聚集能力降低,成為攜帶CYP2C19*2與CYP2C19*3突變基因的部分患者出現氯吡格雷抵抗的重要原因。因此,CYP2C19*2、CYP2C19*3被稱為氯吡格雷代謝功能缺失基因[13]。所以對于IS患者而言,盡早判斷其CYP2C19基因型,可預測機體對氯吡格雷的代謝作用,判斷患者是否易出現抵抗現象,以調整用藥方案,有效改善預后[14]。本研究結果發現,治療1個月后,觀察組血小板聚集率均低于對照組,血小板抑制率高于對照組,中代謝組治療1個月后血小板聚集率低于快代謝組和慢代謝組,血小板抑制率高于快代謝組和慢代謝組,提示給予IS患者氯吡格雷和阿司匹林治療后,臨床療效均可得到明顯改善,但經CYP2C19基因型檢測指導藥物治療后,尤其對于中代謝組患者而言,獲益效果更優。HASSANI IDRISSI H等[15]報道,細胞色素CYP2C19基因多態性是氯吡格雷抵抗的一個重要因素,細胞色素P4502C19是將氯吡格雷代謝為活性產物的關鍵酶之一,有諸多突變位點,其中主要突變位點是CYP2C19*2和CYP2C19*3, 兩者作為功能缺失的等位基因,可以用來解釋大多數氯吡格雷抵抗現象。CYP2C19基因的多態性決定了酶存在個體差異,從而影響酶對氯吡格雷的代謝活性產物的濃度及抗血小板聚集作用[16]。ZHANG Y Y等[17]研究發現,CYP2C19*2基因型可影響氯吡格雷的代謝和血小板的抑制效應,首次給予負荷劑量的氯吡格雷后,采用ADP誘導的血小板聚集程度與CYP2C19基因型密切相關,攜帶有CYP2C19*2基因型的患者中殘余血小板聚集率明顯增加。
本研究對2組患者行1年隨訪,結果發現,觀察組MACCE發生率低于對照組,且中代謝組MACCE發生率最低,提示通過檢測CYP2C19基因型,并根據實際情況為患者提供個體化藥物治療,患者遠期效果更為顯著,可降低預后MACCE的發生率。對于臨床長期服用氯吡格雷患者而言,抵抗現象發生率較高,而通過對IS患者首先行基因型檢測,對于存在氯吡格雷抵抗人群盡早識別,并根據患者具體情況給藥治療,能夠最大程度地降低氯吡格雷抵抗的影響[18]。多因素Logistic回歸分析結果發現,年齡大、高血壓、糖尿病和LVEF<50%是IS患者預后MACCE發生的獨立危險因素(P<0.05)。IS主要發病于腦血管,隨著年齡的增大,動脈粥樣硬化發生率增高,引發預后不良[19]。TU W J等[20]研究發現,糖尿病患者血糖持續處于高表達狀態,高血壓病、高血糖會引發血管內皮和微循環障礙,促進粥樣硬化形成,而高血壓病使斑塊在剪切力下破裂,導致不良心腦血管事件的發生,但本研究未發現收縮壓對IS預后MACCE發生率產生影響。 LVEF<50%的IS患者心功能收縮力明顯降低,導致心功能不全和心肌功能受損,患者甚至可能出現呼吸困難等癥狀,增大MACCE發生率[21]。本研究仍存在一定不足,如MACCE組僅有28例,例數過少,可能導致部分結果存在偏倚。
綜上所述,對IS患者行CYP2C19基因型檢測,通過對不同分型患者予以對應治療,可有效改善其血小板聚集和抑制率,降低MACEE發生率,提示CYP2C19基因型可對氯吡格雷抵抗現象盡早識別,尤其對于CYP2C19*1/*2、CYP2C19*1/*3基因型的中代謝患者受益最大。IS患者預后發生MACEE的獨立危險因素包括年齡大、高血壓、糖尿病和LVEF<50%, 臨床應對該類患者的病情進行密切監測,以改善預后。

