血清CST6、IL-17A與多發性骨髓瘤骨病病情嚴重程度及預后的關系
趙思捷,李淼靜,陳羽玲,賀揚欣,王曉寧
多發性骨髓瘤(multiple myeloma,MM)是血液系統常見的惡性腫瘤[1]。MM細胞能分泌一系列細胞因子等產物,引起全身多器官系統的損害,以骨損害最為常見,又稱為多發性骨髓瘤骨病(MM bone disease,MMBD)[2]。MMBD表現為骨質疏松、溶骨性病變及病理性骨折等,嚴重影響患者生活質量及預后[3]。半胱氨酸蛋白酶抑制劑6(cystatin E/M,CST6)屬于胱抑素超家族成員,具有半胱氨酸蛋白酶抑制活性,在黑色素瘤、宮頸癌等惡性腫瘤中發揮腫瘤抑制作用[4]。近年來發現,CST6能夠抑制破骨細胞功能和分化,是MMBD潛在的血清標志物[5]。白介素17A(interleukin-17A,IL-17A) 主要由T輔助細胞17(T helper 17, Th17)分泌,參與病原體感染及自身免疫性疾病等病理生理過程[6]。研究表明,IL-17A能夠抑制機體免疫功能,促進MM細胞增殖,加重MM患者骨破壞[7]。目前MMBD患者血清CST6、IL-17A水平及臨床意義尚不清楚。本研究通過檢測MMBD患者血清CST6、IL-17A水平,分析兩者與MMBD病情嚴重程度及預后的關系,報道如下。
1 資料與方法
1.1 臨床資料 選取2019年2月—2020年1月西安交通大學第一附屬醫院血液內科診治MMBD患者80例為MMBD組,男40例,女40例,年齡41~77(58.48±6.17)歲;體質量指數(23.18±2.23)kg/m2;免疫球蛋白分型:IgG型36例,IgA型20例,IgD型5例,輕鏈型19例;根據MM國際分期體系(International Staging System, ISS)標準;Ⅰ期22例,Ⅱ期33例,Ⅲ期25例[8];骨轉移部位:脊柱45例,肋骨23例,其他12例;溶骨性病變≥2個者44例;骨病類型:骨質疏松17例,溶骨性破壞35例,病理性骨折21例,其他7例。以同期診治的無骨病的MM患者50例為對照組,男26例,女24例,年齡40~78(58.67±6.26)歲;體質量指數(23.24±2.17)kg/m2;免疫球蛋白分型:IgG型20例,IgA型14例,IgD型4例,輕鏈型12例;ISS分期:Ⅰ期13例,Ⅱ期17例,Ⅲ期20例。2組在性別、年齡、體質量指數、免疫球蛋白分型及ISS分期之間比較,差異無統計學意義(P均>0.05)。本研究經醫院倫理委員會審核通過(XJTU1AF2023LSK-2020-132) ,患者及家屬知情同意并簽署知情同意書。
1.2 病例選擇標準 (1)納入標準:①MM診斷符合《中國多發性骨髓瘤診治指南(2015年修訂)》標準[9];②MMBD的診斷符合《多發性骨髓瘤骨病診治指南》標準[10];③初次診治;④臨床及隨訪資料完整。(2)排除標準:①伴有其他器官惡性腫瘤;②合并嚴重心、肺等臟器功能障礙;③合并骨關節炎、強直性脊柱炎及創傷性骨折;④近1個月有激素、雙磷酸鹽等治療史。
1.3 觀測指標與方法
1.3.1 血清CST6、L17A水平檢測:患者入院后次日清晨治療前采集空腹肘靜脈血5 ml,離心留取上層血清。采用酶聯免疫吸附實驗檢測血清CST6、IL-17A水平。人CST6試劑盒購自上海科雷生物科技有限公司,貨號E3893;人IL-17A試劑盒購自上海江萊生物科技有限公司,貨號JL19256。試驗步驟按照試劑盒說明書進行。
1.3.2 MMBD嚴重程度分級:結合CT、MR或PET-CT等影像學檢查,參考《多發性骨髓瘤骨病診治指南》[9],對MMBD患者進行分級。1級:嚴重的彌漫性骨質疏松;2級:1個解剖學部位的1個或多個溶骨性損害;3級:多個解剖學部位的多個溶骨性損害;4級:嚴重溶骨性損害并發病理性骨折。
1.3.3 隨訪情況:所有患者出院后開始隨訪,每3~6個月隨訪1次,采用門診復查及電話方式進行隨訪,主要記錄患者生存情況及生存時間,隨訪截止至2023年2月1日。隨訪終點為患者死亡或隨訪時間結束。根據隨訪結束時患者生存情況,將患者分為生存亞組(n=55)和死亡亞組(n=25)。
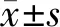
2 結 果
2.1 2組血清CST6、IL-17A水平比較 MMBD組患者血清CST6水平為(2.11±0.27)μg/L,低于對照組的(8.25±1.34)μg/L (t=39.798,P<0.001)。血清IL-17A水平為(25.12±4.27)ng/L, 高于對照組的(12.30±3.21)ng/L (t=18.241,P<0.001)。
2.2 血清CST6、IL-17A與MMBD骨病分級的相關性 Spearman秩相關分析結果顯示,血清CST6與MMBD骨病分級呈顯著負相關(r=-0.721,P<0.001);血清IL-17A與MMBD骨病分級呈顯著正相關(r=0.664,P<0.001)。
2.3 不同預后MMBD患者臨床病理特征比較 死亡亞組ISS分期Ⅲ期、MMBD骨病分級4級、病理性骨折比例及血清IL-17A水平高于生存亞組,而血清CST6水平低于生存亞組,差異均有統計學意義(P<0.05);2亞組其余資料比較,差異無統計學意義(P>0.05),見表1。
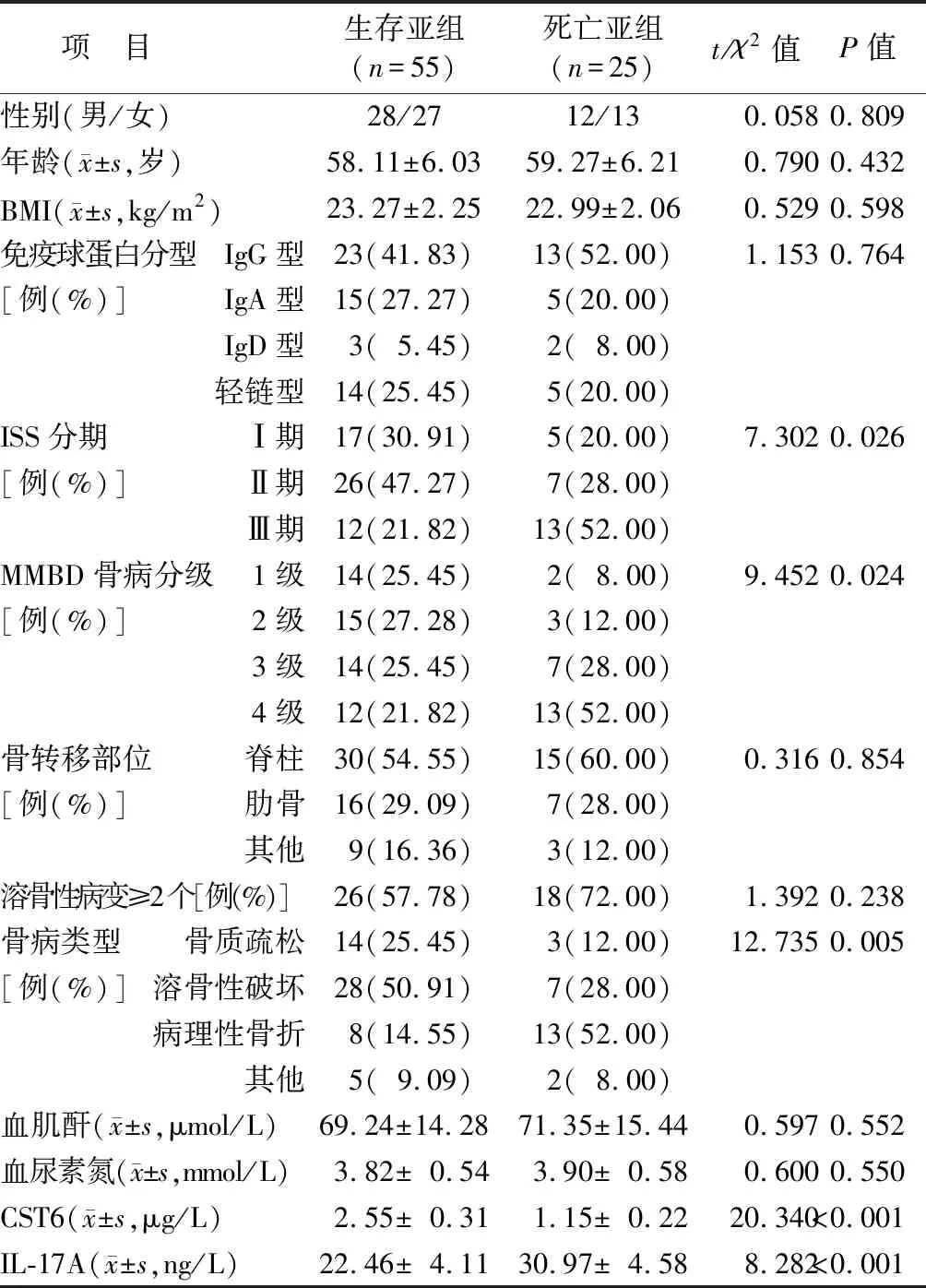
表1 2亞組MMBD患者臨床病理特征比較
2.4 血清CST6、IL-17A對MMBD患者預后評估價值分析 繪制血清CST6、IL-17A對MMBD患者預后評估價值ROC曲線,并計算曲線下面積(AUC),結果顯示:血清CST6、IL-17A及二者聯合對MMBP患者預后評估的AUC分別為0.812、0.888、0.931,以二者聯合的AUC最大 (Z/P=5.147/<0.001,4.784/<0.001),見表2、圖1。
2.5 影響MMBD患者預后的多因素Cox回歸分析 以MMBD患者預后為因變量(賦值:1=死亡,0=生存,t=時間),將表1中差異具有統計學意義的因素(P<0.05)為自變量,進行多因素Cox回歸分析,結果顯示:ISS分期Ⅲ期,骨病分級4級,血清IL-17A高是影響MMBD患者預后的獨立危險因素,血清CST6高是影響MMBD患者預后的獨立保護因素(P<0.01),見表3。
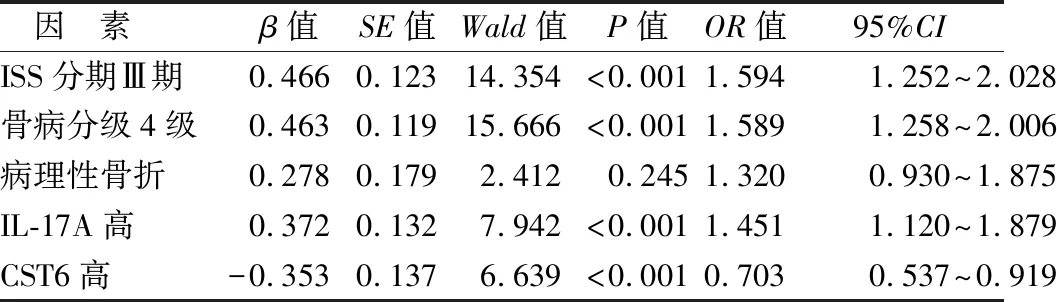
表3 影響MMBD患者預后不良的多因素Logistic回歸分析
2.6 血清CST6、IL-17A水平與MMBD患者生存預后的關系 MMBD患者80例隨訪中死亡25例,失訪3例。分別以ROC曲線中血清CST6、IL-17A對預后評估的最佳截斷值1.71 μg/L、26.14 ng/L為界,將MMBD患者分為CST6高表達亞組(n=39)和低表達亞組(n=41),IL-17A高表達亞組(n=38)和低表達亞組(n=42)。CST6高、低表達亞組MMBD患者的3年生存率分別為84.62%(33/39)、53.66%(22/41),Kaplan-Meier曲線顯示,CST6低表達亞組3年累積生存率低于CST6高表達亞組(Log-rankχ2=7.933,P=0.005)。IL-17A高、低表達亞組MMBD患者的3年生存率分別為44.74%(17/38)、90.48%(38/42),Kaplan-Meier曲線顯示,IL-17A高表達亞組3年累積生存率低于IL-17A低表達亞組(Log-rankχ2=22.802,P<0.001),見圖2。
3 討 論
MMBD是MM的嚴重并發癥,患者表現為骨痛、廣泛骨質疏松及病理性骨折等,嚴重影響MM患者生存質量及預后。MM發生時,骨髓成骨細胞及其信號傳導通路的抑制、破骨細胞及其分化相關信號通路活性增加,引起骨吸收和骨形成平衡的失調,導致MMBD的發生[11]。目前MMBD的診斷主要依賴影像學檢查,但影像學檢查具有滯后性,確診時疾病往往處于進展期或終末期,患者臨床預后較差[2]。深入研究MMBD疾病機制,尋找能夠評估MMBD疾病嚴重程度及預后的血清標志物,對于MMBD疾病診治及預防,具有重要的臨床意義。
CST6屬于2型胱抑素家族成員,由149個氨基酸組成,結構上含有28個殘基的信號肽,其作為半胱氨酸蛋白酶的胞外多肽抑制劑,能夠抑制組織蛋白酶B、組織蛋白酶L等蛋白酶活性[12]。近年來發現,乳腺癌等惡性腫瘤中CST6表達顯著下調,其表達下調促進腫瘤侵襲和骨轉移的發生[13]。本研究中,MMBD患者血清CST6水平降低,與既往學者在CD138陽性MM骨髓瘤細胞中應用二代測序檢測的CST6 mRNA表達下調的結果一致[5]。MMBD患者血清CST6水平降低可能與表觀遺傳學調控異常有關。有研究發現,CST6基因啟動子區的高甲基化狀態導致乳腺癌中CST6表達顯著降低,而應用5-氮雜-2’-脫氧胞苷去甲基化后,腫瘤細胞中CST6表達顯著增加[4]。本研究中,血清CST6與MMBD骨病分級呈負相關,提示CST6的表達下調參與MMBD的疾病進展。有研究發現,MM中CST6能夠抑制組織蛋白酶K切割鞘氨醇激酶1,抑制經典和非經典的核因子κB通路激活,抑制破骨細胞的分化成熟,而CST6表達下調促進破骨細胞的增殖,導致MMBD的發生[5]。尚有研究報道,CST6的表達下調能夠激活組織蛋白酶L,促進破骨細胞前體的去極化,激活破骨細胞,促進骨小梁吸收及骨重塑過程[14]。本研究中,CST6低表達MMBD患者預后較差,提示血清CST6水平有助于評估MMBD患者的預后。筆者分析,一方面是CST6低表達的MM腫瘤細胞惡性程度較高,腫瘤細胞的侵襲轉移能力較強,對化療藥物治療敏感性較差,導致MMBD患者不良預后。有研究表明,CST6的表達下調能夠激活T盒家族致癌轉錄因子2的表達,促進乳腺癌等腫瘤細胞的增殖、侵襲、腫瘤血管生成及化療耐藥性的形成,導致患者不良預后[4]。另一方面,CST6的表達降低加重MMBD患者骨病的病情嚴重程度,導致患者不良預后。有學者在體外細胞實驗中發現,過表達CST6能夠明顯抑制破骨細胞的分化和骨吸收過程,在MM小鼠模型中進一步證實,應用重組CST6治療MM小鼠,能夠顯著抑制實驗動物MMBD的發生[13]。因此,CST6表達降低參與MMBD疾病的發生發展,是新的MMBD預后評估的血清標志物。
IL-17A是IL-17受體家族的成員,參與宿主防御、細胞運輸、免疫調節和組織修復等過程,在感染性疾病、炎性反應、自身免疫性疾病及癌癥中發揮調控作用[15]。近年來發現,IL-17A基因的rs2275913位點的遺傳多態性與MM患者骨病嚴重程度有關[7],提示IL-17A是潛在的MMBD血清標志物。本研究中,MMBD患者血清IL-17A水平升高,與既往研究報道一致[16]。MMBD患者血清IL-17A水平升高與骨髓微環境中CD4+T亞群Th17細胞活化有關。研究表明,MM腫瘤細胞和腫瘤相關成纖維細胞產生促炎細胞因子環境,促進腫瘤微環境中Th17細胞的募集、活化和增殖,導致IL-17A水平增加[17]。本研究中,血清IL-17A水平與MMBD病情嚴重程度有關。分析其原因,IL-17A能夠刺激MM中的未成熟樹突狀細胞,上調活化T細胞核因子1的表達,促進未成熟樹突狀細胞的破骨細胞樣分化,導致溶解性骨損傷,加重MMBD病情程度[18]。另外, IL-17A能夠通過上調NOD樣受體熱蛋白結構域相關蛋白3,誘導成骨細胞焦亡的發生,抑制成骨細胞增殖,而成骨細胞的焦亡能夠釋放白介素-1β和核因子κB受體活化子配體,破壞骨代謝過程[19]。本研究中,IL-17A高表達MMBD患者預后較差,多因素分析提示IL-17A高表達是影響MMBD患者不良預后的獨立危險因素,表明檢測血清IL-17A水平對MMBD患者的預后有預測作用。分析其原因,一方面是IL-17A水平升高能夠結合MM腫瘤細胞表面的相應受體,激活核因子κB信號通路,促進MM腫瘤細胞的惡性增殖,導致MMBD患者不良預后[7]。另一方面,IL-17A水平升高提示MMBD患者中Th17細胞的過度活化,Th17細胞能夠激活骨髓微環境中T淋巴細胞,促進破骨細胞的生成及骨破壞,加重MMBD骨病嚴重程度,導致患者不良預后[20]。
綜上所述,MMBD患者血清CST6水平降低,IL-17A水平升高,兩者與MMBD患者病情嚴重程度有關,均參與MMBD疾病進展。ISS分期、骨病分級、血清IL-17A是影響MMBD患者預后的獨立危險因素,血清CST6是影響MMBD患者預后的獨立保護因素。通過檢測血清CST6和IL-17A水平,有助于臨床醫生評估MMBD病情程度及預后評估。本研究也存在不足之處,本研究為單中心回顧性研究,樣本量有限,有待今后設計前瞻性多中心大樣本臨床試驗進一步研究。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
趙思捷:設計研究方案,實施研究過程,論文撰寫;李淼靜:提出研究思路,論文審核;陳羽玲:實施研究過程,資料搜集整理,論文修改;賀揚欣:進行統計學分析,論文修改;王曉寧:論文撰寫

