血清外泌體LncRNA PCAT1 在早期非小細胞肺癌診斷中的潛在價值研究
柳秋霞,蔡云祥,李勇,萬誠誠,嵇龍飛,胡燕勤
肺癌是全球癌癥相關死亡的主要原因之一,在所有的肺癌患者中,非小細胞肺癌(NSCLC)超過80%[1]。由于缺乏敏感和特異的生物標志物,大多數患者確診時已處于晚期,復發率高,5 年總生存率低于15%[2]。因此,迫切需要開發新的、有效的早期診斷標志物。外泌體是一種細胞外膜囊泡,直徑為30~150 nm。DNA、RNA 和蛋白質等生物活性因子可被包裹到外泌體中,進入細胞外環境[3]。據報道,RNA 是腫瘤細胞衍生的外泌體的主要成分,可以反映腫瘤進展和腫瘤細胞的動態過程[4]。而且外泌體膜可以保護各種類型的RNA 免受循環中的RNase酶降解。近年來,外泌體作為一種新的遞送系統和治療靶點,在醫學領域得到了廣泛的研究。其被認為是一種非侵入性液體活檢技術,有助于惡性腫瘤的診斷[5]。長鏈非編碼RNA(LncRNA)是一類大小超過200 個核苷酸的異質轉錄物,沒有編碼潛力[5]。其在血清外泌體中含量豐富,并被認為是腫瘤發生和發展的關鍵因素,包括NSCLC[6]。本研究探索外泌體lncRNA在NSCLC早期診斷中的值,報道如下。
1 資料與方法
1.1 一般資料 回顧性分析2017 年1 月至2020 年3 月湖州市第一人民醫院收治的206 例NSCLC 患者臨床資料。納入標準:符合2015 年世界衛生組織肺腫瘤分類[7],并經組織病理學診斷為NSCLC,且為首次確診患者。排除標準:(1)入院前接受化療或放療的患者;(2)合并其他惡性腫瘤、傳染性疾病者;(3)合并嚴重心、肝、腎等重要臟器功能障礙者。另選性別和年齡與NSCLC 患者相匹配的健康體檢者200 例。將所有樣本按3 ∶1 比例隨機分為訓練集(50 例NSCLC 和50 例健康對照)和驗證集(156 例NSCLC 和150 例健康對照),具體特征見表1。另外,為了鑒定NSCLC 中失調的外泌體LncRNA,選擇3 例NSCLC 患者[男2 例,女1 例;年齡(59.0±5.57)歲]和3 例健康對照個體[男2 例,女1例;年齡(60.0±7.0)歲]的血清樣本。本研究獲得了湖州市第一人民醫院醫學研究與臨床試驗倫理委員會批準,患者知情同意。
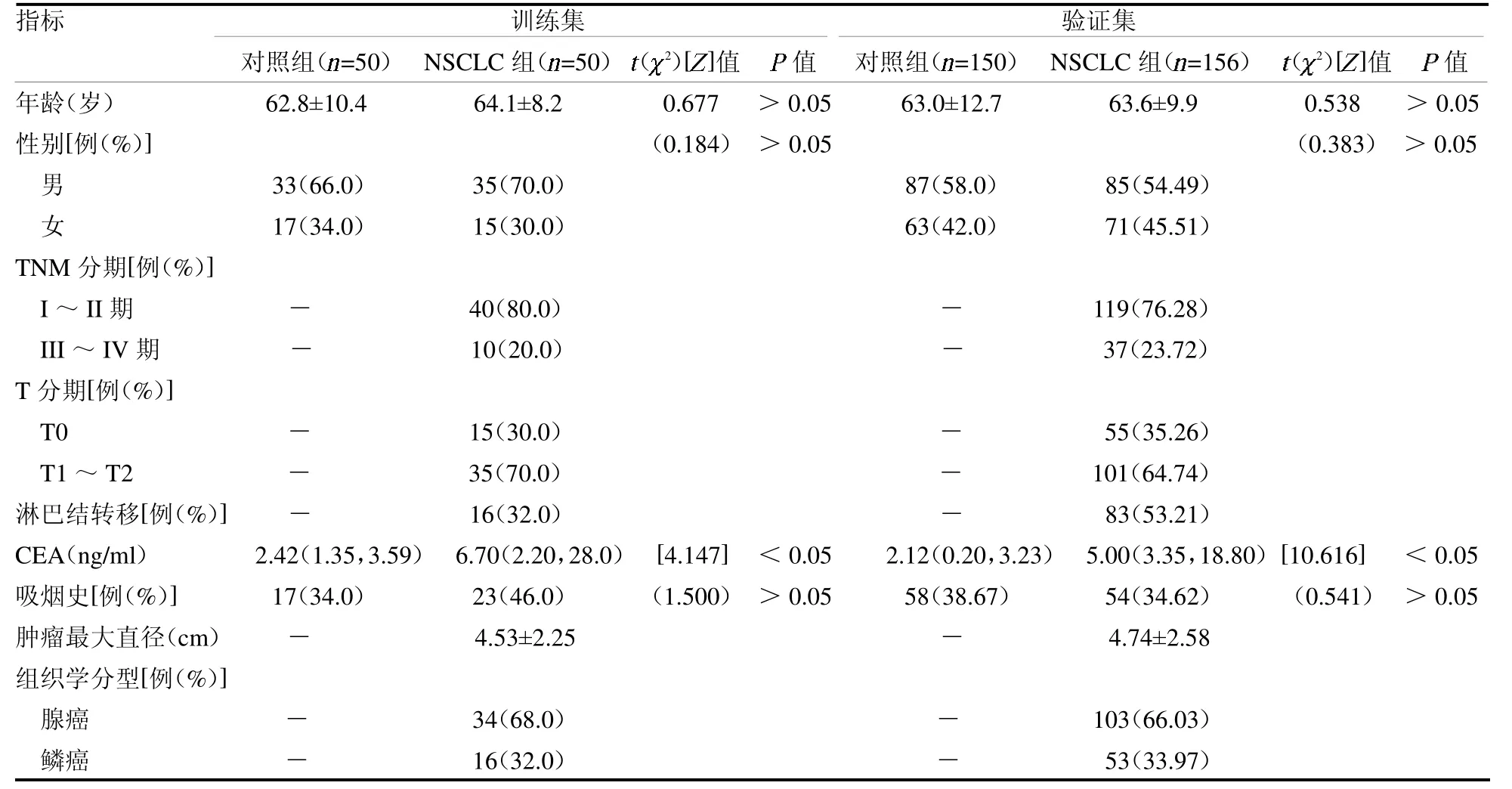
表1 訓練集和驗證集參與者人口統計學特征和病理特征比較
1.2 方法
1.2.1 血清外泌體分離和鑒定 通過兩步離心方案將研究對象的5 ml 靜脈血分離為血清和細胞沉淀(3 800 r/min,4 ℃離心5 min;15 000 r/min,4 ℃離心5 min)。將血清上清液轉移到不含RNase 的管中以供進一步檢測。使用100l 總外泌體分離試劑(美國Invitrogen)從500l 血清中分離外泌體,混合物以15 000 r/min 離心10 min 后,將含有外泌體的顆粒重懸于200l 磷酸鹽緩沖液(PBS)中。(1)通過透射電子顯微鏡(TEM)觀察外泌體的形態,TEM型號:H-7600 型(日本Hitachi)。(2)通過納米粒子跟蹤分析(NTA)評估分離的外泌體的大小分布和濃度,納米顆粒追蹤分析儀型號:ZetaView PMX 110(德國Particle Metrix)。(3)通過蛋白印跡分析檢測外泌體標記蛋白腫瘤易感基因101 蛋白(TSG101)、熱休克蛋白70(HSP70)和溶酶體顆粒糖蛋白63(CD63)抗體(1 ∶1 000,美國Santa Cruz Technologies)。
1.2.2 血清外泌體RNA 提取 使用HiPure 外泌體RNA試劑盒(德國Qiagen)分離總外泌體核糖核酸,使用miRNeasy Mini 試劑盒(Qiagen)純化外泌體RNA,使用(美國Thermo Fischer Scientific)對RNA 純度和濃度進行定量。
1.2.3 高通量測序(RNA-Seq)及LncRNA篩選 外泌體RNA 測序委托RiboBio 生物技術公司(中國廣州)完成。首先根據NEBNext 超定向RNA 文庫制備試劑盒的標準方案,將外泌體RNA逆轉錄并擴增為雙鏈cDNA,然后進行銜接子連接和富集。通過Agilent 2200 Tape 工作站(美國安捷倫)和熒光計(美國Life Technologies)驗證文庫產品,在HiSeq3000 配對末端流動槽上稀釋,然后測序(HiSeq3000 系統,2×150 bp)。用TopHat 軟件2.1.1 版將測序數據與內參基因進行比較,表達水平以每千個堿基長度中所包含的測序片斷數(FPKM)計算。采用Cufflinks 法量化基因表達值,篩選差異基因。本研究中差異基因的篩選標準為錯誤發現率<0.05,基因表達值計算為log2(FPKM)。
1.2.4 實時熒光定量聚合酶鏈式反應(qRT-PCR)檢測血清外泌體lncRNA PCAT1(exoPCAT1) 使用MMLV 轉錄酶(美國Promega)從500 ng 血清外泌體RNA 中產生第一鏈cDNA,在CFX96 qRT-PCR 檢測系統(美國Bio-Rad)上進行qRT-PCR,使用(Ct是閾值周期)公式測量lncRNA PCAT1 表達水平。PCR 反應條件:95 ℃預變性30 s,1 次循環;95 ℃變性10 s,59.5 ℃退火30 s 和72 ℃延伸90 s,42 次循環。引物序列:LncRNA 前列腺癌癥相關ncRNA 轉錄物1(PCAT1):5’-TTTGAGGATGCGGGTGAA-3’(前向)和5’-ATGAGGAAGTGGACGAGATG-3’(后向);內參甘油醛-3-磷酸脫氫酶(GAPDH):5’-GACTCATGACCACAGTCCATGC-3’(前向)和5’-AGAGGCAGGGATGATGTTCTG-3’(后向)。
1.2.5 血清腫瘤生物標志物檢測 使用Elecsys 電化學免疫測定法(美國Roche),在Cobas 8000 模塊化分析儀(美國Roche)中檢測血清癌胚抗原(CEA)水平,其正常值范圍為0 ~5 ng/ml。
1.3 統計方法 使用SPSS 25.0 統計軟件進行數據分析。正態分布計量資料以均數±標準差表示,采用獨立樣本t 檢驗;偏態分布計量資料以M(P25,P25)表示,組間比較采用Mann-Whitney 秩和檢驗;計數資料以百分比表示,組間比較采用檢驗;繪制受試者工作(ROC)曲線分析exoPCAT1 對NSCLC 的診斷效能。P <0.05 表示差異有統計學意義。
2 結果
2.1 血清外泌體鑒定 從NSCLC 患者和健康對照者的血清外泌體表現出相似的典型脂質雙層膜形態(圖1a),囊泡顆粒的直徑主要在30 ~200 nm,NSCLC患者提取的外泌體的總濃度為26.38×106/ml,健康對照組為18.41×106/ml(圖1b);此外,蛋白印跡分析表明,在富含外泌體的沉淀中存在特異性外泌體標記蛋白(TSG101、HSP70 和CD63)(圖1c)。兩組均成功從血清中分離出了外泌體。
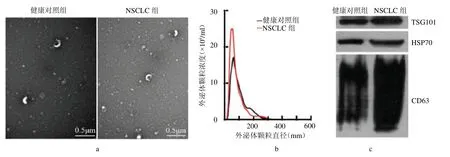
圖1 兩組血清外泌體特征鑒定
2.2 RNA-seq 及LncRNA 篩選 對3 例NSCLC 患者和3 例健康對照者的血清樣本表達譜進行標準化后,箱式圖證明了該微陣列的良好質量(圖2a)。兩組樣本間的熱圖,共發現433 781 個外泌體LncRNA在NSCLC和健康對照組血清樣本之間差異表達(變化倍數>1.5,P <0.05,圖2b)。其中,與健康對照組血清樣本相比,NSCLC血清樣本中405 個外泌體LncRNA 上調,376 個外泌體LncRNA 下調(圖2c)。
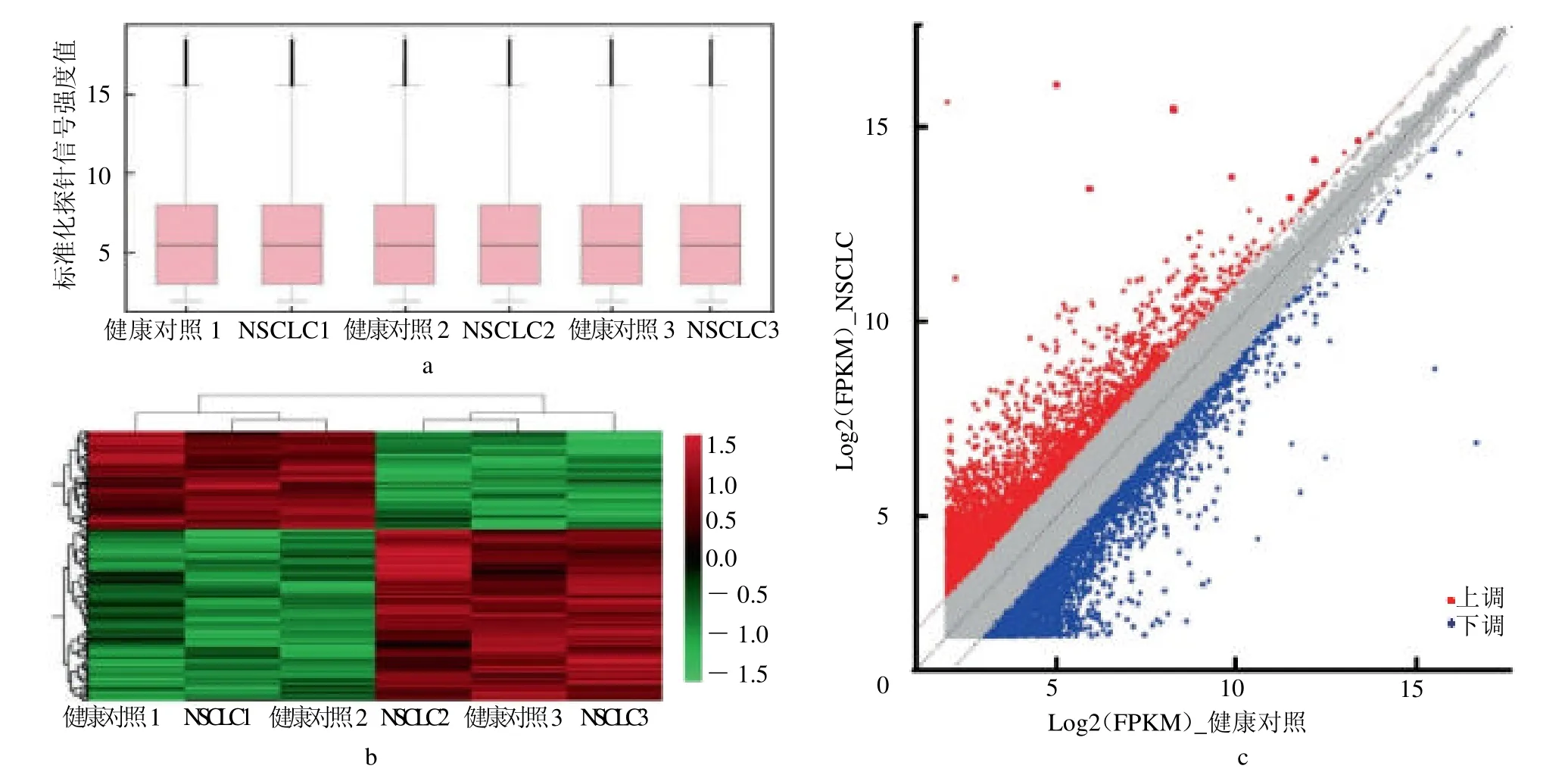
圖2 血清樣本中外泌體LncRNA 微陣列的質量控制和基因scatter 圖
2.3 訓練集中外泌體LncRNA 臨床驗證及血清exoPCAT1 表達分析 在訓練集中,利用qRT-PCR 法對差異性表達最顯著的前20 個外泌體LncRNA(10個上調和10 個下調外泌體LncRNA)進行檢測,結果與RNA-seq 數據一致(P >0.05,圖3a)。其中exoPCAT1 在NSCLC 血清樣本中較健康對照組過表達[2.24(1.45,3.44)vs 0.92(0.57,1.30),Z=5.667,P<0.05,圖3b],其他外泌體LncRNA 僅顯示出微弱的差異性表達。
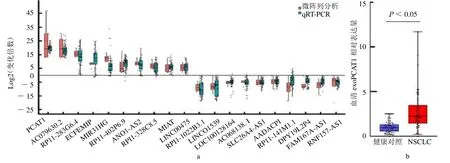
圖3 qRT-PCR 法驗證訓練集血清樣本中外泌體LncRNA 表達量
2.4 驗證集中血清exoPCAT1 表達分析 驗證集NSCLC 組exoPCAT1 相對表達量亦高于健康對照組[2.09(1.32,3.18)vs 0.84(0.56,1.41),Z=10.112,P<0.05,圖4a]。exoPCAT1 診斷NSCLC 的AUC 為0.838(95%CI 0.795 ~0.880,圖4b)。對于早期(I ~II期)和血清CEA正常(<5 ng/ml)的NSCLC患者,exoPCAT1 也有較高的診斷價值,AUC分別為0.789(95%CI 0.737 ~0.841,圖4c)和0.728(95%CI 0.661~0.795,圖4d)。
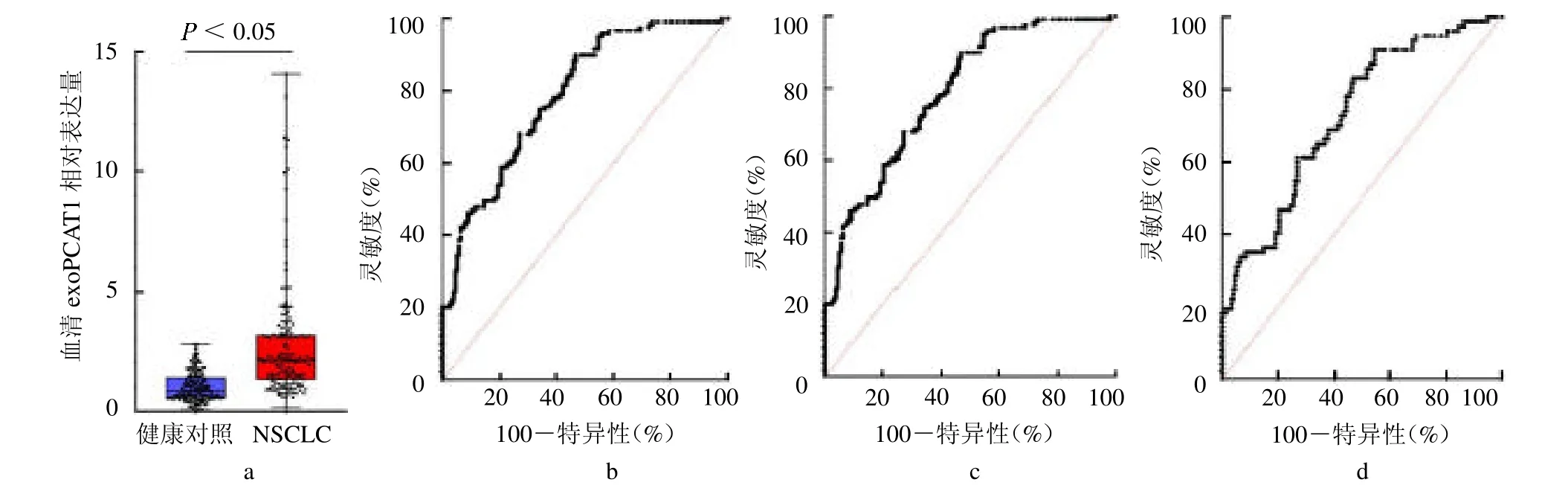
圖4 驗證集血清樣本中exoPCAT1 對NSCLC 的診斷價值
2.5 驗證集中血清exoPCAT1 表達與臨床病理特征的關系 根據驗證集中exoPCAT1 表達中位值,將患者分為高表達組(>2.09)或低表達組(≤2.09)。在驗證集中,血清exoPCAT1 表達與疾病進展有關,exoPCAT1 高表達的NSCLC 患者TNM III ~IV 期、T1 ~T2 分期及淋巴結轉移的比例更高(均P <0.05),見表2。
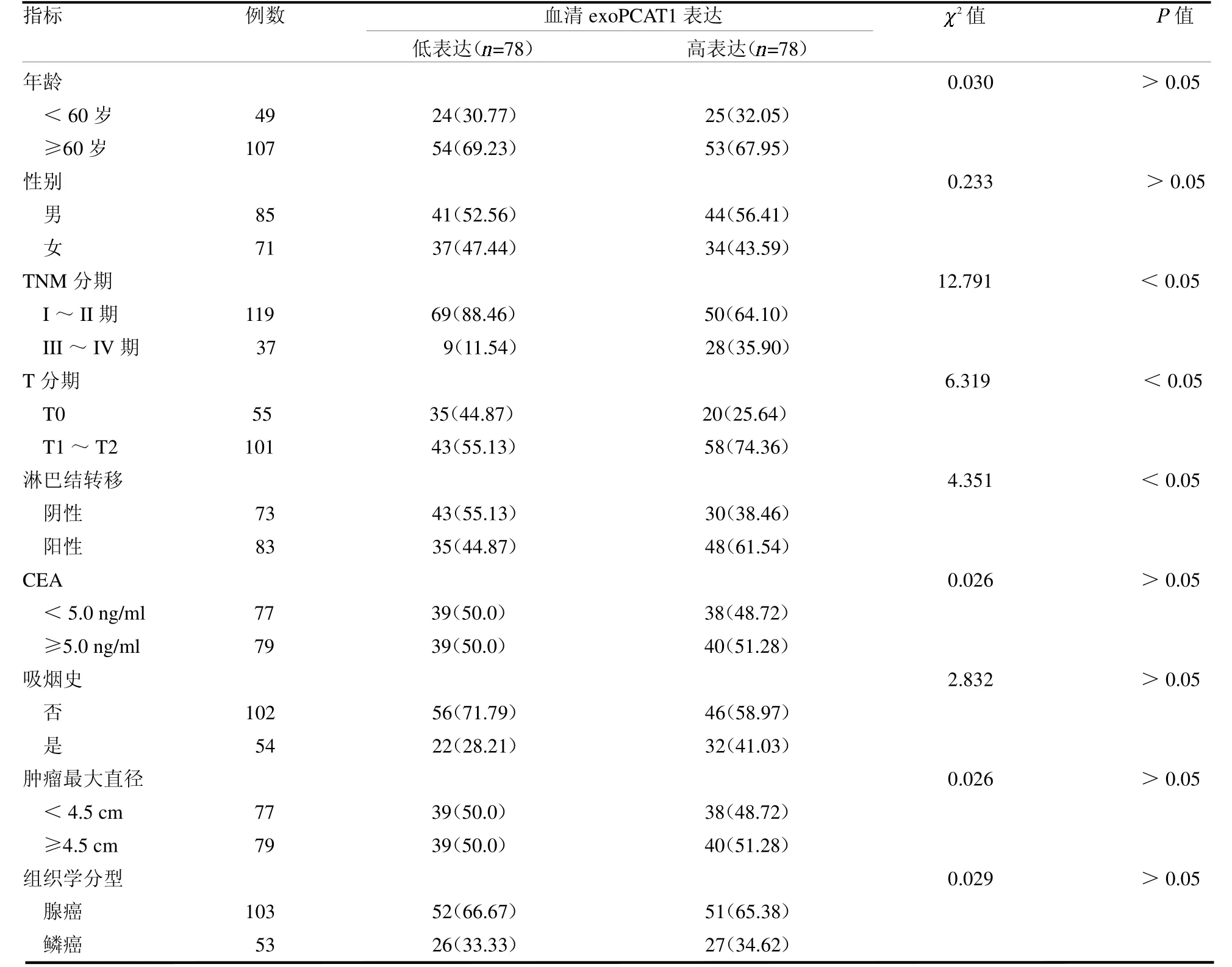
表2 驗證集中血清exoPCAT1 表達與臨床病理特征的關系 例(%)
3 討論
外泌體是一種內源性的納米級細胞外脂質雙層囊泡,人體中幾乎所有類型的細胞均能產生外泌體,其包含豐富的生物活性成分,可作為疾病的候選生物標志物[3]。有研究表明,LncRNAs 在血液外泌體中是穩定的,對NSCLC 有診斷潛力。本研究RNASeq 和qRT-PCR 數據均表明,血清exoPCAT1 在NSCLC 中表達上調[8]。ROC 曲線數據支持exoPCAT1 可以區分早期(I~II期)及CEA水平正常(<5 ng/ml)的NSCLC 患者。
外泌體具有獨特的穩定性,并且可動態檢測,特別是非編碼RNAs已成為有希望的腫瘤生物標志物。本研究發現LncRNA PCAT1 存在于血清外泌體中,并通過RNA-Seq 顯示在NSCLC 中表現高水平。LncRNA PCAT1 被發現是一種高度保守的LncRNA,位于20 號染色體上,含有兩個外顯子。有研究發現,PCAT1 在許多人類癌癥中失調,與致癌作用、臨床病理特征和預后有關[9]。PCAT1 被證實在NSCLC 中上調,并促進細胞增殖和轉移。有研究發現,LncRNA PCAT1 可通過調節SOX2 啟動子區來誘導SOX2 的表達,進而抑制下游cGAS/STING 途徑調節NSCLC 中的細胞毒性T 細胞浸潤,從而產生免疫抑制性腫瘤微環境[10]。另外,生物信息學和表達相關性分析顯示[11],PCAT1 和dyskerin 偽尿苷合成酶1(DKC1)蛋白(一種RNA 結合蛋白)之間存在潛在的相互作用。此外,PCAT1 可激活NSCLC細胞中的血管內皮生長因子/蛋白激酶B/Bcl-2/caspase9 通路,進而影響細胞生物學過程,包括增值、侵襲、遷移等[11]。抑制LncRNA PCAT1 可能是NSCLC一種潛在的治療策略,對抗腫瘤和癌癥靶向治療有重要意義。這也從機制方面解釋了NSCLC 患者血清exoPCAT1 水平普遍升高的原因,且exoPCAT1 高表達與疾病進展有關,高表達者TNM III ~IV 期、T1~T2 分期及淋巴結轉移的比例更高(均P <0.05)。
手術是早期NSCLC 最有效的治療方法,然而,多數NSCLC 患者診斷時已是晚期,只有不到30%的患者有明確的手術指征[12]。早期篩查和早診早治對降低NSCLC 死亡率有重要作用[13]。臨床中常規的檢查手段如MRI 或CT 成本過高,且與高假陽性率相關;而腫瘤標志物為臨床決策提供了補充的風險評估[14-15]。NSCLC 患者顯示出高水平的腫瘤標志物CEA,而它們在早期沒有特異性過表達[16]。本研究發現exoPCAT1 在早期NSCLC患者血清中已經過表達,在區分早期NSCLC患者與健康對照人群方面具有可靠的臨床效能,顯示出令人滿意的診斷標志物潛力。
綜上所述,血清exoPCAT1 有望成為NSCLC的非侵入性生物標志物,為NSCLC的早期診斷和藥物治療靶點提供了新的視角。本研究也存在一些局限性。首先,樣本量較少,需增加樣本量以獲得更可靠的結果;其次,進一步進行LncRNA PCAT1 的lncRNA 驗證,證實LncRNA PCAT1 在NSCLC 顯著差異表達的準確性;最后LncRNA PCAT1 參與NSCLC 進展的作用機制以及與臨床治療的關系也值得探索。
利益沖突 所有作者聲明無利益沖突
作者貢獻聲明 柳秋霞:實驗操作、論文撰寫、整理數據、統計學分析;蔡云祥、李勇:收集數據、整理數據、統計學分析;萬誠誠、嵇龍飛:語言潤色、格式修改;胡燕勤:研究指導、論文修改、經費支持

