基于GC-MS和網絡藥理學探究茉莉花根揮發油鎮靜安神作用
陳睿 潘小芳 楊楠 霍麗妮 陳姎玲 梁天堅

摘要:基于GC-MS(氣相色譜質譜聯用儀,Gaschromatography-mass spectrometry)和網絡藥理學探究茉莉花(Jasminum sambac)根揮發油鎮靜安神的作用機制。利用GC-MS技術分析茉莉花根揮發油成分;借助TCMSP、Swiss Target Prediction等數據庫篩選出潛在靶點,再通過CTD(http://ctdbase.org/)數據庫查詢“insomnia”的相關靶點;利用Venny作圖軟件(https://bioinfogp.cnb.csic.es/tools/venny/index.html)取交集靶點,利用STRING數據庫(https://string-db.org/cgi/input.pl)構建蛋白互作網絡(Protein-protein interaction network,PPI),篩選核心作用靶點;利用Cytoscape 3.7.2軟件繪制活性成分-靶點-通路網絡圖,經GO注釋和KEGG富集分析預測主要靶點及信號通路;最后,利用分子對接軟件SYBYL對主要活性成分與其核心靶點進行對接驗證。結果表明,從茉莉花根中共鑒定23個化合物,篩選出12個活性成分,77個靶點。主要作用于CYP19A1、NCOA2、PTGS1、AR、SLC6A2、CA1等多個靶點,影響神經活性配體受體相互作用、癌癥通路等多條信號通路,從而發揮作用。分子對接結果顯示,大部分活性成分與其核心靶點結合性能較好,主要通過疏水鍵和氫鍵相互作用。
關鍵詞:茉莉花(Jasminum sambac); 根; 揮發油; GC-MS(氣相色譜質譜聯用儀); 網絡藥理學;鎮靜安神作用
中圖分類號:R965.1 ? ? ? ? 文獻標識碼:A
文章編號:0439-8114(2023)11-0084-08
DOI:10.14088/j.cnki.issn0439-8114.2023.11.015 開放科學(資源服務)標識碼(OSID):
The sedation and hypnosis effect of volatile oil from the root of Jasminum sambac based on the GC-MS and network pharmacology
CHEN Rui1,2, PAN Xiao-fang1, YANG Nan2, HUO Li-ni1, CHEN Yang-ling1, LIANG Tian Jian2
(1.College of Pharmacy, Guangxi University of Chinese Medicine, Nanning ?530001, China;2.Faculty of Chinese Medicine Science, Guangxi University of Chinese Medicine, Nanning ?530222, China)
Abstract: The mechanism of sedation and hypnosis effect of volatile oil from the root of Jasminum sambac based on the GC-MS and network pharmacology was explored. The volatile oil components in the roots of Jasminum sambac were analyzed using GC-MS technology; potential targets were screened using databases such as TCMSP and Swiss Target Prediction, and relevant targets of “insomnia” were queried using the CTD (http://ctdbase.org/) database; intersection targets were obtained using the Venny mapping software(https://bioinfogp.cnb.csic.es/tools/Venny/index.html), and a protein-protein interaction network (PPI) was constructed using the STRING database (https://string-db.org/cgi/input.pl) to screen core targets of action; an active ingredient-target-pathway network diagram was created using Cytoscape 3.7.2 software, and main targets and signaling pathways were predicted through GO annotation and KEGG enrichment analysis; finally, the docking between the main active ingredients and their core targets was verified using the molecular docking software SYBYL. The results showed that a total of 23 compounds were identified from the roots of Jasminum sambac, and 12 active components and 77 targets were screened. It mainly acted on multiple targets such as CYP19A1, NCOA2, PTGS1, AR, SLC6A2 and CA1, and affected multiple signaling pathways such as neuroactive ligand receptor interactions and cancer pathways, thereby exerting its effects. The molecular docking results showed that most active ingredients had good binding performance with their core targets, mainly interacting through hydrophobic bonds and hydrogen bonds.
Key words: Jasminum sambac; root; volatile oil; gaschromatography-mass spectrometry(GC-MS); network pharmacology; the sedation and hypnosis effect
失眠是一種較常見的睡眠障礙,主要表現為睡眠時間不足和睡眠質量差。較多失眠患者常伴有抑郁、暴躁、焦慮癥狀,長期失眠易使人精神狀態差,身體機能紊亂,免疫力下降、增加老年癡呆癥、高血壓等的患病風險[1]。治療失眠的藥物主要有苯二氮卓類、非苯二氮卓類及具有鎮靜作用的抗抑郁藥,長期使用易出現依賴性、耐受性等不良反應[2]。因此,尋找療效好、副作用少的藥物是治療失眠的當下目標。
茉莉花[Jasminum sambac (L.) Aiton]為木犀科素馨屬植物,又名茉莉、香魂、莫利花、末莉、末利等,廣泛分布于中國江蘇、福建、廣西等地[3,4],其根、莖、葉均有較高藥用價值。茉莉花根具有麻醉、止痛等功效,對失眠、頭疼、齲齒等疾病有較好的治療作用[5],茉莉花根的主要成分是揮發油、脂肪酸類、萜類、糖苷類、黃酮類等[6-8]。茉莉根醇浸膏能減少小鼠自主活動、抑制扭體反應及延長戊巴比妥鈉閾上劑量睡眠時間的作用,提示茉莉根醇提物對中樞神經系統具有抑制作用[9]。寧天等[10]研究發現茉莉花根醇提物能使小鼠的自主活動減少,明顯延長小鼠睡眠時間。以上成果對研究揮發油類藥物治療失眠具有一定的價值。Burman[1]、Takemoto等[11]研究發現,沉香、佩蘭等植物精油具有較好的鎮靜催眠作用,能改善睡眠。揮發油作為茉莉花根主要成分,不僅具有脂溶性高、易透過血腦屏障等優點,而且在傳統功效上茉莉花根具有鎮靜、麻醉作用,這對開發茉莉花根揮發油,改善睡眠作用具有重要意義。且揮發油中還含有大量脂肪酸,可為物質代謝提供所需的能量,并具有廣泛的藥理活性[12]。
茉莉花在醫療保健和食品行業被廣泛應用,現代學者對茉莉花的研究多局限于不同品種、不同花期之間的揮發性成分,或對食用茉莉花揮發性成分等方面的研究[13-15],但茉莉花根揮發油的成分分析和藥理作用機制尚不明確。因此,本研究運用GC-MS(氣相色譜質譜聯用儀,Gaschromatography-mass spectrometry)方法對茉莉花根揮發油進行分析,利用網絡藥理學和分子對接預測其根部揮發油鎮靜安神的物質基礎和作用機制,以期為茉莉花其他部位開發研究提供理論依據。
1 材料與方法
1.1 材料
1.1.1 試材來源 茉莉花根藥材于2019年6月在廣西橫縣購入。
1.1.2 儀器 TSQ 8000 Evo型三重串聯四級桿氣質聯用儀,美國賽默飛世爾科技公司;揮發油提取器,天津泰斯特儀器有限公司。
1.2 方法
1.2.1 茉莉花根部揮發油的測定 分別取茉莉花根部藥材適量,置于揮發油提取器中,加熱至微沸,提取3 h后收集蒸餾液,加入適當無水硫酸鈉除去水分,即得油狀提取物。取茉莉花根莖揮發油以色譜級乙酸乙酯稀釋后,過濾,采用氣相色譜-質譜聯用技術對其進行定性定量分析,得到不同生長部位總離子流圖,通過標準質譜庫對比,確定其化學成分,并用峰面積歸一化法計算各組分的相對含量。
色譜條件:色譜柱為TG-SQC(30 m×0.25 nm× 0.25 μm);進樣口溫度250 ℃,初始溫度50 ℃保持 ?1 min,以10 ℃/min的速率升至180 ℃,保持2 min,再以5 ℃/min速率升至250 ℃保持10 min。載氣為氦氣,流速為1.5 mL/min,進樣量:1.0 μL。分流比為40∶1。
質譜條件:EI離子源;電子能量為70 eV,離子源溫度為250 ℃;傳輸線溫度為250 ℃;掃描范圍為50~550 amu。
1.2.2 化學成分及疾病相關靶點預測 從TCMSP、Swiss Target Prediction數據庫(http:tcmspw.com/tcmsp.php、http:www.swisstargetprediction.ch/)檢索獲取各成分相關靶點,將各靶點基因導入UniProt(https://www.uniprot.org/)數據庫校正。用CTD數據庫搜索“insomnia”,得到失眠相關靶點,利用Venny 2.1.0軟件取得茉莉花根揮發油的活性成分靶點與失眠疾病靶點交集靶點。
1.2.3 交集靶點蛋白互作(Protein-protein interaction,PPI)網絡分析 將交集靶點導入STRING數據庫,獲得PPI網絡。以tsv格式保存后將其相互作用信息上傳至Cytoscape 3.7.1軟件進行拓撲分析,篩選出degree值≥平均度值的靶點作為核心靶點,此時的核心靶點有可能是茉莉花根揮發油發揮鎮靜安神的關鍵靶點。
1.2.4 GO基因功能注釋和KEGG通路富集分析 將交集靶點錄入到生物學信息注釋數據庫DAVID 6.8(http:david. Ncifcrf.gov/)中進行基因本體(Ggene ontology, GO)注釋和京都基因與基因百科全書(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,選定靶基因名稱為“Homo sapiens”,取P<0.01的富集結果,進而研究各靶點在基因功能上的富集情況和參與的主要通路。
1.2.5 網絡模型構建及分析 利用Cytoscape 3.7.2軟件對上述預測結果進行編輯和分析,得到活性成分-靶點(Compound-target,C-T)網絡、活性成分-靶點-通路(Compound-target-pathway, C-T-P)網絡。由此網絡反映茉莉花根揮發油活性成分涉及的潛在作用靶點與通路間的聯系。
1.2.6 分子對接 選取茉莉花根揮發油的主要活性成分與核心靶點,利用RCSB Protein data bank 數據庫(https://www.rcsb.org/)下載關鍵蛋白及其共結晶,利用SYBYL 2.0軟件進行分子對接,取對接得分以預測二者的結合性能,從而驗證網絡藥理學研究結果。
2 結果與分析
2.1 茉莉花根莖葉揮發油成分的氣相色譜-質譜分析
對茉莉花根揮發油成分進行氣質聯用分析,結果如圖1所示。從揮發油成分中共解析鑒定得到23種化合物(表1),利用面積歸一化法計算各組分相對含量。結果顯示,從茉莉花根中共鑒定出的化合物分別為糠醛、苯甲醛、N-甲基苯胺、2-乙烯基吡啶、(S)-芳樟醇、桉葉油醇、1-十三烯、油醇、2-(4-甲基-3-環己烯-1-基)丙醛、對苯二酸二肼、二苯醚、2,6-二叔丁基苯醌、全反式視黃醛、2,2,7,7-四甲基-5,6-環氧三環[2.2.1.01,6]十一烷、11α-孕酮、(9Z)-9-十六碳烯-1-醇、1,2,3,4,5,6-六氫-1,1,5,5-四甲基-7H-2,4alpha-甲橋萘、肉豆蔻酸、二氫莎草醌、棕櫚酸甲酯、棕櫚酸、(Z)-油酸甲酯、蓖麻油酸。茉莉花根中相對質量分數較高的化合物為棕櫚酸(30.24%)、桉葉油醇(16.23%),表明茉莉花根揮發油主要化學成分為脂肪酸類、酯類、萜類等。
2.2 化學成分、疾病相關靶點預測及化合物-靶點網絡
通過GC-MS成分分析共得到23個揮發性成分。經過TCMSP、Swiss Target Prediction數據庫檢索獲取各成分相關靶點,設置Probability*>0.5,再借助CTD數據庫查找到35 361個鎮靜、助眠靶點,經Venny分析,最后得到12個活性成分,77個交集靶點。
2.3 交集靶點蛋白互作(Protein-protein interaction,PPI)網絡分析
將77個交集靶點導入STRING數據庫進行蛋白互作分析,可信度為 0.7,得到靶點間相互作用關系,如圖2所示。將 PPI 網絡節點信息導入Cytoscape 3.7.2 軟件,利用軟件插件cytoHubba選擇top值為10,顯示核心蛋白有ADRA1B、CHRM1、ADRA1A、CHRM3、FFAR1、ADRA1D、ADRA1B、NCOA1、IL6、F2、TNF(圖3)。
2.4 GO基因功能注釋分析和KEGG通路富集分析
利用DAVID數據庫分析,并按照P<0.01,共挑選出106個GO term,包括68個生物過程(Biological process,BP)、14個細胞組分(Cellular component, CC)和24個分子功能(Molecular function, MF),僅選取“count”排名前10作圖分析。如圖4所示,其中,生物過程主要涉及腺苷酸環化酶激活腎上腺素受體信號、對藥物反應、細胞信號等;細胞組分主要涉及質膜的組成部分、突觸后膜、質膜等;分子功能主要涉及腎上腺素結合、藥物結合、類固醇結合等。經KEGG富集分析,設置P<0.01,共篩選出17條最顯著富集通路。如圖5所示,與鎮靜、安神相關的顯著富集通路是神經活性配體受體相互作用(Neuroactive ligand-receptor interaction)、CGMP-PKG信號通路(CGMP-PKG signaling pathway)、鈣信號通路(Calcium signaling pathway),相關基因包括CHRM2、GABRA2、CHRM3、GABRA1、CHRM1、CHRNA2、GABRA5、PTGER3、GABRA3、ADRA1D、ADRB1、ADRB2、F2、ADRA1B、ADRA2C、NR3C1、ADRA1A、ADRA2B、ADRA2A、DRD1、PRSS3、NOS3、NCOA1、IL6、TNF、FFAR1等。
2.5 活性成分-靶點、活性成分-靶點-通路網絡構建
運用Cytoscape 3.7.2軟件構建“活性成分-靶點”(C-T)網絡,如圖6所示,橙色長方形節點代表活性成分,藍色長方形節點代表靶點,邊表示活性成分與靶點的相互作用關系。
在網絡分析中,網絡度和介數是用于篩選網絡節點的2個重要參數。節點的重要性與節點的網絡度和介數成正比,度數越大,節點越大。由表2可知,11個化學成分共有靶標細胞色素P450芳香化酶(Cytochrome P450 arom, CYP19A1);7個化學成分共有靶標和受體共激活因子2(Nuclear receptor coactivator 2, NCOA2)、前列腺素內過氧化物合酶1(Prostaglandin-endoperoxide synthase 1, PTGS1)和雄激素受體(Androgen receptor, AR);6個化學成分共有靶標去甲腎上腺素轉運體(Norepinephrine transporter, NET, SLC6A2)和碳酸酐酶1(Carbonic anhydrase,CA1);5個化學成分共有靶標碳酸酐酶2(Carbonic anhydrase,CA2);糖皮質激素受體(Glucocorticoid receptor, NR3C1)、鹽皮質激素受體(Mineralocorticoid receptor, NR3C2)、核受體亞家族1Ⅰ組成員3[Nuclear receptor subfamily 1 group I member 3 (by homology),NR1I3]。上述結果表明,茉莉花根揮發油中的每個活性成分可對應多個靶點,同時,1個靶點對應多個成分,構建了茉莉花根揮發油成分與靶點間復雜的網絡關系。
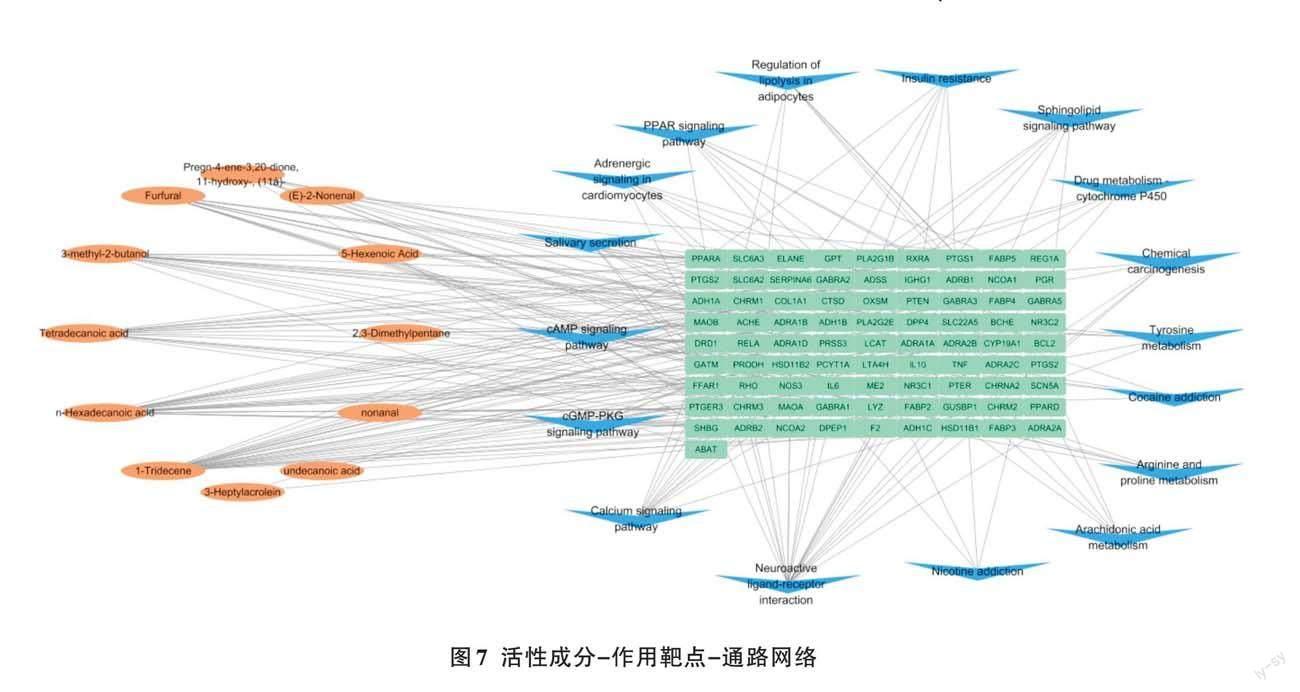
茉莉花根揮發油“活性成分-作用靶點-通路”(C-T-P)網絡模型如圖7所示。12個活性成分(橙色橢形節點)共對應82個交集靶點(綠色長方形節點),相關生物信號通路17條(藍色三角形節點),節點越大表示其度數越大。分析發現,網絡度排名靠前的靶點和通路在上述GO和KEGG富集分析結果中也靠前。表明茉莉花根揮發油的每種活性成分可作用于多個靶點,每個靶點對應不同成分,涉及多條信號通路,各靶點、通路之間相互協調、共同參與藥理作用的發揮。
2.6 分子對接驗證
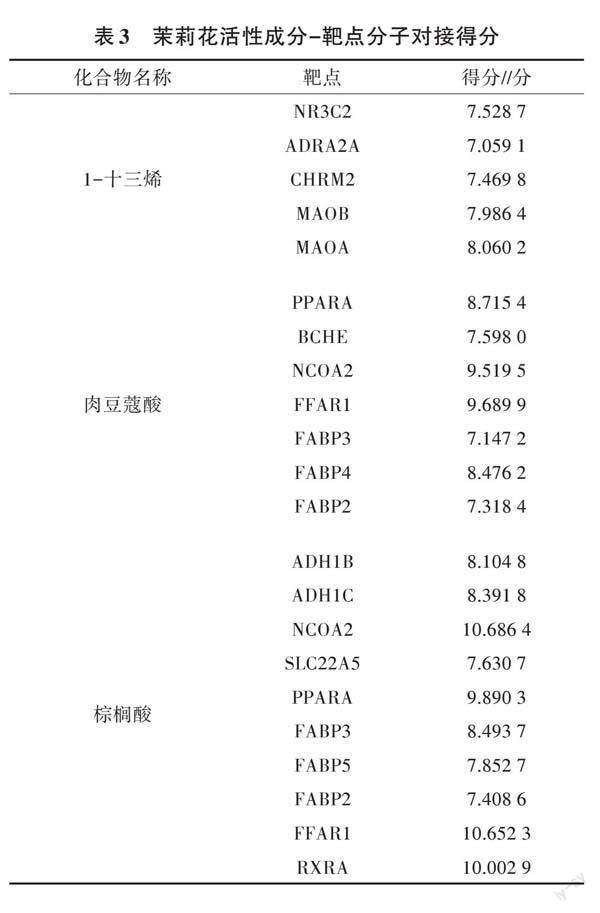
將茉莉花根活性成分與關鍵靶點進行分子對接,分子對接得分越高,則表示活性成分與靶標蛋白的結合性能越好。當得分高于4.25分時,說明茉莉花根揮發油與其靶點具有一定的結合活性,當對接得分高于5分時,則表明二者結合活性較好,當對接得分高于7分時,則具有強烈的結合活性,對接結果(表3)僅選取得分大于7分的活性成分與相關靶點進行展示,大部分活性成分與其核心靶點具有較好的結合活性。茉莉花根揮發油中的棕櫚酸與NCOA2分子對接示意如圖8所示,可見二者主要通過疏水接觸產生相互作用。
3 討論
茉莉花根揮發油中存在多種揮發性成分,均具有廣泛的藥理作用,是一種極具開發空間和利用價值的中藥,擁有廣闊的市場前景。本研究通過GC-MS技術對茉莉花根揮發油進行成分分析,發現其揮發油中主要為脂肪酸類、酯類、萜類等化學成分。脂肪酸類化合物有較強的抗氧化作用,且兼具調節血脂、降血壓、改善微循環等作用[16,17]。該類化合物在茉莉花根揮發油中的相對百分含量較高,根還含有較多的酯類和萜類成分,酯類成分是茉莉花根的氣味來源。萜類成分如芳樟醇,具有鎮痛、抗炎、抗腫瘤等作用[18]。此外,茉莉花根揮發油部分化合物結構未能鑒定,有待進一步研究。
根據網絡藥理學方法系統研究茉莉花根揮發油的活性成分及其藥理作用機制。研究結果表明,油醇、棕櫚酸、(S)-芳樟醇、桉葉油醇、棕櫚酸甲酯等活性成分主要作用于CYP19A1、NCOA2、PTGS1、AR、SLC6A2、CA1等關鍵靶點,這些靶點常與神經退行性疾病、炎癥、腫瘤等疾病有密切聯系。
SLC6A2是一種能夠調節認知功能、情緒等中樞神經系統活動的神經遞質。在調控腎上腺素能神經遞質和遞質-受體信號傳導通路中發揮重要作用[19],Hommers等[20]研究發現SLC6A2的表達可能導致恐懼和焦慮的中樞和外周處理發生改變。說明茉莉花根揮發油的活性成分可作用于SLC6A2基因,從而發揮對神經退行性疾病的防治作用。
PTGS也稱環加氧酶,是前列腺素生物合成中的關鍵酶。袁岸等[21]研究發現荊芥揮發油的抗炎作用機制與PTGS1、IL-1β、IL-6、TNF等靶點關系密切。向凈勻等[22]研究發現降低PTGS1的活性可減輕腦缺血損傷的炎癥反應。說明PTGS1是炎癥通路的重要靶點,因此,茉莉花根揮發油與炎癥的關系主要與PTGS1基因有關。
CA也被稱為碳酸鹽脫水酶或碳酸鹽裂合酶[23],在胃癌、大腸癌、肝癌等消化系統疾病中均有CA的表達,它是預測腫瘤發生及評估預后的重要生物學標志物[24]。CYPI9Al編碼細胞色素P450芳香化酶,是影響雌激素生物合成的重要酶基因。甄鑫等[25]研究發現CYP19基因編碼產物芳香化酶在雄激素代謝中發揮重要作用,且與多囊卵巢綜合征(Polycystic ovary syndrome, PCOS)發病相關。NCOA2又名SRC-2,在發育、內分泌調節和腫瘤等生理和病理過程中發揮重要作用。Lin等[26]通過試驗證明NCOA2的表達可在體內影響人胃癌的增殖和侵襲。本研究結果顯示,茉莉花根揮發油的活性成分可作用于CA1、CA2、CYPI9Al、NCOA2等靶點,說明它可能通過影響此類腫瘤相關靶點的表達從而干預腫瘤的發生、發展,但具體作用機制有待進一步探究。
AR屬于核受體超家族中的類固醇受體,是編碼雄激素受體的基因。已有相關文獻報道,該基因的遺傳變異可引起雄激素不敏感綜合征[27]。說明茉莉花根揮發油活性成分可作用于AR基因,從而調節性發育。
利用KEGG通路富集分析,按P<0.01,得到最顯著的富集通路包括神經活性配體受體相互作用、癌癥通路等。神經活性配體受體相互作用信號通路是質膜上所有與細胞內外信號通路相關的受體和配體的集合[28]。該通路與茉莉花根揮發油的PTGER1、PTGER2、GABRA2、DRD1、NR3C1等靶點有關。癌癥通路是典型的信號通路,癌癥由遺傳和表觀遺傳的改變所驅動,這些改變可引起細胞過度增殖和遷移。常見癌癥信號通路包括NF-KB信號通路、TNF信號通路、MAPK/ERK通路等。而茉莉花根揮發油活性成分能與EGFR、PTGER1、AR、PPARD、IL6、NOS2等靶點結合作用于癌癥通路,從而發揮其抗癌作用。
綜上所述,本研究借助GC-MS技術和網絡藥理學方法,系統篩選出了茉莉花根揮發油活性成分及潛在作用靶點,通過C-T和C-T-P網絡闡述了活性成分、潛在作用靶點和通路之間的聯系,揭示了茉莉花根揮發油藥理作用機制,分子對接結果顯示,茉莉花根活性成分與靶點具有良好的結合性能,證實了網絡藥理學預測靶點的準確性,為茉莉花根揮發油活性成分及后續作用機制的研究提供了線索。
參考文獻:
[1] BURMAN D. Sleep disorders: Insomnia[J].FP essentials,2017,460:22-28.
[2] 林炳岐,李 峰,馬 捷,等.基于GABA能系統通路探討失眠的機制[J].現代生物醫學進展,2018,18(3):565-568.
[3] 庫爾班江,歐青海,阿布都薩拉木.中藥茉莉花的研究進展[J].科技信息(科學教研),2008(5):43-44.
[4] 黎貴卿,李區寧,宋業昌,等.茉莉花香氣、茉莉花精油及凈油揮發性成分的HS-SPME-GC-MS和GC-MS比較分析[J].廣西林業科學,2020,49(1):139-144.
[5] 劉志平,周文芬,崔建國.茉莉花莖中多糖的提取與含量測定[J].食品研究與開發,2009,30(2):44-46.
[6] 黃芳芳,徐桂花,陳全斌.茉莉花研究文獻計量分析[J].大眾科技,2007(1):138-145.
[7] 王以靜,李海舟,楊崇仁,等.茉莉花與茉莉花茶[J].福建茶葉,2021,43(11):268-270.
[8] 徐曉俞,李愛萍,鄭開斌,等.茉莉花香氣成分及其加工應用研究進展[J].中國農學通報,2017,33(34):159-164.
[9] 王振學,王 惕,胡凌歌,等.中藥茉莉根戒毒效果前期研究[J].中國藥物濫用防治雜志,2002(2):41-42.
[10] 寧 天,梁 紅,黃維真,等.茉莉花根對小鼠的鎮痛和鎮靜作用[J].中藥藥理與臨床,2014,30(2):99-101.
[11] TAKEMOTO H,ITO M,SHIRAKI T,et al. Sedative effects of vapor inhalation of agarwood oil and spikenard extract and identifi-cation of their active components[J].J Nat Med,2008,62(1):41-46.
[12] 胡 銳,李寶莉.傳統藥物中脂肪酸的藥理活性和現代研究[J].中外醫療,2008(27):135-136.
[13] 郭素枝,張明輝,邱棟梁,等.3個茉莉品種花蕾香精油化學成分的GC-MS分析[J].西北植物學報,2011,31(8):1695-1699.
[14] 張 芊,郜祥雄,王 平.雙瓣茉莉5個花期揮發性成分GC-MS分析[J].熱帶作物學報,2015,36(4):792-797.
[15] 王海琴,劉錫葵,柳建軍.食用茉莉花香味成分的GC/MS分析[J].昆明師范高等專科學校學報,2006(4):11-13.
[16] 韓 飛,陳 泣,舒積成,等.湖北產牛至藥材不同提取部位揮發油GC-MS分析[J].中草藥,2015,46(13):1887-1891.
[17] 吳 健,項 崢,許 穎,等.GC-MS分析中藥白及中脂肪酸成分[J].食品與藥品,2014,16(6):428-430.
[18] 姜冬梅,朱 源,余江南,等.芳樟醇藥理作用及制劑研究進展[J].中國中藥雜志,2015,40(18):3530-3533.
[19] 黃昉萌,駱杰偉,陳 慧,等.高血壓肝陽上亢證與SLC6A2基因多態性的關聯研究[J].中國中醫基礎醫學雜志,2010,16(7):613-615.
[20] HOMMERS L G,RICHTER J,YANG Y,et al. A functional genetic variation of SLC6A2 repressor hsa-miR-579-3p upregulates sympathetic noradrenergic processes of fear and anxiety[J].Translational psychiatry, 2018,8(1):226-238.
[21] 袁 岸,劉 淇,饒志粒,等.基于網絡藥理學的荊芥揮發油主要成分抗炎機制研究[J].中國藥理學通報,2020,36(1):97-103.
[22] 向凈勻,吳 杰,王 琰,等.基于網絡藥理學的黃芩素、京尼平抗腦缺血作用機制研究[J].中草藥,2019,50(23):5802-5811.
[23] 李 為,曹 ?龍,周蓬蓬,等.溫度對細菌碳酸酐酶催化碳酸鈣沉積的影響[J].地球與環境,2013,41(4):371-377.
[24] 曹景瑩,楊文宇,周 宇,等.碳酸酐酶與消化系統疾病關系的研究進展[J].海南醫學,2018,29(11):1568-1570.
[25] 甄 鑫,顏桂軍,孫海翔,等.CYP19A1基因多態性與多囊卵巢綜合征的相關性研究[J].醫學研究生學報,2014,27(6):596-599.
[26] LIN Z L,YANG F,LU D,et al. Knockdown of NCOA2 inhibits the growth and progression of gastric cancer by affecting the wnt signaling pathway-related protein expression[J].Technol Cancer Res T,2020,19:1-9.
[27] MARIA S R,MARGHERITA F,AICHI M,et al. Comparison of NGS panel and Sanger sequencing for genotyping CAG repeats in the AR gene[J].Mol Genet Genom Med,2020,8(6):e1207.
[28] LAUSS M,KRIEGNER A,VIERLINGER K,et al. Characterization of the drugged human genome[J]. Pharmacogenomics,2007, ?8(8):1063-1073.

