環孢素A減輕急性胰腺炎模型小鼠心臟損傷的機制研究①
吳 童 高雪飛 賈迎麗 楊 靜 (唐山市工人醫院內科,唐山 063000)
急性胰腺炎(acute pancreatitis,AP)是一種不可預測的威脅生命的炎癥性疾病,常伴有嚴重的全身炎癥反應,導致多器官功能障礙[1]。每個患者的預后取決于AP 的嚴重程度,最嚴重型通常伴有多器官損傷,病死率為15%~30%[2]。目前研究表明,促炎癥細胞因子通過驅動炎癥反應在AP 相關并發癥中起著關鍵作用[3]。因此,更好地了解AP 的炎癥調節途徑對于發現新的治療靶點是必要的。不同類型免疫細胞介導的抗炎和促炎免疫反應不平衡參與AP 病理生理學過程[1]。巨噬細胞在AP 損傷過程中起著至關重要的作用[4]。根據組織微環境中存在的刺激,巨噬細胞可分為典型激活的M1 型和交替激活的M2 型[4]。M1 表型巨噬細胞分泌促炎介質IL-6、IL-1β、TNF-α和活性氮、氧等促炎因子,具有較強的殺微生物作用。M2 表型巨噬細胞通過產生抗炎介質,如IL-10 和IL-4,參與組織重塑[5]。M2 型巨噬細胞在化解炎癥中起著積極作用,這是AP 治療所必需的。因此,調節巨噬細胞極化平衡可能是AP治療的一個有前途的策略。環孢素A(Cyclosporin A,CSA)是一種有效的免疫抑制藥物,主要抑制鈣調神經磷酸酶和鈣調神經磷酸酶依賴的轉錄因子[6]。通過這種抑制作用,CSA阻斷T細胞產生NFAT依賴性細胞因子,如IL-2,并抑制包括輔助性T(Th)細胞在內的效應T 細胞激活和功能[6]。最近研究表明CSA對系統性紅斑狼瘡、類風濕關節炎、脊柱關節炎等炎癥性疾病具有有益的影響,同時能降低心血管疾病的發生風險[7]。因此,CSA 可有效治療炎癥性疾病。然而,它在調節巨噬細胞分化中的作用仍不清楚。鑒于上述發現,本研究旨在證明CSA 是否通過調節巨噬細胞極化影響AP 的炎癥反應,從而保護AP小鼠及相關心臟損傷。
1 材料與方法
1.1 材料
1.1.1 動物 雄性C57BL/6J 小鼠,上海杰思捷實驗動物有限公司,生產許可證:SCXK(滬)2018-0004。體質量22~25 g,6~8 周齡,安置在12 h/12 h明暗循環、無特定病原體環境中,自由飲用食物和水。
1.1.2 主要試劑與儀器 RAW264.7細胞(中國典型培養物保藏中心);CSA(美國Sigma-Aldrich 公司);緩沖液(美國BD Biosciences 公司);FcR 阻斷試劑(美國Miltenyi公司);固定/滲透緩沖液(南京福麥斯生物技術有限公司);L-精氨酸(北京Solarbio 公司);CD206(美國Biolegend 公司);血清肌酸激酶同工酶(上海臥宏生物科技有限公司);乳酸脫氫酶(南京建城生物工程研究所);酶聯免疫吸附試驗試劑盒(北京英柏生物科技公司);TUNEL 檢測試劑盒(北京百奧萊博科技有限公司);Trizol 試劑(美國Invitrogen 公司);cDNA 合成試劑盒、SYBR Premix Ex TaqTMⅡ(日本TaKaRa 公司);BCA 蛋白檢測試劑盒(江蘇凱基生物技術股份有限公司);PVDF 膜(美國Millipore Corp 公司);Aperio S2 Leica 生物系統顯微鏡(德國Leica 公司);p-STAT6、GAPDH(美國Abcam公司);ABI 7500 PCR 系統(美國Life Technologies公司)。
1.2 方法
1.2.1 培養RAW264.7 細胞 將RAW264.7 細胞置于含10%胎牛血清(FBS)、1%雙抗的DMEM 培養基中,于37 ℃、含5%CO2細胞培養箱中培養,每2 d傳代1次,取對數生長期細胞進行實驗。
1.2.2 流式細胞術 將RAW264.7 細胞接種于6 孔板中,用0、5、10、20 nmol/L CSA 刺激24 h,然后將細胞密度調整為2.5×106個/ml,用200 μl 懸浮液檢測M2標志物。用AF647 CD206或PEcy7 CD23抗體標記M2 標志物。極化分析心臟組織中巨噬細胞,將組織碎塊置于0.1%Ⅳ型膠原酶溶液中孵育40 min,經70 μm 濾網過濾。取上清液300 g 離心5 min,棄上清,加入紅細胞裂解液冰上孵育15 min,300 g 離心5 min,棄上清經200 目濾器過篩,細胞計數,再懸浮在染色緩沖液中。隨后,加入FcR阻斷試劑以提高抗體的特異性。細胞首先用表面標志物(F4/80)染色,用固定/滲透緩沖液固定和滲透,然后用FITC 偶聯的CD11c(M1 標志)和APC 偶聯的CD206(M2標志)染色,通過流式細胞儀進行分析。
1.2.3 AP模型建立 為研究CSA在AP中的作用,將雄性C57BL/6J 小鼠隨機分為3 組(n=15),即對照組、AP 模型組和AP+CSA 組。參照文獻[8]方法,對AP 組和AP+CSA 組小鼠腹腔注射L-精氨酸建立AP模型。L-精氨酸溶解在生理鹽水中,并在注射前將pH 調節至7.0。小鼠以4 g/kg 劑量腹腔注射2 次L-精氨酸,每次注射間隔1 h。第1次注射后,所有小鼠可以自由獲得食物和水。第2次注射L-精氨酸指定時間點為0。對于CSA治療,在首次注射L-精氨酸前30 min,小鼠皮下注射20 mg/kg CSA(溶于橄欖油)。AP 誘導24 h 后,在戊巴比妥鈉全麻下經眼眶靜脈叢出血法采集血樣于離心管靜置。處死小鼠,將每只小鼠的胰腺、心臟組織用10%甲醛固定,進行病理學檢查,同時將血樣在3 000 g 下離心10 min。將血清置于-80 ℃冰箱儲存備用。
1.2.4 小鼠血清胰腺、心肌損傷指標測定 用生化分析儀測定AP 誘導24 h 后血清肌酸激酶同工酶、乳酸脫氫酶水平。采用ELISA 試劑盒檢測肌鈣蛋白(cTnT)、TNF-α、血清淀粉酶、脂肪酶水平。
1.2.5 組織病理學檢查及免疫組化分析 AP誘導24 h 后處死小鼠。立即采集胰腺和心臟組織,用多聚甲醛固定,石蠟包埋,切片,HE 染色,在Aperio S2 Leica 生物系統顯微鏡下檢查組織病理變化。采用TUNEL檢測試劑盒檢測組織切片中細胞凋亡。
1.2.6 RNA 提取與定量實時PCR 分析 用Trizol試劑從巨噬細胞裂解物和小鼠心臟中分離總RNA,并使用cDNA 合成試劑盒在37 ℃下反轉錄15 min。cDNA 采用SYBR Premix Ex TaqTMⅡ和ABI 7500 PCR 系統進行實時PCR。使用2-ΔΔCt方法計算靶基因相對表達。目標基因序列見表1。

表1 目標基因序列Tab.1 Target gene sequence
1.2.7 細胞熱位移分析(CETSA) 根據文獻[9]進行CETSA。采用激酶緩沖液溶解收集的巨噬細胞,12 000 g 離心20 min,取上清液。巨噬細胞裂解液分為DMSO 組和20 nmol/L CSA 組。將各組分為7 等份,分別在46、50、54、58、62、66、70 ℃下熱處理3 min,然后將DMSO 組和20 nmol/L CSA 組快速轉移到冰上,用低溫離心機在1 2000 g 離心10 min,取上清液,加入負載緩沖液,CETSA分析。
1.2.8 免疫印跡分析 收集細胞,通過裂解緩沖液裂解30 min,BCA 蛋白檢測試劑盒測定蛋白質濃度,10%SDS-PAGE 分離,電泳轉移到PVDF 膜上。在室溫下用3%BSA封閉細胞膜1 h,4 ℃下用相應抗體:PKM2(1∶4 000 稀釋)、HIF1α(1∶1 000 稀釋)、p-STAT1(1∶1 000 稀釋)、p-STAT6(1∶2 000 稀釋)和GAPDH(1∶5 000 稀釋)在4 ℃下孵育過夜,次日用HRP 偶聯的二抗孵育1 h。用增強化學發光系統觀察蛋白條帶。通過GAPDH 免疫印跡法驗證樣品的等載量。用圖像測量軟件對譜帶強度進行量化。
2 結果
2.1 CSA對RAW264.7細胞M2極化的影響 為了探討CSA 對M2 極化的影響,用不同劑量的CSA(0、5、10 和20 nmol/L)刺激RAW264.7 細胞24 h。然后收集細胞并對M2 表型的CD206 和CD23 標志物進行染色。流式細胞術數據顯示,M2標志物標志的巨噬細胞數量以劑量依賴性的方式增加(圖1)。此外,還檢測了M1 標志物一氧化氮合酶(iNOS)的轉錄水平。結果顯示在CSA 刺激的細胞中iNOS mRNA表達減少(圖2)。
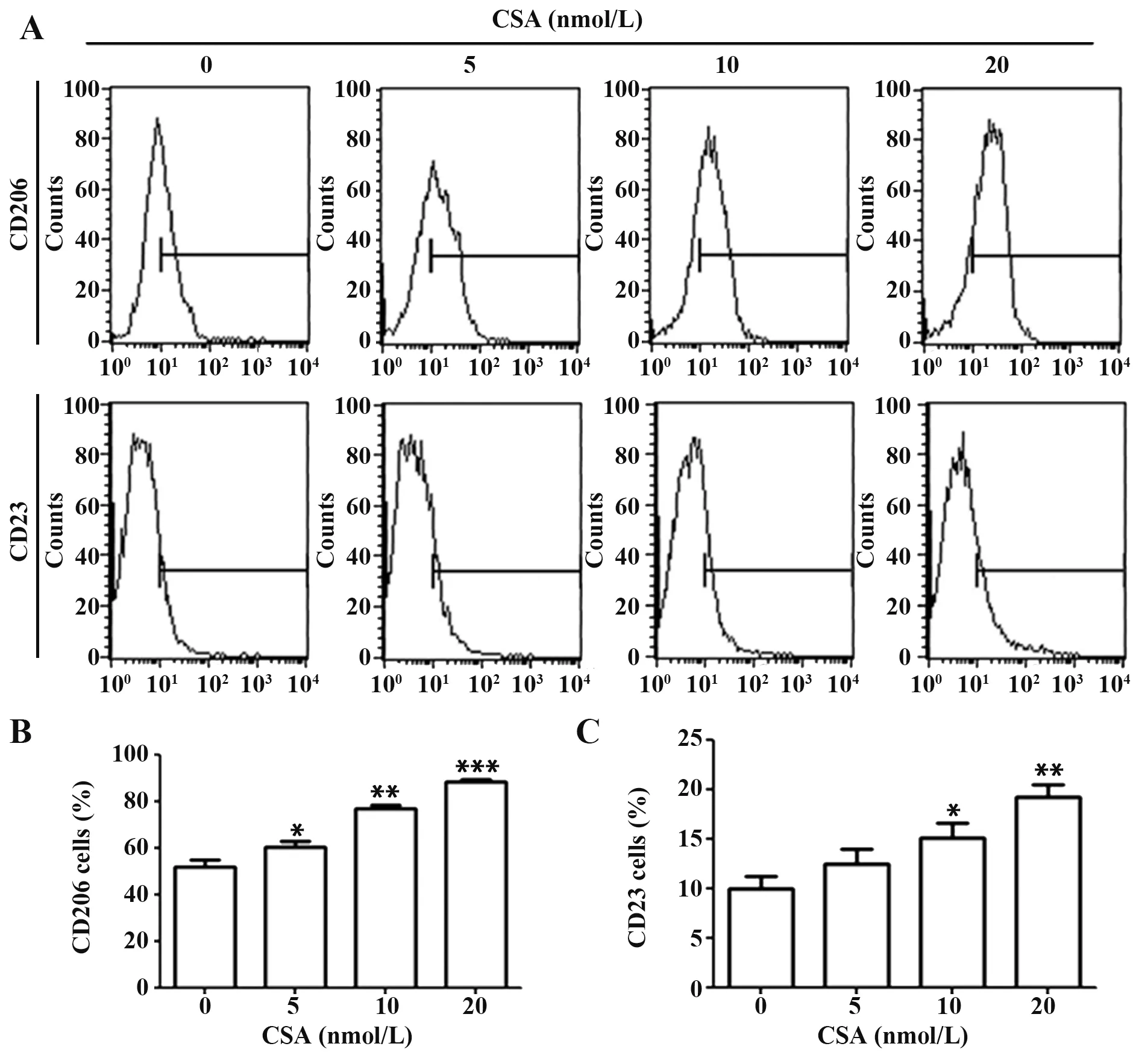
圖1 CSA對RAW264.7細胞M2極化的影響Fig.1 Effects of CSA on M2 polarization in RAW264.7 cells
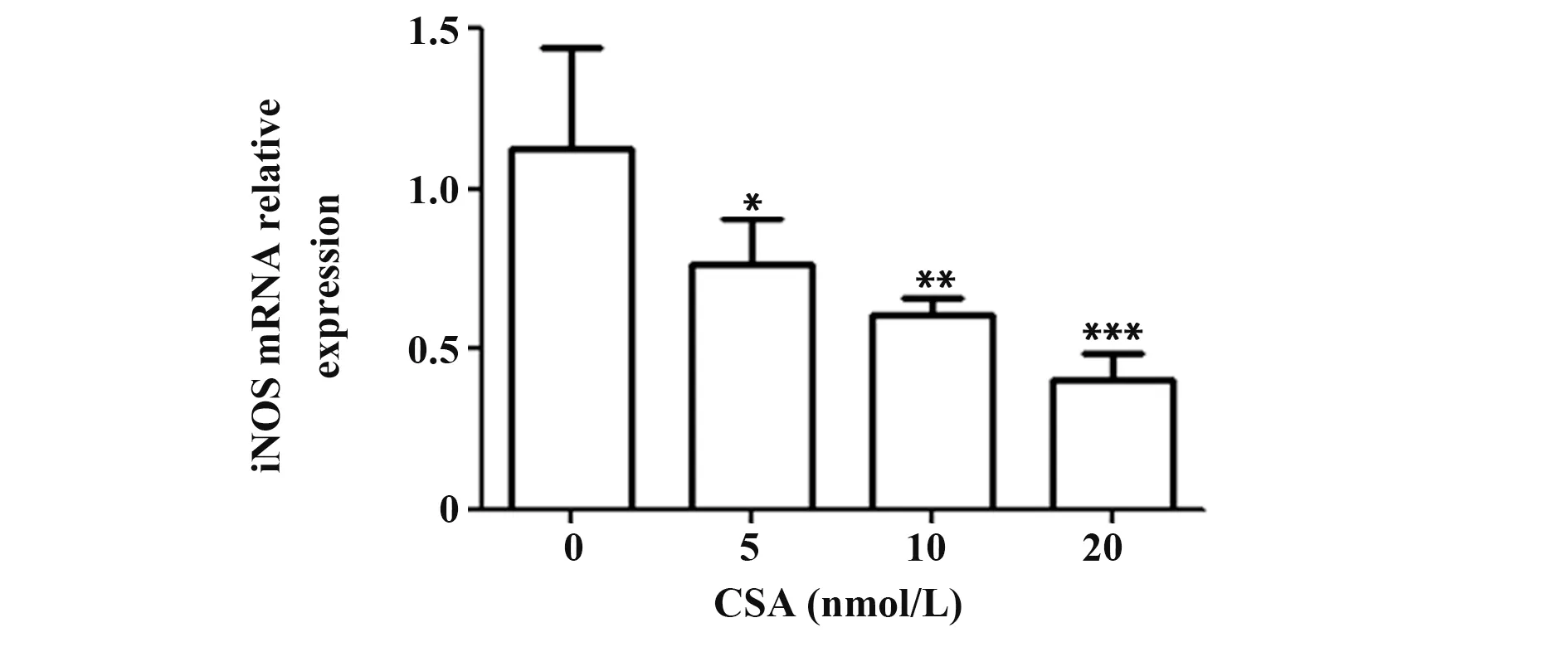
圖2 RT-qPCR檢測iNOS mRNA水平Fig.2 mRNA levels of iNOS determined by RT-qPCR
2.2 CSA可改善實驗性AP胰腺損傷 評估CSA對L-精氨酸誘導的AP 的影響,結果表明,AP 組24 h病死率為33.3%(5/15)。對照組、AP+CSA組小鼠均存活24 h。AP 組胰腺組織出現明顯的組織病理學改變,包括水腫、出血和腺泡細胞變性,組織病理學評分明顯高于對照組,CSA預處理顯著改善胰腺結構,降低胰腺組織病理學評分(圖3A、B)。此外,還評估了血清淀粉酶、脂肪酶和胰腺TNF-α變化。AP顯著提高了血清淀粉酶和脂肪酶水平以及胰腺TNF-α水平,表明AP小鼠模型胰腺損傷嚴重。CSA預處理顯著降低了參數的水平(P<0.05,圖3C~E)。結果表明CSA給藥對L-精氨酸誘導的AP有保護作用。
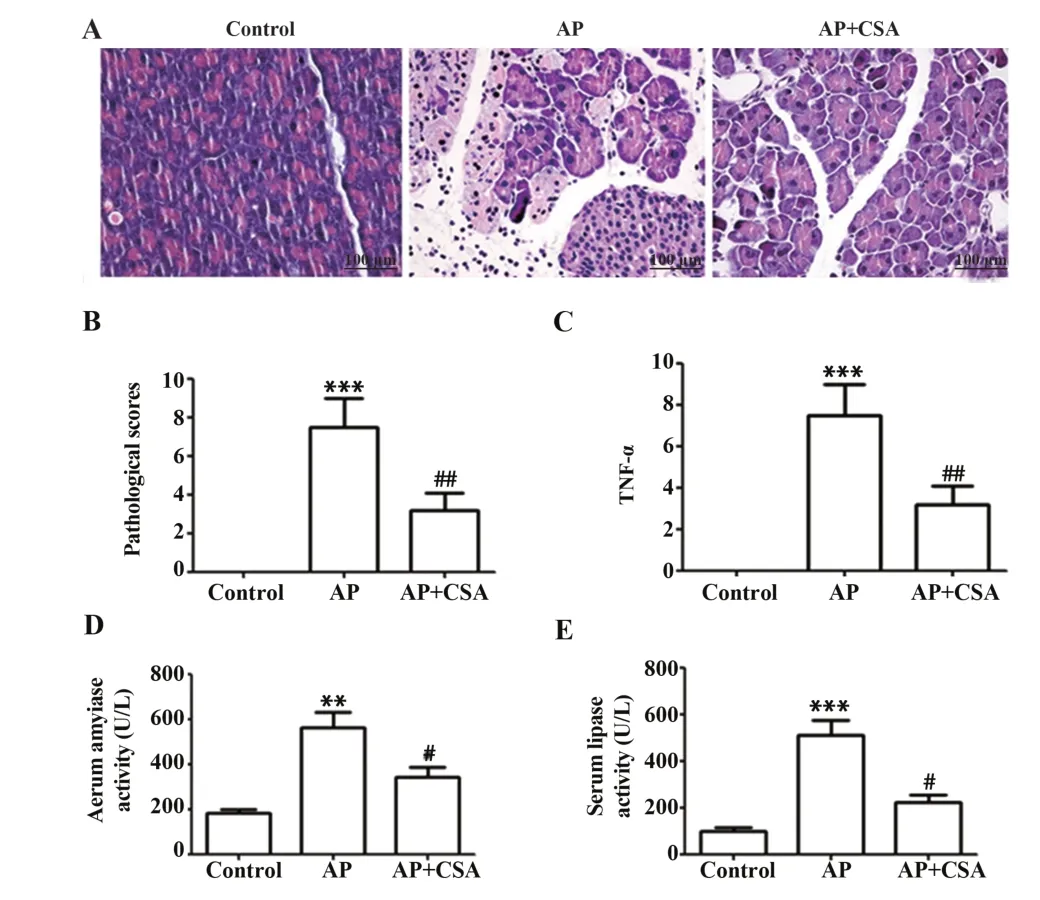
圖3 CSA改善實驗性AP損傷(×200)Fig.3 CSA ameliorate pancreatic damage in experimental AP (×200)
2.3 CSA 減輕AP 模型小鼠心臟損傷 HE 染色顯示心肌損傷的病理特征,AP 組心肌纖維壞死、炎癥細胞浸潤、出血和梗死區結構破壞,CSA預處理顯著減輕心肌損傷程度(圖4A)。此外,AP 模型組顯著提高了血清CK-MB、LDH 和cTnT 水平,表明AP 小鼠模型心肌損傷嚴重,CSA 預處理顯著降低了這些參數的水平(P<0.05,圖4B~D)。與這些結果一致,AP 模型組心肌TUNEL 陽性細胞多于對照組,CSA預處理顯著減少TUNEL 陽性細胞數量(圖4E)。表明CSA對AP模型小鼠的心臟損傷具有保護作用。

圖4 CSA減輕AP模型小鼠心臟損傷Fig.4 CSA attenuates cardiac injury in AP model mice
2.4 CSA抑制AP模型小鼠的心肌炎癥反應 通過檢測心肌組織中炎癥物質的表達水平,探討CSA 對AP模型小鼠的心肌炎癥反應的影響。如圖5A、B所示,與對照組相比,AP 模型組中心肌炎癥細胞因子IL-1β 和iNOS mRNA 表達顯著增加,CSA 預處理顯著抑制了IL-1β 和iNOS mRNA 表達。M1 表型巨噬細胞分泌炎癥細胞因子,如前所述,CSA在體外調節巨噬細胞極化,進一步檢測心肌巨噬細胞功能。CD11c+F4/80+為M1 表型,CD206+F4/80+為M2 表型。流式細胞術分析顯示,CSA預處理顯著降低AP誘導的心肌巨噬細胞中CD11c+F4/80+比例,提高CD206+F4/80+比例(圖5C~E)。
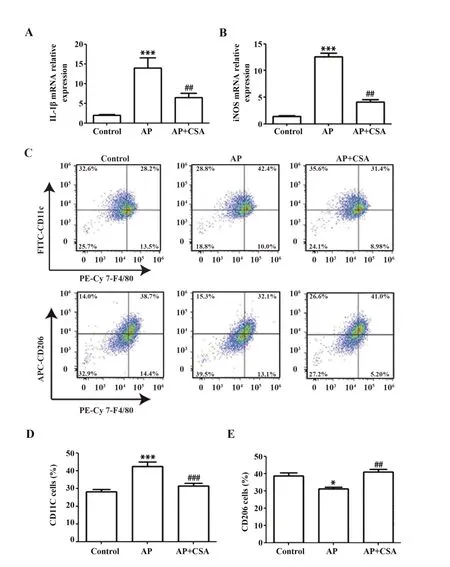
圖5 CSA抑制AP小鼠心肌炎癥反應Fig.5 CSA inhibits myocardial inflammatory response in AP mice
2.5 PKM2 作為CSA 的潛在靶點 本研究進一步考察CSA 是否能抑制LPS 誘導的PKM2 激活并防止巨噬細胞炎癥。結果表明,LPS+CSA 處理顯著抑制LPS 誘導PKM2 表達(圖6A)。此外,PKM2 還可以通過蛋白質-蛋白質相互作用發揮生物學功能。20 nmol/L CSA+LPS 顯著抑制HIF1α 表達,同時伴隨著巨噬細胞中p-STAT1 表達降低和p-STAT6 表達增加(圖6A)。為了驗證CSA 與PKM2 靶蛋白的結合,使用CETSA 驗證目標。當靶蛋白與小分子結合時,結構向低能高穩定性方向變化,耐高溫能力增強。如圖6B 所示,在CSA 處理的細胞裂解液中,PKM2對高溫有較強的耐受性,在高溫下PKM2 條帶強度較DMSO組增強,說明PKM2是CSA的靶標。
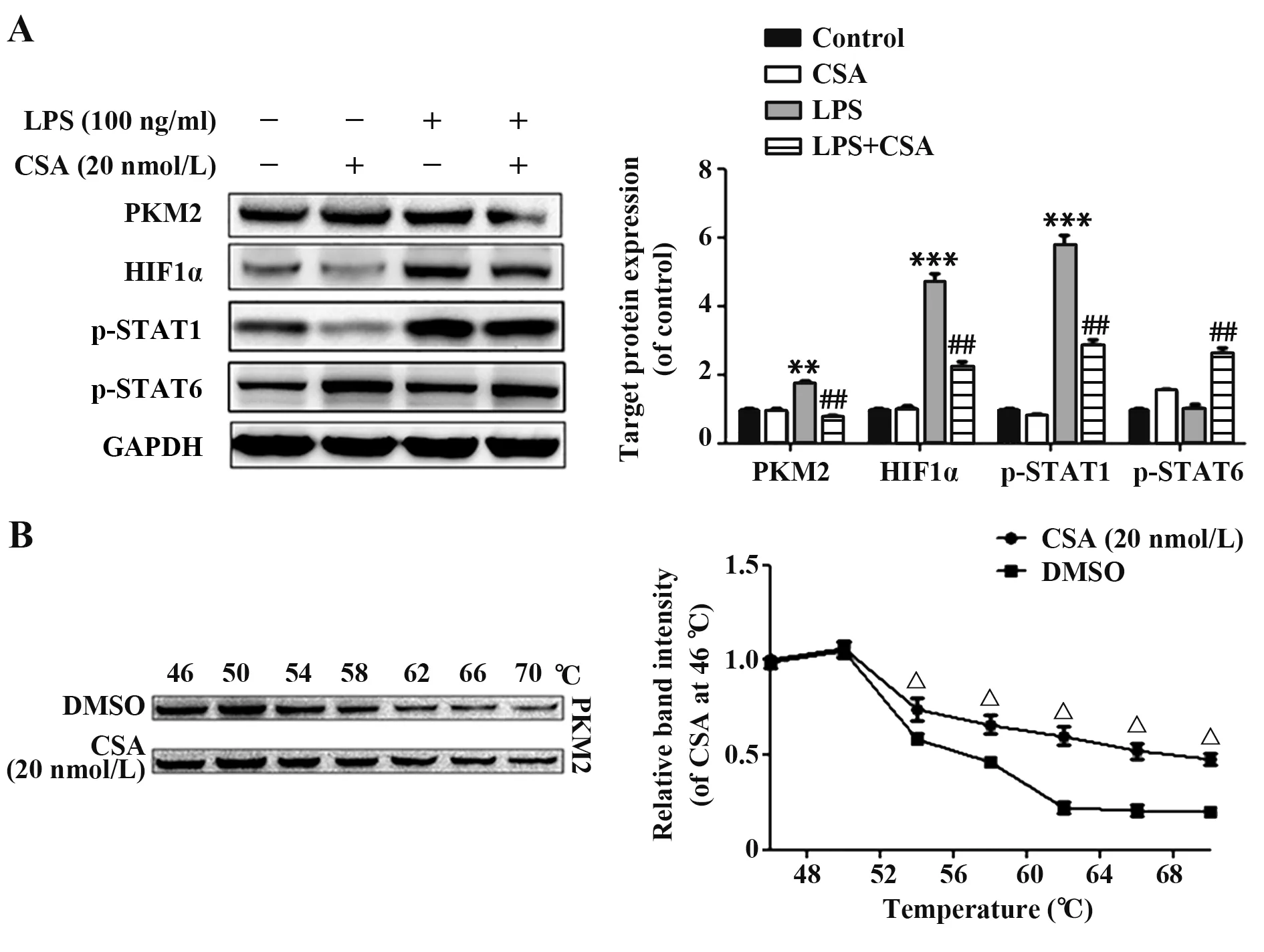
圖6 PKM2作為CSA的潛在目標Fig.6 PKM2 serves as a potential target for CSA
3 討論
AP 是一種致命的臨床疾病,其特點為進展迅速,目前沒有特效的方法可以阻止胰腺壞死的發生與發展,通常伴有多器官損傷,一旦發病其病死率高達50%~60%[1]。因此,通過改變過度炎癥反應是一種有效的治療手段[10]。大量研究發現,各種炎癥介質誘導的炎癥反應在AP 模型小鼠誘發的多器官損傷中起重要作用[2]。在較多的炎癥模型中,有研究發現,用L-精氨酸制備AP模型,24 h時到高峰,均與眾多臨床上分析該疾病的結果近似,因此本實驗采用L-精氨酸制備AP 模型小鼠作為研究對象[11]。CSA在多種炎癥性疾病方面有較好的治療作用。該研究采用CSA 作為預防給藥處理。為了進一步研究,本研究分析了CSA 在AP 模型小鼠合并心臟損傷中的潛在作用,結果表明,CSA 減輕了胰腺損傷,改善了心功能和組織學。此外,CSA 抑制胰腺和系統性促炎細胞因子的產生,其作用機制與降低M1巨噬細胞比例和提高M2 巨噬細胞比例有關。因此,CSA可能是治療AP的一種有前途的藥物。
在AP 的多器官系統功能障礙中,心臟損傷是相關表現的一部分,甚至致病[12]。AP期間可觀察到心肌病變的改變。CK-MB、LDH和cTnT是心臟損傷高度可靠的生物標志物[13]。在本研究中,小鼠腹腔注射L-精氨酸刺激胰腺可引起胰腺明顯的病理改變,血清淀粉酶和脂肪酶水平(胰腺損傷標志物)升高。此外,AP 動物表現出明顯的心臟損害,心肌細胞凋亡和心肌相關酶CK-MB、LDH、cTnT 增加。以上結果表明,本研究成功建立了伴有心臟損傷的AP模型,與文獻[14]一致。本研究結果提示CSA 預處理可明顯改善胰腺和心臟組織病理學變化,逆轉血清淀粉酶、脂酶和心臟相關酶變化。對AP 誘導的心臟損傷具有有益的作用。
越來越多的證據表明,參與AP 誘導的多器官功能障礙的致病因素包括全身炎癥反應、氧化應激和循環蛋白水解酶[14]。炎癥細胞因子在AP 的炎癥反應中起關鍵作用。一方面,AP開始于局限性胰腺和胰周炎癥。過度釋放炎癥介質將輕度AP 轉化為重度AP,并進一步導致全身炎癥反應綜合征[14]。另一方面,隨著AP、細菌和內毒素從腸道侵入血液系統,腸黏膜的免疫屏障受損,進一步誘導炎癥介質釋放[15]。許多促炎癥細胞因子如TNF-α、IL-1β,被認為參與了AP 發生,循環中這些介質的高水平表達可導致進一步的多器官衰竭[14]。已有研究表明CSA 在體內外均有抗炎作用。CSA 治療降低了脂多糖誘導的巨噬細胞TNF-α 和IL-6 的產生[16]。XIAO等[17]報道CSA對LPS介導的炎癥性肺損傷具有治療潛力。與以上結果一致,本研究證明了CSA 預處理可顯著降低全身炎癥細胞因子,包括TNF-α 和IL-1β。因此,CSA 的心臟保護作用可能歸因于其抗炎特性。QIAN等[18]證明,CSA對急性壞死性胰腺炎大鼠腦損傷的保護作用。本研究進一步證實了CSA在AP相關心臟損害中的有益作用。
在AP 情況下,宿主會產生極端的免疫反應。免疫功能障礙被認為是AP 全身炎癥中的一個重要因素[14]。巨噬細胞是一種重要的免疫細胞類型,通過影響炎癥和免疫功能在AP 多個階段發揮關鍵作用。M1 和M2 巨噬細胞的可塑性隨AP 的發展而變化。M2 巨噬細胞參與炎癥溶解和組織修復,這對AP 的治療至關重要[5]。本研究分析了CSA 對膿毒癥巨噬細胞M1/M2 極化的調節作用。本研究結果表明,CSA 在體外以劑量依賴的方式增加CD206 和CD23標志的巨噬細胞數量。在體內,CSA 誘導心臟巨噬細胞M2 極化,即F4/80+CD206+巨噬細胞占F4/80+細胞(總巨噬細胞)比例升高。以上發現與先前的研究一致,即表觀遺傳修飾物可以調節巨噬細胞表型[19]。PKM2 是巨噬細胞糖酵解重編程的關鍵決定因素[10]。PKM2 的單體和二聚體形式具有不活躍的丙酮酸激酶活性,促進巨噬細胞糖酵解和炎癥反應。而PKM2的四聚體形式具有活性的酶丙酮酸激酶活性,可誘導TCA 循環、OXPHOS 和抗炎反應[10]。研究發現,通過內源性分子和合成化合物抑制PKM2 可以減輕巨噬細胞引起的炎癥性疾病[20-24]。因此,研究進一步觀察PKM2 是否作為CSA 的潛在靶點。結果顯示CSA 預處理可能通過下調PKM2促進M2-巨噬細胞極化。
本研究結果表明,CSA 可以顯著改善L-精氨酸誘導的AP 和相關心臟損害的嚴重程度。以PKM2為靶點的CSA 在AP 中的作用可能與增加M2 巨噬細胞數量、抑制促炎癥細胞因子產生有關。因此,CSA可為胰腺疾病提供治療潛力。

