喙尾琵琶甲腸道來源真菌的分離及其次級代謝產物的抗菌、抗腫瘤活性篩選
李銘暉 王明明 殷鵬凱 楊自忠 肖懷 楊大松 楊銀河
摘要:目的 研究藥用昆蟲喙尾琵琶甲Blaps rynchopetera成蟲腸道的活性真菌,為抗菌、抗腫瘤活性天然產物的開發提供新的真菌資源。方法 結合稀釋涂布法和選擇培養法對喙尾琵琶甲成蟲腸道的真菌進行分離純化;以9株病原菌為指示菌,通過牛津杯瓊脂擴散法檢測腸道真菌次級代謝產物的抗菌活性;結合形態學,通過分子生物學方法進行ITS序列比對,鑒定抗菌活性顯著的真菌并構建系統發育樹;采用5株腫瘤細胞,對已鑒定的菌株進行抗腫瘤活性測試。結果 從喙尾琵琶甲腸道中分離獲得108株真菌,其中17株真菌具有不同程度的抗菌活性;選擇7株抑菌活性顯著(抑菌圈直徑≥14 mm)的真菌進行鑒定;研究還顯示3株真菌的次級代謝產物具有廣譜的抗腫瘤活性。結論 喙尾琵琶甲腸道來源真菌的次級代謝產物具有一定的抗菌及抗腫瘤活性。
關鍵詞:喙尾琵琶甲; 腸道真菌; 抗菌活性; 抗腫瘤活性;分子鑒定; 系統發育樹
中圖分類號:Q978.1 ?文獻標志碼:A
Isolation of fungi from the guts of Blaps rynchopetera and screening of antimicrobial and antitumor activity of fungis secondary metabolites
Li Minghui, Wang Mingming, Yin Pengkai, Yang Zizhong, Xiao Huai, Yang Dasong, and Yang Yinhe
(Yunnan Provincial Key Laboratory of Entomological Biopharmaceutical R&D, College of Pharmacy, Dali University, Dali 671000)
Abstract Objective In order to provide new fungal resources for the development of antimicrobial and antitumor active natural products, the active fungi in the guts of medicinal insect Blaps rynchopetera adults were studied. Methods Fungi were isolated and purified from the gut of B. rynchopetera adults by using dilution coating method and selective culture method. The antimicrobial activities of secondary metabolites from the fungi were detected by Oxford cup agar diffusion assay with 9 pathogenic microorganism as indicator strain. ITS sequence alignment was performed to identify the fungi with significant activity through molecular biological method and the phylogenetic tree was constructed. Five tumor cell lines were used to test the antitumor activity of the identified strains. Results A total of 108 strains of fungi were isolated from the gut of B. rynchopetera, among them 17 strains showed different degrees of antimicrobial activity. Seven fungi with significant antibacterial activity (the diameter of the inhibition zone was greater than 14 mm) were selected for identification. The study also showed that the secondary metabolites of three strains of fungi had broad-spectrum ?antitumor activity. Conclusion The secondary metabolites of fungi from the gut of B. rynchopetera have certain antibacterial and antitumor activity.
Key words Blaps rynchopetera; Gut fungi; Antimicrobial activity; Antitumor activity; Molecular identification; ?Phylogenetic tree
昆蟲,隸屬無脊椎動物節肢動物門昆蟲綱,在自然界中數量龐大,種類繁多,目前已報道和命名的昆蟲達100萬種。昆蟲的腸道系統通常分為前腸、中腸和后腸3個區域,具有存儲、消化食物和排泄的功能[1],這為微生物的定殖提供了獨特的生存環境。昆蟲腸道微生物包含原生生物、古生菌、細菌和真菌等[2],研究表明它們可幫助宿主消化食物以獲取生存所必需的營養成分,提高宿主對寄生蟲、病原體的防御,調節免疫系統提升自我解毒的能力,影響宿主的發育周期、交配繁殖及壽命等 [3-6]。已有文獻報道昆蟲腸道微生物具有產生活性次級代謝產物的能力,例如從三開蜣螂Copris tripartitus的腸道細菌中分離獲得兩個新型環肽類化合物Coprisamides A和B,對苯醌還原酶均具有顯著的誘導活性[7]。從黑負葬甲Nicrophorus concolor的腸道放線菌微桿菌Microbacterium sp.分離出兩個多肽類化合物nicrophorusamides A和B,對金黃色葡萄球菌、糞腸球菌等革蘭陽性菌具有抑制作用[8]。研究表明,昆蟲腸道微生物是挖掘新型次級代謝產物的重要來源,具有潛在的藥用價值和研究意義。
喙尾琵琶甲Blaps rynchopetera屬于鞘翅目Coleoptera擬步甲科Tenebrionidae琵琶甲屬Blaps,是一種攜帶特殊臭味的昆蟲,具有抗菌、消炎、解毒、免疫調節等作用,作為一種民間藥用昆蟲,在云南彝族長期廣泛用來治療發燒、咳嗽、胃炎、瘡腫等病癥[9]。近年研究發現,喙尾琵琶甲蟲體提取物中含有酚類、醌類、脂肪酸、脂肪酸酯、環肽、氨基酸等化學成分[10-12],研究還顯示喙尾琵琶甲成蟲的粗提物具有體外抑菌活性、抗腫瘤活性和抗氧化活性[13-15]。根據調查[16],喙尾琵琶甲在云南省分布廣泛,生長在垂直海拔760~2450 m陰涼潮濕的環境,靠近居民房屋、牲畜圈舍,這樣的生存環境大大增加了喙尾琵琶甲腸道菌群的種類豐富度。
鑒于喙尾琵琶甲是一種分布廣,適應性強,生存環境較為惡劣的藥用昆蟲,目前尚未有喙尾琵琶甲腸道真菌代謝產物的相關研究。本研究對喙尾琵琶腸道來源真菌進行分離純化,共獲得108株真菌。以6株病原細菌、3株病原真菌為指示菌,采用牛津杯瓊脂擴散法對抗菌活性真菌進行篩選。結果顯示,17株真菌的次級代謝產物具有不同程度的抗菌活性。本研究對抗菌活性明顯的7株真菌進行形態學、分子生物學鑒定,并對這7株真菌的次級代謝產物進行抗腫瘤活性測試,結果顯示3株真菌的次級代謝產物對5株腫瘤細胞表現出較高的細胞抑制率。本研究是對藥用昆蟲喙尾琵琶甲成蟲腸道真菌資源的首次探索,這為后續從喙尾琵琶甲成蟲腸道真菌中挖掘活性天然產物提供了重要的微生物資源。
1 材料與方法
1.1 供試昆蟲與病原菌
喙尾琵琶甲成蟲的采集時間:2020年8月;地點:云南省大理白族自治州大理市滿江區農作物田地內。成蟲經大理大學昆蟲生物醫藥研發重點實驗室楊自忠教授根據形態特征[17]鑒定為喙尾琵琶甲Blaps rynchopetera。
9株病原菌:金黃色葡萄球菌Staphylococcus aureus (ATCC25923)、大腸埃希菌Escherichia coli (ATCC25922)、銅綠假單胞菌Pseudomonas aeruginosa (ATCC9027)、糞腸球菌Enterococcus faecalis (ATCC47077)、白假絲酵母Canidia albicans (ATCC10231)、黑曲霉Aspergillus niger (BNCC186380)、青霉Penicillium expansum (BNCC117714) 由昆蟲生物醫藥研發重點實驗室菌種儲藏庫提供,耐甲氧西林金黃色葡萄球菌(methieillin-resistant Staphylococus aureus, MRSA)(ATCC43300)購自廣東省科學院微生物研究所,鼠傷寒沙門菌Salmonella typhimurium (BNCC103281) 購自北納生物科技有限公司。
供試腫瘤細胞系:采用肺癌細胞A549、肝癌細胞SMMC-7721、宮頸癌細胞Hela、乳腺癌細胞MDA-MB-231及結腸癌細胞SW480 5種腫瘤細胞進行真菌代謝產物的抗腫瘤活性測試,所有細胞系均由中國科學院昆明植物研究所天然藥物活性篩選中心提供。
1.2 試劑與儀器
真菌分離純化用PDA培養基(廣東環凱微生物科技有限公司),分離時培養基中添加50 μg/mL氯霉素以抑制細菌生長。病原菌的活化及抗菌活性篩選培養基為PDA培養基、LB培養基(廣東環凱微生物科技有限公司)、BHI培養基(北京陸橋技術股份有限公司)。
陽性藥品試劑主要包括鹽酸萬古霉素(vancomycin hydrochloride)、青霉素G鈉(penicillin G sodium)和制霉菌素(nystatin) (上海麥克林生化科技有限公司),氯霉素(chloramphenicol) (上海阿拉丁試劑有限公司)。
主要試劑包括瓊脂粉(廣東環凱微生物科技有限公司),甲醇、乙酸乙酯、冰乙酸(天津市風船化學試劑科技有限公司),真菌基因組提取試劑盒(武漢納磁生物科技有限公司)、PCR產物磁珠法純化試劑盒(上海碩美生物科技有限公司)。通用引物為北京六合華大基因科技有限公司合成。
儀器主要包括潔凈工作臺(SW-CJ-2FD,蘇州安泰空氣技術有限公司),振蕩培養箱(MQD-S2R,上海旻泉儀器有限公司),生化培養箱(LBI-250,上海龍躍儀器設備有限公司),立式壓力蒸汽滅菌器(YXQ-50A,上海博訊醫療生物儀器股份有限公司),電子天平(WTB 5008,杭州萬特衡器有限公司),PCR儀(9700,ABI公司),離心機(5417R,德國Eppendorf公司),電泳儀電源(DYY-8C,北京市六一儀器廠),水浴鍋(DK-24,上海精宏實驗設備有限公司)。
1.3 腸道真菌的分離、純化
將20頭喙尾琵琶甲成蟲活體置于已滅菌的玻璃瓶中,于-20 ℃條件下放置30 min。待蟲體不動后,在潔凈工作臺內,對蟲體進行體表的消毒:向瓶中加入無菌水,用力搖晃2 min,清洗2次,依次用5%次氯酸鈉浸泡1 min,75%乙醇浸泡3 min,用無菌水沖洗3次,置于室溫晾干。取最后一次清洗的無菌水200 μL涂布于PDA培養基上,在28 ℃的培養箱中培養7 d,觀察培養基上沒有任何微生物生長。
在潔凈工作臺上,用手術刀、剪刀將試蟲腹部覆蓋的體殼去除,暴露出內部臟器組織,取出腸道組織,稱重,加入PBS溶液(1 mL/g)研磨。取1 mL研磨液至裝有9 mL PBS的試管中,依次稀釋至10-6 g/mL
濃度,采用稀釋涂布法,取10-3~10-6 g/mL不同濃度的稀釋液各100 μL均勻涂布于含有50 μg/mL氯霉素、100 mg/L氯霉素和鏈霉素混合液的PDA培養基上,每個濃度進行3個平行實驗,同時設置培養基空白對照和PBS溶劑對照;將平板置于28 ℃培養箱中培養,待平板長出可見菌落,通過觀察菌落形態、大小、菌絲顏色等特征,挑取菌絲在PDA培養基上進行真菌純化,至少轉接3次以上,直至獲得單一菌株,用50%甘油作為凍存液,將菌種保存于-80 ℃冰箱中。
1.4 腸道真菌的抗菌活性測試
真菌代謝粗提物的制備:每株菌發酵10個平皿,置于28 ℃培養箱中培養14 d后,將培養基切割成小塊,以乙酸乙酯 : 甲醇 : 冰乙酸 = 80 : 15 : 5(V/V/V)
的配比液分別浸泡3 d,2 d,1 d,過濾提取液,合并減壓濃縮獲得粗提物浸膏。
采用牛津杯瓊脂擴散法[18]檢測真菌次級代謝產物粗提物的抗菌活性:將9株病原菌于對應的液體培養基中進行活化培養4 h (37 ℃,180 r/min),調整菌液濃度為(3~5)×106 CFU/mL的菌懸液。各吸取
100 μL菌液至對應的固體培養基上,均勻涂布,輕輕插入牛津杯 (直徑8 mm),分別吸取100 μL粗提物 (20 mg/mL),對應陽性藥(鹽酸萬古霉素150 μg/mL、氯霉素150 μg/mL、青霉素G鈉150 μg/mL、制霉菌素1 mg/mL)加入牛津杯,將培養皿于4 ℃冰箱中放置
4 h后再轉移至37 ℃培養箱中培養,12 h后觀察結果,記錄抑菌圈的大小,每組進行3次平行實驗。
1.5 抗菌活性真菌鑒定及系統發育樹分析
觀察抗菌活性明顯的7株真菌在平板上的菌落形態、菌絲形態和孢子形態。采用柱式法提取真菌基因組DNA。使用真菌通用引物ITS4 (5'-TCCTCCGCTTATTGATATGC-3')和ITS1(5'- TCCGTAGGTGAACCTGCGG-3')擴增轉錄間隔區ITS序列。PCR反應體系(25 μL):PCR Mix 21 μL,上、下游引物(5 pmol/L)各1 μL,模板(ng/μL) 2 μL。PCR反應程序:96 ℃ 5 min;96 ℃ 20 s,56 ℃ 30 s,72 ℃ 30 s,共35個循環;72 ℃ 10 min。對3 ?L PCR產物進行1.0%的瓊脂糖凝膠檢測后,委托北京六合華大基因科技有限公司進行基因測序。
將純化后的PCR產物進行上機測序,選擇與菌株同源性高的序列作為參照序列,將測序結果與NCBI數據庫中的序列進行Blast比對,運用MEGA 7.0軟件,采用Neighbor Joining方法[19]構建系統發育樹,根據真菌菌株間的親緣關系確定種屬分類情況,最后將各菌株序列提交至GenBank數據庫,以獲取序列號。
1.6 腸道真菌代謝產物對腫瘤細胞的抑制活性測試
實驗采用MTS法檢測7株喙尾琵琶甲成蟲腸道真菌代謝產物的抗腫瘤細胞活性,用含10%胎牛血清的RMPI1640完全培養液配制單個細胞懸液,提前12~24 h接種細胞進行培養,接種3000~5000個細
胞/孔至96孔板上,每孔體積100 μL。樣品用DMSO溶解,加入細胞孔,以100 μg/mL樣品濃度篩選,每孔終體積200 μL,每種處理均設3個復孔。于37 ℃培養48 h后,保留貼壁細胞棄孔內培養液,每孔加MTS溶液20 μL和培養液100 μL;設3個空白復孔 (MTS溶液20 μL和培養液100 μL的混合液),繼續孵育2~4 h,使反應充分進行后測定光吸收值。
選擇492 nm波長,使用多功能酶標儀讀取各孔的光吸收值,記錄結果,數據處理后以樣品編號為橫坐標,細胞抑制率為縱坐標繪制細胞的抑制率圖。實驗設順鉑(cisplatin, DDP)和紫杉醇(Taxol)兩個陽性化合物,以化合物濃度為橫坐標,細胞存活率為縱坐標繪制細胞生長曲線,計算在不同濃度下的化合物對五種腫瘤細胞的抑制率。
2 結果
2.1 腸道真菌的分離、純化
從喙尾琵琶甲成蟲腸道中分離到真菌108株,編號為BPF1~BPF108,保存于-80℃超低溫冰箱內。
2.2 腸道真菌的抗菌活性
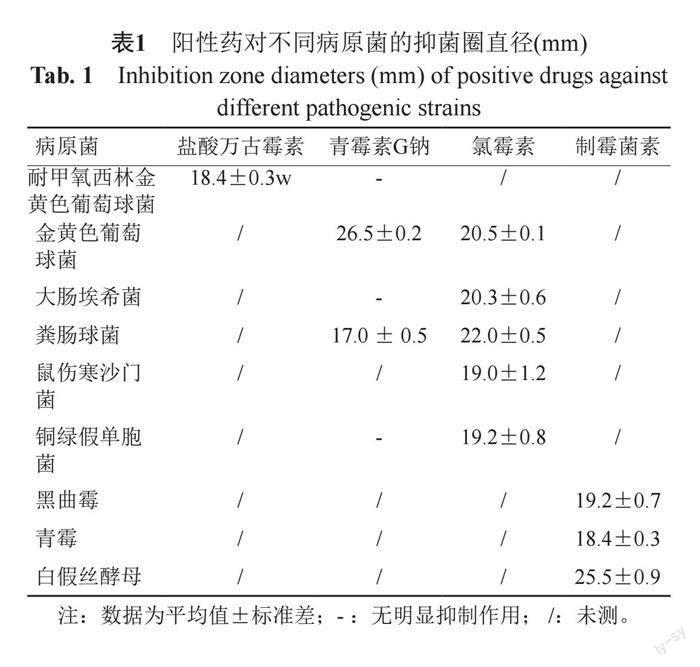
根據不同病原菌,實驗選用不同的陽性藥為對照,采用牛津杯瓊脂擴散法檢測真菌代謝產物的抗菌活性,陽性藥的抑菌圈直徑見表1所示。
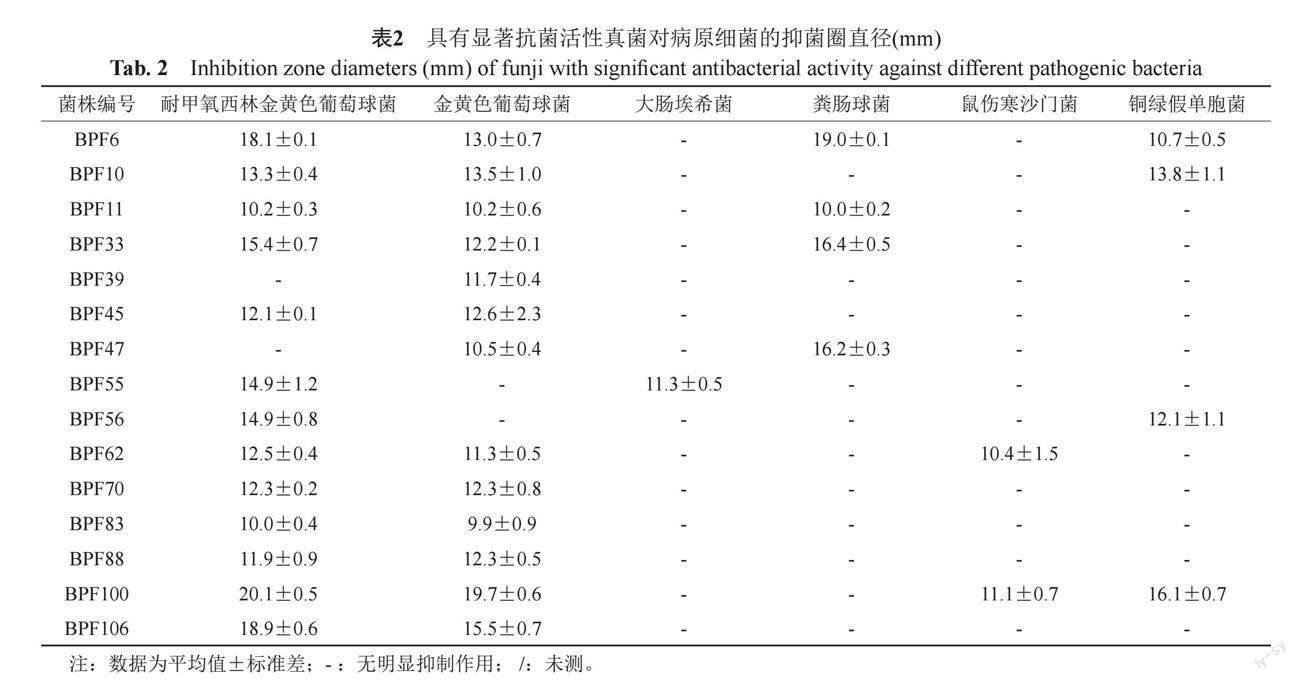
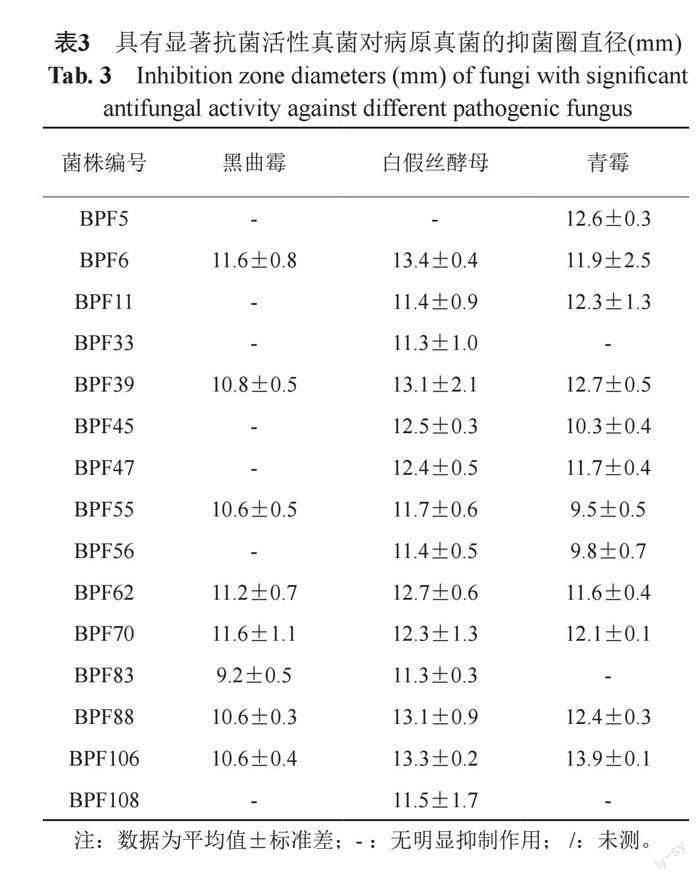
抗細菌活性結果表明:通過對108株腸道真菌的固體發酵產物進行抗菌活性檢測,其中有15株真菌的代謝產物對病原細菌表現出不同程度的抑菌作用,有7株真菌的代謝產物對病原細菌顯示出較強的抑菌活性(抑菌圈直徑≥14 mm)[20]。其中菌株BPF6、BPF100的代謝產物對四株細菌具有抑制作用,BPF10、BPF11、BPF33、BPF62的代謝產物對3株細菌具有抑制作用,抑菌圈直徑見表2。圖1顯示的是部分喙尾琵琶甲成蟲腸道真菌代謝產物對細菌的抑制作用。抗真菌活性結果顯示:共有15株真菌的代謝產物表現出抑菌活性,其中7株真菌BPF6、BPF39、BPF55、BPF62、BPF70、BPF88、BPF106的代謝產物對黑曲霉、青霉和白假絲酵母3種真菌具有廣譜的抑菌活性,抑菌圈直徑見表3。
2.3 抗菌活性真菌鑒定及系統發育樹分析
喙尾琵琶甲成蟲腸道真菌代謝產物的抗菌活性結果(表2~3)顯示:具有顯著抗菌活性(抑菌圈直徑≥14 mm)的腸道真菌共有7株,編號依次為BPF6、BPF33、BPF47、BPF55、BPF56、BPF100、BPF106,這些真菌在PDA培養基上的菌落形態見圖2和表4。圖2表明,各菌株的菌落形態均有差異,呈現出絨毛狀或絮狀,菌落顏色呈現綠色、黃色、白色、棕色等,菌絲均呈現出分枝狀,分生孢子呈現卵圓形或橢圓形。有的菌株生長較快,菌絲較發達,如BPF6和BPF33,在溫度為28 ℃的PDA平板上,3 d即可長至平板的三分之二大小。有的菌株生長較慢,如BPF100和BPF106,但它們的菌落邊緣較為清晰,易于觀察[21-24]。
提取7株抗菌活性顯著真菌的DNA,使用通用引物(ITS1和ITS4)進行PCR擴增,獲得目的基因擴增片段。對擴增產物測序,測序結果通過NCBI數據庫中Blast程序進行比對。將同源性高的序列作為參照序列,并運用MEGA 7軟件采用Neighbor-Joining方法構建系統發育樹(圖3)。結果發現這7株菌歸屬于5個屬,其中,真菌BPF6和BPF33與長梗木霉屬Trichoderma longibrachiatum的序列相似性達100%,真菌BPF47與深綠木霉屬Trichoderma atroviride的序列相似性達100%,真菌BPF55與尖孢鐮刀屬Fusarium oxysporum的序列相似性達100%,真菌BPF56和BPF100與桔青霉屬Penicillium citrinum的序列相似性達100%,真菌BPF106與假枝孢菌Cladosporium pseudocladosporioides的序列相似性達100%。將7株真菌的擴增序列提交至GenBank數據庫,菌株按照編號數字由小到大對應的序列號為OP364036.1–OP364042.1。
2.4 ?腸道真菌對腫瘤細胞的抑制活性
采用MTS法對7株喙尾琵琶甲成蟲腸道真菌:BPF6、BPF33、BPF47、BPF55、BPF56、BPF100和BPF106的代謝產物進行腫瘤細胞抑制活性測試。結果顯示,在測試濃度為100 μg/mL 時,7株真菌的代謝產物對5株腫瘤細胞表現出不同程度的抑制活性,其中3株真菌BPF6、BPF33、BPF55對5株腫瘤細胞的抑制率較高,實驗結果見表5。
3 討論
天然產物骨架類型豐富,生物活性廣泛,是創新藥物的重要來源。微生物因分布廣泛,種類繁多,生境條件多樣,生長周期短,發酵技術較成熟,短時間內可大量富集代謝產物等優勢獲得眾多學者的關注。近年來,同一生境下微生物代謝產物的重復分離導致新型抗生素發現速度降低,本研究提出以生境特殊、腸道微生物豐富、生存競爭激烈、研究較少的藥用昆蟲喙尾琵琶甲成蟲腸道來源真菌作為新的微生物來源,對后續研究新型抗生素具有重要的指導意義。Yin等[25]從黃蜻Pantala flavescens腸道內生真菌Curvularia crepinii QTYC-1的代謝物中分離出4個化合物,其中新化合物O-demethylated-zeaenol對蘋果黑腐皮殼菌具有抑制作用,可在農業生產領域用作生物防腐劑。Li等[26]從螽斯Longhorned grasshoppers腸道內生真菌Fusarium proliferatum ZS07的代謝物中分離出6個化合物,其中新聚酮衍生物O-methylated SMA93,對枯草芽胞桿菌具有較強抑制作用,在農業生產上可用作生物防腐劑。
本研究對20頭喙尾琵琶甲成蟲腸道中的真菌進行分離純化,獲得108株形態有差異的真菌,說明其腸道中可培養的真菌資源較為豐富。對108株真菌的代謝產物進行抗菌活性篩選,結果顯示有7株真菌的代謝物對病原菌顯示出較強的抑制作用(表2~3),有3株真菌代謝物對腫瘤細胞表現出較高的抑制率(表5)。鑒定結果顯示這7株活性真菌歸于5個屬(圖3)。其中BPF6、BPF33具有較強的抗菌活性和抗腫瘤活性,與其親緣關系較近的長梗木霉屬Trichoderma longibrachiatum真菌,有文獻報道[27]從其代謝物中分離獲得5個新化合物,其中化合物Longibramides B 和 E對金黃色葡萄球菌有抑制作用,對乳腺癌細胞MCF-7、小鼠小膠質瘤細胞BV-2具細胞毒作用;Ngo等[28]從長梗木霉SFC100166的培養液中獲取13個化合物,其中11個化合物對不同植物致病真菌具不同程度的抑制作用;深綠木霉的代謝產物能抑制幽門螺旋桿菌以及產志賀氏毒素大腸埃希菌[29];尖孢鐮刀菌的代謝產物具有廣譜的抑菌作用[30];桔青霉代謝產物對小鼠腫瘤細胞系具有細胞毒活性,對金黃色葡萄球菌也有一定的抑制作用[31];本研究獲得的腸道真菌表現出極大的研發潛力,后續可對這些活性真菌進行次級代謝產物及其作用機制研究。研究結果顯示喙尾琵琶甲成蟲腸道含有豐富的真菌,腸道內存在的抗菌活性真菌,或為蟲體自身抵御外來病原菌的侵染提供助力。本研究僅對真菌次級代謝產物的粗提物進行活性篩選,獲得了具有一定抗菌活性、抗腫瘤活性的菌株,這為進一步研究喙尾琵琶甲成蟲腸道真菌的生物活性物質提供了新的真菌資源。
4 結論
本研究從喙尾琵琶甲成蟲腸道中分離獲得108株真菌,其中抗菌活性菌有17株;7株抑菌活性顯著的真菌經鑒定歸屬于5個屬;3株真菌的次級代謝產物具有廣譜的抗腫瘤活性。該研究表明喙尾琵琶甲腸道來源真菌的次級代謝產物具有一定的抗菌及抗腫瘤活性,為后續進一步挖掘活性次級代謝產物奠定了基礎。
參 考 文 獻
Engel P, Moran N A. The gut microbiota of insects-diversity in structure and function[J]. FEMS Microbiol Rev, 2013, 37: 699-735.
Douglas A E. Multiorganismal insects: Diversity and function of resident microorganisms[J]. Annu Rev Entomol, 2015, 60: 17-34.
Zhang Y L, Ge H M, Zhao W, et al. Unprecedented immunosuppressive polyketides from Daldinia eschscholzii, a mantis-associated fungus[J]. Angew Chem Int Ed Engl, 2008, 47: 5823-5826.
Salem H, Bauer E, Strauss A S, et al. Vitamin supplementation by gut symbionts ensures metabolic homeostasis in an insect host[J]. Proc R Soc B, 2014, ?281: 20141838.
Zug R, Hammerstein P. Bad guys turned nice? A critical assessment of Wolbachia mutualisms in arthropod hosts[J]. Biol Rev Cambridge Philos Soc, 2015, 90(1): 89-111.
Shan H W, Wu W, Sun Z T, et al. The gut microbiota of the insect infraorder Pentatomomorpha (Hemiptera: Heteroptera) for the light of ecology and evolution[J]. Microorganisms, 2021, 9, 464.
Um S, Park S H, Kim J, et al. Coprisamides A and B, new branched cyclic peptides from a gut bacterium of the dung beetle Copris tripartitus[J]. Org Lett, 2015, 17: 1272-1275.
Shin Y H, Bae S, Sim J, et al. Nicrophorusamides A and B, antibacterial chlorinated cyclic peptides from a gut bacterium of the carrion beetle Nicrophorus concolor[J]. J Nat Prod, 2017, ?80: 2962-2968.
羅建蓉, 何江波, 張楨, 等. 藥用昆蟲喙尾琵琶甲化學成分研究[J]. 中成藥, 2010, 32(11): 2013-2014.
羅情, 蔡樂, 巫秀美, 等. 藥用昆蟲喙尾琵琶甲中環肽類成分研究[J]. 中草藥, 2015, 46(16): 2381-2384.
郭明磊, 劉建宏. 喙尾琵琶甲化學防御物質氣相色譜-質譜分析及抑菌試驗[J]. 湖北農業科學, 2016, 55(5): 1271-1273.
賈力揚, 李啟艷. 喙尾琵琶甲化學成分及藥理應用的研究進展[J]. 中醫藥學報, 2018, 46(6): 118-122.
李蕾, 遲勝起, 李文鵬, 等. 云南琵琶甲化學成分的抑菌活性[J]. 云南大學學報(自然科學版), 2000, 22(5): 386-388.
施貴榮, 莊孝龍, 郭美仙, 等. 喙尾琵琶甲提取物的體外抗腫瘤活性研究[J]. 安徽農業科學, 2012, 40(6): 3387-3388.
崔文博, 錢金栿, 羅建蓉, 等. 喙尾琵琶甲不同極性段提取物的體外抗氧化活性研究[J]. 時珍國醫國藥, 2013, 24(7): 1566-1567.
趙敏, 陳曉鳴, 孫龍, 等. 云南省喙尾琵琶甲分布及生態環境調查[J]. 林業科學研究, 2007, 20(3): 356-362.
任國棟, 董賽紅, 彭東顏. 中國琵甲屬Blaps Fabricius防御腺研究(鞘翅目:擬步甲科)[J]. 河北大學學報(自然科學版), 2000, 20(S1): 37-45.
周芳, 熊海濤, 張江, 等. 牛津杯法測定抗菌肽對四種有害微生物的抑制效果[J]. 飼料工業, 2018, 39(06): 48-51.
陸嬌嬌, 暢瑛, 李波, 等. 兩株灰黃霉素產生菌的18S rDNA和ITS序列測定與分析[J]. 福建農業科技, 2019, 50(10): 10-15.
Bibi Y, Nisa S, Chaudhary F M, et al. Antibacterial activity of some selected medicinal plants of Pakistan[J]. BMC Complement Altern Med, 2011, 11: 52.
Bissett J. A revision of the genus Trichoderma. I. Section Longibrachiatum sect. nov[J]. Can J Bot, 1984, 62: 924-931.
魏景超. 真菌鑒定手冊[M]. 上海: 上海科學技術出版社, 1979: 623.
中國科學院中國孢子植物志編輯委員會. 中國真菌志[S]. (第三十五卷青霉屬及其相關有性型屬). 北京: 科學出版社, 2007: 121-124.
Lee D J, Lee J S, Lee H B, et al. Four endophytic ascomycetes new to Korea: Cladosporium anthropophilum, C. pseudocladosporioides, Daldinia eschscholtzii, and Nigrospora chinensis[J]. Kor J Mycol, 2019, 47(3): 187-97.
Yin C P, Jin L P, Sun F F, et al. Phytotoxic and antifungal metabolites from Curvularia crepinii QTYC-1 isolated from the gut of Pantala flavescens[J]. Molecules, 2018, 23, 951.
Li S, Shao M W, Lu Y H, et al. Phytotoxic and antibacterial metabolites from Fusarium proliferatum ZS07 isolated from the gut of long-horned grasshoppers[J]. J Agric Food Chem, 2014, 62: 8997-9001.
Zhang S H, Yang J, Ma H, et al. Longibramides A-E, peptaibols isolated from a mushroom derived fungus Trichoderma longibrachiatum Rifai DMG-3-1-1[J]. Chem Biodiversity, 2021, 18: e2100128.
Ngo M T, Nguyen M V, Han J W, et al. In vitro and in vivo antifungal activity of sorbicillinoids produced by Trichoderma longibrachiatum[J]. J Fungi, 2021, 7: 428.
Saravanakumar K, Mandava S, Chellia R, et al. Novel metabolites from Trichoderma atroviride against human prostate cancer cells and their inhibitory effect on Helicobacter pylori and Shigella toxin producing Escherichia coli[J]. Microb Pathog, 2019, 126: 19-26.
Poleto L, da Rosa L O, Fontana R C, et al. Production of antimicrobial metabolites against pathogenic bacteria and yeasts by Fusarium oxysporum in submerged culture processes[J]. Bioprocess Biosyst Eng, 2021, 44(6): 1321-1332.
Lai D, Br?tz-Oesterhelt H, Müller W E, et al. Bioactive polyketides and alkaloids from Penicillium citrinum, a fungal endophyte isolated from Ocimum tenuiflorum[J]. Fitoterapia, 2013, 91: 100-106.

