澳洲堅果葉片黃化期間光合能量代謝相關基因的表達研究



摘""要:葉片光合作用是維持植物生命活動的能量來源,但在華南地區一些澳洲堅果品種的新梢葉片通常在夏季持續高溫條件下發生黃化,嚴重影響了植株生長和果實生產。為了探究澳洲堅果黃化葉片的光合能量發生機制,本研究基于前期獲得的HAES344澳洲堅果不同黃化時期葉片轉錄組測序數據,鑒定與篩選光合能量代謝相關基因,并通過qRT-PCR分析光合能量代謝中的關鍵基因在HAES344澳洲堅果葉片黃化過程中的表達變化。結果表明:通過KEGG功能注釋和富集分析,在HAES344澳洲堅果葉片黃化期間共鑒定出96個差異表達基因與能量代謝相關,以氧化磷酸化路徑富集的差異基因數量最多,其次是碳固定路徑,而富集到天線蛋白的差異基因最少;經過篩選(RPKMgt;0.5),共獲得43個基因與光合能量代謝相關,其中有27個基因的表達量在黃化葉片中明顯降低,另有16個基因的表達量變化則相反。利用qRT-PCR分析光合能量代謝中重要功能基因的相對表達量發現,在HAES344澳洲堅果黃化葉片中有關光系統Ⅱ(PSⅡ)天線蛋白編碼基因CAP10A、ATP合酶亞基蛋白編碼基因(ATPC、ATPF)、碳同化酶基因(GAPA、GPD、At4g2652、rbcL)、硫氧還蛋白編碼基因(Os05g0200100、CXXS1)及質體蛋白跨膜轉運基因TIC32的轉錄水平均顯著低于其正常葉片,而有關硫代謝基因(SIR、APR3)和環式電子傳遞介導基因(PGR5、ndhB、ndhD)的相對表達量則顯著高于其正常葉片,表明澳洲堅果黃化葉片中光合能量代謝相關基因的表達模式發生了較大改變,進而影響了光合能量的產生。該研究結果為深入探討光合能量代謝相關基因在澳洲堅果黃化葉片中的作用機制提供參考依據。
關鍵詞:澳洲堅果;葉片黃化;光合作用;能量代謝;電子傳遞中圖分類號:S664.9""""""文獻標志碼:A
Expression"of"Genes"Related"to"Photosynthetic"Energy"Metabolism"During"Leaf"Yellowing"of"Macadamia
YANG"Weihai,"GUO"Shanxiang,"XU"Ting,"XIAO"Yi,"LEI"Wenjun
College"of"Life"Science"and"Resources"and"Environment,"Yichun"University,"Yichun,"Jiangxi"336000,"China
Abstract:"Leaf"photosynthesis"is"the"energy"source"of"plant"life"activities."However,"some"macadamia"varieties"(Macadamia"integrifolia)"planted"in"southern"China"are"prone"to"generate"the"etiolated"leaves"under"the"continuous"high"temperature"in"summer,"which"seriously"affects"the"shoot"growth"and"fruit"production"of"macadamia"trees."In"order"to"explore"the"mechanism"of"photosynthetic"energy"generation"in"the"etiolated"leaves"of"macadamia,"the"genes"related"to"photosynthetic"energy"metabolism"were"identified"and"screened"in"this"study,"based"on"the"previously"obtained"transcriptome"sequencing"data"from"the"leaves"of"HAES344"macadamia"at"different"yellowing"stages,"and"the"expression"changes"of"the"key"genes"in"photosynthetic"energy"metabolism"were"analyzed"during"leaf"yellowing"of"HAES344"macadamia"by"qRT-PCR."96"genes"with"differential"expression"in"the"etiolated"leaves"of"HAES344"macadamia"were"identified"to"be"related"to"energy"metabolism"according"to"KEGG"functional"annotation"and"enrichment"analysis,"and"the"number"of"the"differentially"expressed"genes"enriched"in"the"oxidative"phosphorylation"pathway"was"the"highest,"followed"by"carbon"fixation"pathway,"and"the"least"genes"were"enriched"in"the"antenna"proteins."After"screening"(RPKMgt;0.5),"a"total"of"43"genes"related"to"photosynthetic"energy"metabolism"were"obtained."Among"these"genes,"the"expression"level"of"27"genes"decreased"significantly"in"the"yellowed"leaves,"while"the"remaining"16"genes"did"the"opposite."Through"the"qRT-PCR"analysis"of"the"relative"expression"level"of"key"functional"genes"in"the"photosynthetic"energy"metabolism,"the"CAP10A"gene"encoding"photosystem"Ⅱ"(PSⅡ)"antenna"protein,"the"ATPC"and"ATPF"genes"encoding"ATPase"subunit"protein,"the"enzyme"genes"related"to"carbon"assimilation"(GAPA,"GPD,"At4g2652"and"rbcL),"the"Os05g0200100"and"CXXS1"genes"encoding"thioredoxin,"and"the"TIC32"gene"associated"with"plastid"protein"transmembrane"transport"showed"a"significant"lower"transcription"level"in"the"etiolated"leaves"of"HAES344"macadamia"compared"with"the"normal"leaves,"while"the"SIR"and"APR3"genes"related"to"sulfur"metabolism"and"the"PGR5,"ndhB"and"ndhD"genes"mediating"cyclic"electron"transfer"did"the"opposite,"which"suggested"that"the"greatly"changed"expression"patterns"of"genes"related"to"photosynthetic"energy"metabolism"affected"the"production"of"photosynthetic"energy"in"the"macadamia"yellowing"leaves."The"results"of"this"study"would"provide"a"reference"for"further"exploring"the"mechanism"of"photosynthetic"energy"metabolism-related"genes"in"the"etiolated"leaves"of"macadamia.
Keywords:"macadamia"(Macadamia"integrifolia);"leaf"yellowing;"photosynthesis;"energy"metabolism;"electron"transport
DOI:"10.3969/j.issn.1000-2561.2024.06.003
澳洲堅果(Macadamia"integrifolia)起源于澳大利亞,因其果仁營養豐富、風味獨特而在熱帶及亞熱帶地區廣泛栽培。中國是澳洲堅果生產大國,種植面積超過20萬hm2,穩居世界第一[1]。云南與廣西作為我國澳洲堅果的兩大重要產區,其主栽品種HAES344和桂熱1號在夏季持續的高溫條件下經常出現新梢葉片黃化現象,嚴重時甚至干枯,進而影響果實產量[2],嚴重制約了當地澳洲堅果產業的發展。
光合作用對高溫脅迫尤為敏感。高溫能夠破壞光系統Ⅱ(PSⅡ)的捕光天線系統、供體側放氧復合體以及反應中心結構,影響PSⅡ受體側電子傳遞及其光合放氧功能;同時,高溫影響光合反應過程中相關酶的活性,進而影響碳同化效率[3]。核酮糖-1,5-二磷酸(RuBP)羧化酶/加氧酶(Rubisco)是碳同化的關鍵酶和限速酶,該酶在葉綠體基質中大部分處于鈍化形態,只有經Rubisco活化酶(RCA)活化后才具備活性[4]。然而,RCA對高溫非常敏感,因RCA活性受到抑制而造成活化的Rubisco數量減少,是高溫脅迫下葉片Rubisco活性及光合速率降低的一個重要原因[5]。在梨黃化葉片中,RCA活性及其編碼基因Rubisco"activase"Ⅳ/Ⅴ的表達均正向調控光合作用[6]。Rubisco的大亞基(rbcL)在光合作用中起著關鍵性作用[7],脅迫條件下rbcL基因的表達量下調可導致其光合作用下降[8-9]。另外,甘油醛-3-磷酸脫氫酶(GAPDH)[10]、果糖-1,6-二磷酸醛縮酶(FBA)[11]、核糖-5-磷酸異構酶(RPI)[12]等酶的活性水平也與卡爾文循環的運轉速率有關,影響著植物的光合能力。高溫條件下,葉綠體中GAPDH[13]與FBA[6,"14]顯著上調表達,有利于提高其編碼酶的蛋白表達水平及活性,增強葉片光合能力。
正常情況下,光反應能夠為碳同化提供比例合適的ATP/NADPH能量分子。然而,發生在類囊體片層的光反應是容易受到高溫脅迫損傷的關鍵位點,造成ATP及NADPH的生產和消耗失衡,進而誘導光化學電子傳遞鏈組分過度還原與活性氧(ROS)過量產生,導致光抑制的增強和光系統的氧化損傷[15-16]。在葉綠體中,ATP是由ATP合酶(ATPase)催化光合磷酸化反應而產生,NADPH則是在線性電子傳遞鏈末端通過葉型鐵氧還蛋白(Fd)-NADP+氧化還原酶(LFNR)催化而成。高溫脅迫明顯降低苜蓿葉綠體的ATPase"活性和ATP含量,光合速率亦明顯下降[17]。葉面噴施亞精胺可顯著增加熱脅迫下ATPase亞基CF1及其編碼基因ATPA的表達[18]。ZHANG等[19]指出,高溫脅迫容易使得光合線性電子傳遞受阻,導致非循環光合磷酸化活性下降,影響ATP的產生。HUANG等[20]發現,在短暫的溫度脅迫下,植物會激活圍繞光系統Ⅰ(PSⅠ)的環式電子傳遞,亦可通過ATPase驅動ATP合成,保證有足夠的ATP用于碳同化、光呼吸以及PSⅡ修復。YAMORI等[21]認為,環式電子傳遞循環對提高葉綠體內ATP含量或者ATP/NADPH比值以及保護光系統免遭脅迫引起的氧化損害具有重要作用。然而,環式電子傳遞循環對各電子載體的氧化還原平衡高度敏感。溫度變化可通過影響硫氧還蛋白(Trx)的氧化還原狀態來調節電子載體的氧化還原活性及其電子傳遞效率[22]。KANG等[23]認為,Trx不僅可以通過依賴Fd的Trx氧化還原酶(FTR)調節PGR5/PGRL1介導的環式電子傳遞途徑,也可以通過依賴NADPH的Trx還原酶C(NTRC)控制光合電子傳遞和非光化學淬滅,還能夠對葉綠體酶(如GAPDH、RCA)的巰基進行還原調控,以調節光合碳同化過程。過表達NTRC能夠促進葉綠體ATPase和Trx調節酶的活化[23],提高PGR5表達量可增強環式電子流[24],進而增強植物的抗性。
前期研究已表明,受高溫脅迫引發的HAES344澳洲堅果黃化葉片中葉綠素含量和PSⅡ活性均明顯降低[2],但在葉片黃化過程中光合能量代謝相關基因的表達情況尚不清楚。因此,本研究基于前期測序的HAES344澳洲堅果黃化葉片轉錄組數據[25],采用生物信息學方法對其光合能量代謝相關差異表達基因進行篩選,通過qRT-PCR進一步分析其中重要基因的表達變化,進而解析澳洲堅果葉片黃化過程中光合能量代謝相關基因的差異表達規律,為深入認識澳洲堅果葉片黃化機理奠定基礎。
1""材料與方法
1.1""材料
以廣東省湛江市的3株樹冠生長較一致、夏梢正常抽生的8~10年生HAES344澳洲堅果植株作為供試材料,于2019年6月1日(S1:全綠葉片)、20日(S2:中度黃化葉片,黃化面積占總葉面積的50%~70%)和28日(S3:重度黃化葉片,黃化面積接近100%)分別在樹冠外圍采集夏梢上初始成熟的第4~5輪葉片作為樣品(圖1),將葉片用超純水沖洗干凈后剪碎,置于–80"℃冰箱中備用。
1.2""方法
1.2.1""能量代謝相關基因的篩選""基因表達量數據來源于前期獲得的HAES344澳洲堅果不同黃化時期葉片(各時期均為3個生物學重復)轉錄組數據[25]。利用DESeq2軟件進行差異基因分析,結合KEGG、Nr、Pfam等數據庫的基因功能注釋,按照Plt;0.05且[∣log2"(Fold"Change)∣≥1]的標準,篩選出HAES344澳洲堅果葉片黃化過程中與能量代謝相關的差異表達基因。
1.2.2""qRT-PCR分析""從能量代謝差異基因中選擇與光合作用相關的部分重要基因進行qRT-PCR分析。根據轉錄組測序結果中的轉錄本序列,應用Primer"Premier"6.0軟件設計引物,以澳洲堅果中的蘋果酸脫氫酶基因MDH為內參基因[26]。基因的引物序列委托南京集思慧遠生物科技有限公司合成(表1)。
應用多糖多酚植物總RNA試劑盒(DP441,北京天根生化科技有限公司)提取葉片樣品的RNA,經檢測RNA質量后,使用Hifair?Ⅲ"1st"Strand"cDNA"Synthesis"SuperMix"for"qPCR試劑盒(YEASEN,上海翌圣生物科技股份有限公司)反轉錄合成第1鏈cDNA,再采用Genious"2×"SYBR"Green"Fast"qPCR"Mix試劑盒(ABclonal,武漢愛博泰克生物科技有限公司)對目標基因進行qRT-PCR檢測。PCR反應體系(20"μL)為:1.0"μL"cDNA,1.0"μL正向引物,1.0"μL反向引物,10"μL"SYBR"Premix"Ex"Taq,7.0"μL"ddH2O。測定儀器為BIOER實時熒光定量PCR儀(FQD-96A),反應程序(兩步法)為:95"℃"5"min,95"℃"10"s,60"℃"30"s,40個循環。試驗設置3個生物學重復,每個樣品重復3次;用2-??CT法計算基因的相對表達量。
1.3""數據處理
所有的試驗數據均是3個獨立生物學重復的平均值,利用SPSS"16.0統計軟件對數據進行One-"Way"ANOVA(LSD測驗)檢驗,Plt;0.05表示顯著性差異。應用GraphPad"Prism"8.0軟件制圖。
2""結果與分析
2.1""能量代謝相關基因的鑒定
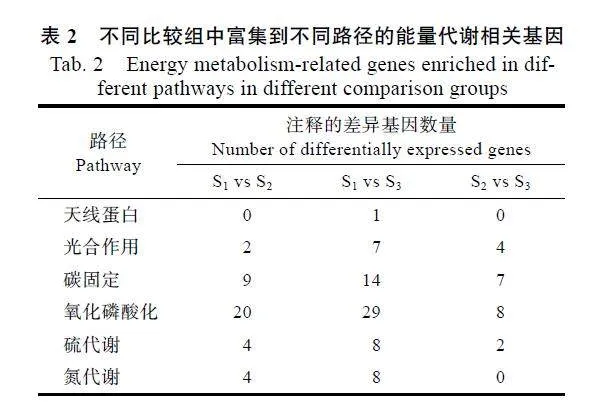
基于前期獲得的HAES344澳洲堅果不同黃化時期(S1、S2和S3)葉片轉錄組數據[25],根據KEGG的注釋結果,鑒定出96個與能量代謝途徑相關的差異基因。如圖2A所示,S1"vs"S2、S1"vs"S3和S2"vs"S3比較組分別有6、17和14個上調基因以及33、46和6個下調基因。韋恩圖分析表明,僅有2個差異基因共同存在于S1"vs"S2、S1"vs"S3和S2"vs"S3比較組中,但S1"vs"S2和S1"vs"S3共同包含的差異基因最多,達到18個(圖2B)。
KEGG富集分析表明,S1"vs"S2、S1"vs"S3和S2"vs"S3分別有20、29和8個差異基因注釋到氧化磷酸化路徑,是基因數量富集最多的路徑;其次是碳固定路徑,3個比較組中分別有9、14和7個差異基因得到注釋,但注釋到天線蛋白的差異基因最少,僅在S1"vs"S3中發現有1個基因被注釋(表2)。
2.2""光合能量代謝相關基因的表達分析
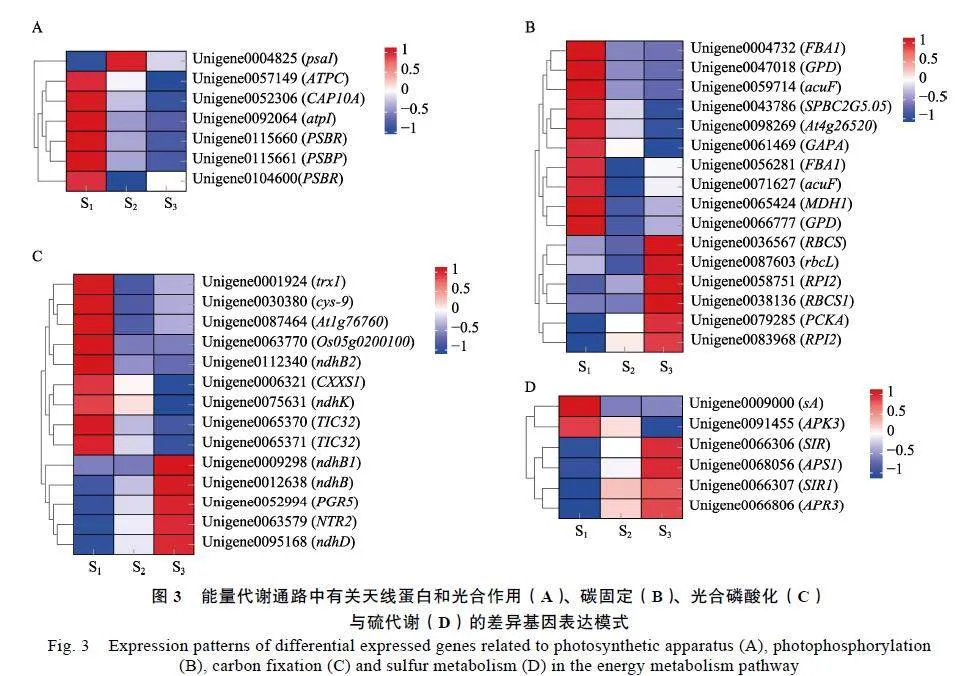
篩除低表達豐度的基因(RPKMlt;0.5)后,共獲得1個天線蛋白基因CAP10A和6個光合作用相關基因(圖3A)以及16個碳固定相關基因(圖3B)、14個光合磷酸化相關基因(圖3C)與6個硫代謝相關基因(圖3D),這些基因在HAES344澳洲堅果葉片黃化過程中具有不同的表達趨勢。
與正常綠葉(S1)相比,在天線蛋白與光合作用途徑中,除PSⅠ相關基因psaI在黃化葉片S2中顯著上調表達外,其余6個基因則在黃化葉片(S2、S3)中顯著下調表達,包括2個ATPase相關基因(ATPC與atpI)和4個PSⅡ復合體組成蛋白相關基因(CAP10A、PSBP和2個PSBR)(圖3A);在碳固定途徑中,包括3個FBA編碼基因(2個FBA1和At4g26520)、3個GAPDH編碼基因(GAPA和2個GPD)等在內的10個基因在黃化葉片中顯著下調表達,而另外的6個基因的表達則相反,其中包括2個RPI編碼基因(RPI2)和3個Rubisco相關基因(rbcL、RBCS和RBCS1)(圖3B);在光合磷酸化途徑中,包括4個Trx編碼基因(Trx1、CXXS1、Os05g0200100、Atlg76760)、2個NADH-質體醌氧化還原酶相關基因(ndhK與ndhB2)和2個LFNR跨膜轉運相關基因(TIC32)等在內的9個基因均在黃化葉片中發生下調表達,而包括Trx還原酶編碼基因NTR2、PGR5蛋白編碼基因PGR5、NADH脫氫酶(NDH)相關基因ndhB等在內的5個基因的表達則相反(圖3C);對于硫代謝相關基因,包括亞硫酸還原酶(SIR)編碼基因(SIR和SIR1)、5'-腺苷酰硫酸還原酶(APR)基因APR3等在內的4個基因均在黃化葉片中明顯上調表達,其余2個基因的表達則相反(圖3D)。這一結果顯示,上述基因的顯著上調或下調表達可能在HAES344澳洲堅果葉片黃化過程中對光合能量代謝具有正調控或負調控作用。
2.3""光合能量代謝相關基因的qRT-PCR分析
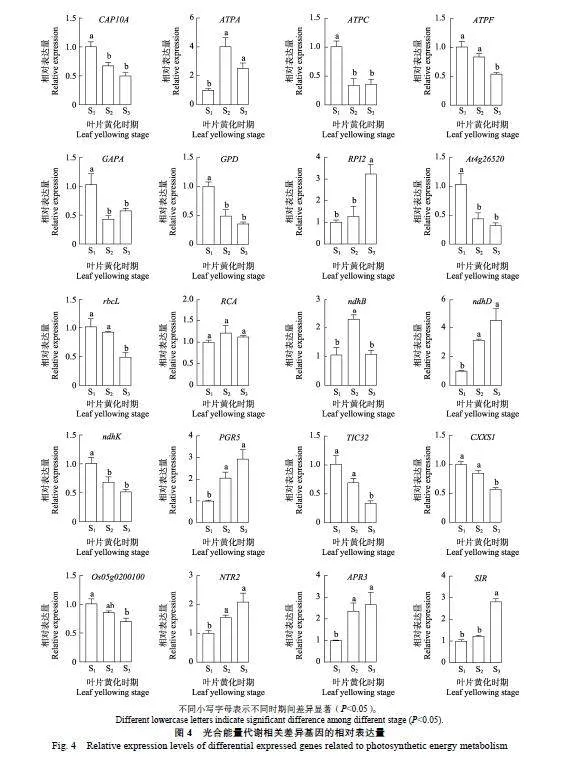
對20個重要的光合能量代謝相關基因進行qRT-PCR分析發現,CAP10A、ATPC、ATPF、rbcL、GAPA、GPD、At4g26520、ndhK、TIC32、CXXS1和Os05g0200100的相對表達量在葉片黃化過程中逐漸降低。其中,CAP10A、ATPC、GAPA、GPD、At4g26520和ndhK在S1時期的相對表達量均顯著高于S2和S3,但其在S2與S3之間的表達量差異均不顯著;ATPF、rbcL、TIC32和CXXS1在S3時期的相對表達量均顯著低于S1和S2,而其在S1與S2之間的表達量差異均不顯著;Os05g0200100在S1時期的相對表達量顯著高于S3,但其在S1與S2之間以及S2與S3之間的表達量差異均不顯著(圖4)。
在葉片黃化期間,RPI2、ndhD、PGR5、NTR2、APR3和SIR的相對表達量逐漸升高。其中,ndhD、PGR5、NTR2和APR3在S1時期的相對表達量均顯著低于S2和S3,但其在S2與S3之間的表達量差異均不顯著;RPI2和SIR在S3時期的相對表達量均顯著高于S1和S2,而其在S1與S2之間的表達量差異均不顯著。另外,ATPA和ndhB的相對不同小寫字母表示不同時期間差異顯著(Plt;0.05)。
表達量均呈現先升后降的變化趨勢,RCA的表達變化則相對平穩。其中,ATPA在S2和S3時期的相對表達量均顯著高于S1,但其在S2與S3之間差異不明顯;ndhB在S2時期的相對表達量均顯著高于S1和S3,但其在S1與S3之間差異不顯著(圖4)。
3""討論
在本研究中,基于KEGG注釋和富集分析,從鑒定出的96個與能量代謝途徑相關的差異基因中篩選到了43個參與光合能量代謝的功能基因,發現有27個基因在HAES344澳洲堅果黃化葉片中下調表達,其余16個基因則在黃化葉片中上調表達,說明這些基因對黃化葉片的光合能量代謝發揮了重要作用。進一步選取20個關鍵的光合能量代謝相關基因進行實時熒光定量PCR分析發現,大部分基因的相對表達量變化與轉錄組中基因的RPKM值變化趨勢基本一致,進一步表明本研究挑選的20個關鍵基因極可能參與了光合能量代謝。
3.1""PSⅡ結構與功能
夏季高溫常導致HAES344澳洲堅果新梢葉片變黃,這與ROS積累引起的葉綠素降解和PSⅡ損傷密切相關[2]。葉綠素作為光合作用的決定性因素,影響著光合同化產物的形成[27]。植物在進行光合作用時,葉綠素只有與葉綠素a/b結合蛋白結合形成色素蛋白復合體后才能行使其吸收與傳遞光能以及參與光化學反應的功能。CP24是PSⅡ捕光天線中的一種外周捕光天線蛋白,在傳遞光能、維持PSII及類囊體膜結構、耗散過量激發能方面起著重要作用[28]。賈兵等[6]認為,增強碭山酥梨黃化葉片中葉綠素a/b結合蛋白編碼基因Chl"a-b"P4/CP24/29.1的表達量可提升類囊體膜中電子及質子的轉移能力。KOVáCS等[29]證實,CP24蛋白與ROS的清除有關,在敲除其編碼基因的擬南芥植株中ROS的積累明顯較野生型更高。本研究中,編碼CP24的CAP10A在澳洲堅果葉片黃化期間顯著下調表達,可能是由于澳洲堅果黃化葉片中ROS過量累積所引起的CP24蛋白降解所致,進而影響光能的吸收與傳遞。另外,PSBP和PSBR也在黃化葉片中顯著下調表達,意味著PSⅡ復合體的結構完整性和驅動電子傳遞反應功能可能遭到破壞[30]。
3.2""葉綠體ATP合成
碳同化是葉綠體利用光反應中形成的同化力(ATP和NADPH)將CO2轉化為穩定碳水化合物的過程。其中,ATP是由ATPase催化光合磷酸化反應而產生。高溫下編碼葉綠體ATPase中CF1蛋白α亞基的ATPA和γ亞基的ATPC1在白楊葉片中顯著上調表達,促進ATP的合成以用于PSⅡ修復[31],但在遭受熱脅迫的黃瓜葉片中ATPA明顯下調表達[18]。本研究中,ATPC和編碼CF0蛋白a亞基的ATPF均在HAES344澳洲堅果黃化葉片中顯著下調表達,表明ATPase的CF1及CF0蛋白含量明顯減少,可能使得CF0與CF1的結合更松散,導致CF1脫離CF0,進而造成ATPase喪失ATP合成功能而表現出ATP酶水解ATP的活性[30]。因此,ATPA在黃化葉片中表現為顯著上調表達,說明ATPase水解ATP的能力增強,可能是通過釋放能量來提高黃化葉片應對ROS過量積累的一種防衛反應[32]。
3.3""環式電子傳遞
電子傳遞鏈是光合作用形成同化力的核心環節。在高等植物的葉綠體中,NADPH是在光合線性電子傳遞的最后一步反應中通過LFNR催化還原NADP+而成。楊超等[33]認為,位于葉綠體內膜上的易位子TIC參與了將LFNR前體蛋白從細胞質基質中轉運至葉綠體的定位過程。TIC32屬于TIC復合體的亞基,介導了質體蛋白這一轉運過程[34]。本研究發現,TIC32在黃化葉片中顯著下調表達,意味著LFNR的跨膜轉運可能發生減弱,進而限制了線性電子傳遞,降低了葉綠體基質中NADPH的生成能力。環式電子傳遞是葉綠體中ATP合成的一個重要替代路徑,存在PGRL1/PGR5介導途徑與NAD(P)H脫氫酶(NDH)復合體介導途徑,對植物正常生長發育和抵御逆境具有重要作用[35]。DALCORSO等[36]認為,PGRL1/PGR5復合體可作為質子梯度調節蛋白參與高溫條件下線性電子流到環式電子流的轉換,對誘導熱耗散和保護PSⅡ免遭光抑制是必需的。NDH介導的環式電子傳遞能夠緩解葉綠體基質過度還原,維持電子傳遞鏈氧化還原系統的平衡,驅動ATP合成[35]。敲除編碼NDH基因的煙草對高溫脅迫敏感[37]。本研究中,PGR5、ndhB和ndhD在黃化葉片中顯著上調表達,意味著黃化葉片能通過增強環式電子流來生成ATP和耗散過剩熱量,用以修復或減輕氧化脅迫對光系統造成的損傷。然而,ndhK和ndhB2在黃化葉片中顯著下調表達,說明黃化葉片中構成NDH復合體的亞基含量明顯減少,暗示了整個NDH復合體的穩定性可能受到影響[35]。
3.4""葉綠體氧化還原狀態
硫氧還蛋白(Trx)是一類小分子蛋白,不僅直接參與ROS的清除,還能通過改變其氧化還原狀態來調節光合電子傳遞速率[22]。KANG等[23]認為,在Trx系統中,氧化態的Trx和Trx類蛋白可被NTR還原,用以維持葉綠體的氧化還原平衡。本研究表明,編碼Trx的Trx1和Os05g0200100以及編碼Trx類蛋白的CXXS1均在黃化葉片中顯著下調表達,意味著Trx的功能可能受到抑制,導致黃化葉片細胞內的氧化還原狀態失衡,進而影響了光合電子傳遞;然而,NTR2顯著上調表達,表明黃化葉片可能發生了氧化應激,通過將Trx從氧化態轉化為還原態,提高其清除ROS的能力,以緩解氧化脅迫。硫代謝在植物體的生長發育中起著至關重要的作用,SIR和APR可充當電子供體來還原Trx[38]。在黃化葉片中,SIR和APR3的相對表達量顯著增加,說明更多的Trx可能得到還原,用以維持光合電子傳遞和抵抗氧化脅迫。
3.5""碳同化能力
在光合碳同化過程中,Rubisco是最重要的限速酶,但Rubisco活性受到RCA的調控[4]。紫花苜蓿葉片中編碼Rubisco大亞基的rbcL在干熱脅迫下呈現出先顯著增加、后持續降低的表達變化趨勢[9],干旱脅迫下rbcL的下調表達導致冬油菜葉片光合作用的下降[8]。PERDOMO等[5]認為,高溫脅迫下葉片中Rubisco活性的降低是因為RCA活性受到高溫抑制而造成活化的Rubisco數量減少所致。本研究發現,rbcL在重度黃化葉片中顯著下調表達,表明Rubisco的大亞基發生了降解,可能是黃化葉片中ROS引起的酶促或非酶促裂解所致[7]。然而,RCA的表達在葉片黃化過程中未發生顯著性變化,意味著RCA可能發生了熱聚合,使得RCA從可溶性組分向不溶性組分轉移,導致RCA含量變化不明顯[39]。另外,卡爾文循環的運轉速率與GAPDH、FBA、RPI等酶的活性水平關系密切[10-12]。GAPDH是催化光合最初產物1,3-二磷酸甘油酸還原為3-磷酸甘油醛的關鍵調節酶,其活性的高低會影響光合速率及光合產物的積累。葉綠體GAPDH上調表達及其編碼的酶活性提高,有利于增強光合代謝在逆境下的抗性[13]。本研究結果表明,編碼GAPDH的GAPA和GPD在黃化葉片中顯著下調表達,說明黃化葉片的光合能力下降,也意味著GAPDH的活性變化可能與葉綠體所遭受的氧化還原失衡有關[23]。FBA所催化的反應位于RuBP再生階段,在很大程度上控制碳的固定和流量。本研究中,編碼FBA的At4g2652也在黃化葉片中顯著下調表達,意味著RuBP的再生能力減弱,與HAAKE等[11]發現馬鈴薯葉中因FBA表達減弱而引起光合作用顯著降低的結果較一致。然而,編碼核糖-"5-磷酸異構酶的RPI2在重度葉片黃化中顯著上調表達,可能是黃化葉片對高溫環境的應激響應所致。
4""結論
本研究基于轉錄組數據分析,確定了43個光合能量代謝相關基因在HAES344澳洲堅果夏梢葉片自然黃化過程的表達模式;通過qRT-PCR分析發現,CAP10A、ATPC、ATPF、GAPA、GPD、At4g2652與rbcL等基因在黃化葉片中顯著下調表達,可能導致了PSⅡ捕獲天線蛋白降解、葉綠體ATP合成功能減弱和碳同化能力下降,而PGR5、ndhB、ndhD、NTR2、SIR和APR3等基因顯著上調表達以及TIC32、Os05g0200100、CXXS1等基因顯著下調表達,可能造成葉綠體內氧化還原狀態失衡,并激發環式電子流,用以減輕氧化脅迫對光合能量機構的損傷。本研究為深入探討澳洲堅果葉片黃化機制提供參考依據。
參考文獻
[1]"楊為海,"曾利珍,"曾輝,"萬繼鋒,"陳倪,"鄒明宏,"陸超忠,"張漢周,"羅煉芳,"朱文華."澳洲堅果種質資源葉片形態性狀觀測分析[J]."熱帶作物學報,"2020,"41(1):"69-76."YANG"W"H,"ZENG"L"Z,"ZENG"H,"WAN"J"F,"CHEN"N,"ZOU"M"H,"LU"C"Z,"ZHANG"H"Z,"LUO"L"F,"ZHU"W"H."Investigation"and"analysis"on"leaf"morphological"characters"of"macadamia"germplasm"resources[J]."Chinese"Journal"of"Tropical"Crops,"2020,"41(1):"69-76."(in"Chinese)
- 楊為海,"曾輝,"萬繼鋒,"張漢周,"陸超忠."高溫條件下澳洲堅果葉片黃化的生理特性[J]."熱帶作物學報,"2021,"42(3):"830-838.YANG"W"H,"ZENG"H,"WAN"J"F,"ZHANG"H"Z,"LU"C"Z."Preliminary"study"on"physiological"characteristics"of"macadamia"leaf"etiolation"under"high"temperature[J]."Chinese"Journal"of"Tropical"Crops,"2021,"42(3):"830-838."(in"Chinese)
- 唐婷,"鄭國偉,"李唯奇."植物光合系統對高溫脅迫的響應機制[J]."中國生物化學與分子生物學報,"2012,"28(2):"127-132.TANG"T,"ZHENG"G"W,"LI"W"Q."Defense"mechanisms"of"plants"photosystem"to"heat"stress[J]."Chinese"Journal"of"Biochemistry"and"Molecular"Biology,"2012,"28(2):"127-132."(in"Chinese)
- PORTIS"J"A"R."Rubisco"activase-rubisco’s"catalytic"chaperone[J]."Photosynthesis"Research,"2003,"75:"11-27.
- PERDOMO"J"A,"CAPó-BAUCà"S,"CARMO-SILVA"E,"GALMéS"J."Rubisco"and"rubisco"activase"play"an"important"role"in"the"biochemical"limitations"of"photosynthesis"in"rice,"wheat,"and"maize"under"high"temperature"and"water"deficit[J]."Frontiers"in"Plant"Science,"2017,"8:"490."
- 賈兵,"董煒昱,"郭國凌,"張舒琴,"陳猛,"許波,"衡偉."外源Fe2+對梨黃化葉光合能力及糖合成代謝的影響[J]."果樹學報,"2022,"39(1):"25-35.JIA"B,"DONG"W"Y,"GUO"G"L,"ZHANG"S"Q,"CHEN"M,"XU"B,"HENG"W."Effects"of"ferrous"sulfate"applied"by"foliar"spray"on"photosynthesis"and"photoproducts"metabolism"of"the"chlorotic"pear"leaves"(Pyrus"bretschneideri"‘DangshanSuli’)[J]."Journal"of"Fruit"Science,"2022,"39(1):"25-35."(in"Chinese)
- 劉擁海,"彭新湘,"李明啟."水稻葉片中過氧化氫與核酮糖-1,5-二磷酸羧化酶/加氧酶降解的關系[J]."植物生理學報,"2000,"26(6):"481-486."LIU"Y"H,"PENG"X"X,"LI"M"Q."Degradation"of"ribulose-1,5-bisphosphate"carboxylase/oxygenase"in"rice"leaves"under"oxidative"stress"induced"by"methyl"viologen[J]."Acta"Phytophysiologica"Sinica,"2000,"26(6):"481-486."(in"Chinese)
- 米超,"趙艷寧,"劉自剛,"陳其鮮,"孫萬倉,"方彥,"李學才,"武軍艷."白菜型冬油菜"RuBisCo"蛋白亞基基因rbcL和rbcS的克隆及其在干旱脅迫下的表達[J]."作物學報,"2018,"44(12):"1882-1890.MI"C,"ZHAO"Y"N,"LIU"Z"G,"CHEN"Q"X,"SUN"W"C,"FANG"Y,"LI"X"C,"WU"J"Y."Cloning"of"RuBisCo"subunits"genes"rbcL"and"rbcS"from"winter"rapeseed"(Brassica"rapa)"and"their"expression"under"drought"stress[J]."Acta"Agronomica"Sinica,"2018,"44(12):"1882-1890."(in"Chinese)
- 許超,"何承剛,"牟蘭,"畢玉芬,"姜華."干熱脅迫下紫花苜蓿Rubisco羧化酶和活化酶活性變化及其基因表達的研究[J]."草地學報,"2021,"29(2):"228-293."XU"C,"HE"C"G,"MU"L,"BI"Y"F,"JIANG"H."The"activities"of"rubisco"carboxylase"and"activase"and"their"gene"expressions"in"alfalfa"under"drought"and"heat"stresses[J]."Acta"Agrestia"Sinica,"2021,"29(2):"228-293."(in"Chinese)
- 張愛軍,"商振清,"董永華,"李廣敏,"張曉紅."6-BA和KT對干旱條件下小麥旗葉甘油醛-3-磷酸脫氫酶及光合作用的影響[J]."河北農業大學學報,"2000,"32(2):"37-41."ZHANG"A"J,"SHANG"Z"Q,"DONG"Y"H,"LI"G"M,"ZHANG"X"H."Effect"of"6-BA"and"KT"on"glyceraldehy-3-phospate"dehydrogenase"activity"and"phytosynthesis"in"wheat"flag"leaves"under"soil"drought[J]."Journal"of"Agricultural"University"of"Hebei,"2000,"32(2):"37-41."(in"Chinese)
- HAAKE"V,"ZRENNER"R,"SONNEWALD"U,"STITT"M."Amoderate"decrease"of"plastid"aldolase"activity"inhibits"photosynthesis,"alters"the"levels"of"sugars"and"starch,"and"inhibits"growth"of"potato"plants[J]."The"Plant"Journal,"1998,"14(2):"147-157.
- 巴桑玉珍,"扎桑,"王玉林,"徐齊君,"原紅軍,"尼瑪扎西."青稞新光合作用相關基因的克隆和序列分析[J]."大麥與谷類科學,"2017,"34(6):"1-7."BASANG"YUZHEN,"ZASANG,"WANG"Y"L,"XU"Q"J,"YUAN"H"J,"NYIMA"TASHI."Cloning"and"sequence"analysis"of"photosynthesis-related"genes"in"Tibetan"hulless"barley"(Hordeum"vulgare"L."var."Nudum"HK."f.)[J]."Barley"and"Cereal"Sciences,"2017,"34(6):"1-7."(in"Chinese)
- 吳巧玉,"何天久."五種相關光合蛋白基因在馬鈴薯野生種冷馴化中的表達分析[J]."種子,"2021,"40(12):"56-60.WU"Q"Y,"HE"T"J."Expression"analysis"of"five"photosynthesis-related"protein"genes"in"cold"acclimation"of"wild"potato"varieties[J]."Seed,"2021,"40(12):"56-60."(in"Chinese)
- MICHELIS"R,"GEPSTEIN"S."Identification"and"characterization"of"a"heat"induced"isoform"of"aldolase"in"oat"chloroplast[J]."Plant"Molecular"Biology,"2000,"44:"487-498.
- LI"H,"AHAMMED"G"J,"ZHOU"G"N,"XIA"X"J,"ZHOU"J,"SHI"K,"YU"J"Q,"ZHOU"Y"H."Unraveling"main"limiting"sites"of"photosynthesis"under"below-"and"above-ground"heat"stress"in"cucumber"and"the"alleviatory"role"of"luffa"rootstock[J]."Frontiers"in"Plant"Science,"2016,"7:"746.
- CHOUDHURY"F"K,"RIVERO"R"M,"BLUMWALD"E,"MITTLER"R."Reactive"oxygennbsp;species,"abiotic"stress"and"stress"combination[J]."The"Plant"Journal,"2017,"90:"856-867.
- 莫億偉,"郭振飛."溫度脅迫對苜蓿和柱花草光合作用及N同化的影響[J]."草地學報,"2008,"16(1):"100-102."MO"Y"W,"GUO"Z"F."The"Effects"of"temperature"stress"on"photosynthesis"and"nitrogen"reduction"of"alfalfa"and"Guyana"stylosanthes[J]."Acta"Agrestia"Sinica,"2008,"16(1):"100-102."(in"Chinese)
- WANG"L,"ZHOU"H,"GUO"S,"AN"Y,"SHU"S,"LU"N,"SUN"J."Exogenous"spermidine"maintains"the"chloroplast"structure"of"cucumber"seedlings"and"inhibits"the"degradation"of"photosynthetic"protein"complexes"under"high-temperature"stress[J]."Acta"Physiologiae"Plantarum,"2018,"40(3):1-15.
- ZHANG"R,"SHARKEY"T"D."Photosynthetic"electron"transport"and"proton"flux"under"moderate"heatstress[J]."Photosynthesis"Research,"2009,"100:"29-43.
- HUANG"W,"ZHANG"S"B,"CAO"K"F."Cyclic"electron"flow"plays"an"important"role"in"photoprotection"of"tropical"trees"illuminated"at"temporal"chilling"temperature[J]."Plant"Cell"Physiology,"2011,"52:"297-305.
- YAMORI"W,"SHIKANAI"T."Physiological"functions"of"cyclic"electron"transport"around"photosystem"Ⅰ"in"sustaining"photosynthesis"and"plant"growth[J]."Annual"Review"of"Plant"Biology,"2016,"67(1):"81-106.
- DIETZ"K"J,"PFANNSCHMIDT"T."Novel"regulators"in"photosynthetic"redox"control"of"plant"metabolism"and"gene"expression[J]."Plant"Physiology,"2011,"155(4):1477-1485.
- KANG"Z,"QIN"T,"ZHAO"Z."Thioredoxins"and"thioredoxin"reductase"in"chloroplasts:"a"review[J]."Gene,"2019,"706:"32-42."
- OKEGAWA"Y."Characterization"of"factors"affecting"the"activity"of"photosystem"I"cyclic"electron"transport"in"chloroplasts[J]."Plant"amp;"Cell"Physiology,"2008,"49(5):"825-834.
- YANG"W"H,"XU"H"Y,"XIAO"Q"S,"LI"X"P,"SHAO"Q."Combined"analysis"of"metabolome"and"transcriptome"provides"insights"into"metabolisms"of"chlorophylls,"carotenoids,"and"flavonoids"in"the"yellowing"leaves"of"‘HAES344’"macadamia[J]."Scientia"Horticulturae,"2023,"308:"111600.
- 楊倩,"楊子平,"周婭麗,"陳東泉,"劉恒."澳洲堅果實時熒光定量"PCR"分析中內參基因的篩選[J]."熱帶作物學報,"2020,"41(8):"1505-1512."YANG"Q,"YANG"Z"P,"ZHOU"Y"L,"CHEN"D"Q,"LIU"H."Screening"of"stable"reference"genes"for"qRT-PCR"analysis"in"Macadamia"integrifolia[J]."Chinese"Journal"of"Tropical"Crops,"2020,"41(8):"1505-1512."(in"Chinese)
- LI"J,"CAO"X"M,"JIA"X"C,"LIU"L"Y,"CAO"H"W,"QIN"W"Q,"LI"M."Iron"deficiency"leads"to"chlorosis"through"impacting"chlorophyll"synthesis"and"nitrogen"metabolism"in"Areca"catechu"L.[J]."Frontiers"in"Plant"Science,"2021,"12:"710093."
- 李韻佳."低溫脅迫下三倍體枇杷微量捕光天線蛋白基因EjLhcb4.1/5/6的功能分析[D]."重慶:"西南大學,"2021.LI"Y"J."Functional"characterization"of"light"harvesting"chlorophyll"a/b"binding"antenna"proteins"EjLhcb4.1/5/6"genes"in"triploid"loquat"(Eriobotrya"japonica)"under"cold"stress[D]."Chongqing:"Southwest"University,"2021."(in"Chinese)
- KOVáCS"L,"DAMKJ?R"J,"KERE?CHE"S,"LLIOAIA"C,"RUBAN"A"V,"BOEKEMA"E"J,"JANSSON"S,"HORTON"P."Lack"of"the"light"harvesting"complex"CP24"affects"the"structure"and"function"of"the"grana"membranes"of"higher"plant"chloroplasts[J]."The"Plant"Cell,"2006,"18(11):"3106-3120.
- 武維華."植物生理學[M]."3版."北京:"科學出版社,"2018:"122-130.WU"W"H."Plant"physiology[M]."3rd"ed."Beijing:"Science"Press,"2018:"129-130."(in"Chinese)
- SONG"Y"P,"CHEN"Q"Q,"CI"D,"SHAO"X"N,"ZHANG"D"Q."Effects"of"high"temperature"on"photosynthesis"and"related"gene"expression"in"poplar[J]."BMC"Plant"Biology,"2014,"14:"111.
- 蔡智博."擬南芥atpA基因調控植物響應低溫脅迫的分子機制研究[D]."哈爾濱:"東北農業大學,"2020.CAI"Z"B."Studies"on"molecular"mechanism"of"atpA"gene"regulating"plants"response"to"low"temperature"stress"in"Arabidopsis[D]."Harbin:"Northeast"Agricultural"University,"2020."(in"Chinese)
- 楊超,"胡紅濤,"吳平,"莫肖蓉."高等植物鐵氧還蛋白-"NADP+氧化還原酶研究進展[J]."植物生理學報,"2014,"50"(9):"1353-1366."YANG"C,"HU"H"T,"WU"P,"MO"X"R."Advances"in"the"research"of"ferredoxin-NADP+"oxidoreductase"in"higher"plants[J]."Plant"Physiology"Journal,"2014,"50(9):"1353-1366."(in"Chinese)
- ARONSSON"H,"JARVIS"P."The"chloroplast"protein"import"apparatus,"its"components,"and"their"roles[C]//SANDELIUS"A"S,"ARONSSON"H."Plant"cell"monographs,"Vol."13:"the"chloroplast-interactions"with"the"environment."Heidelberg:"Springer-Verlag,"2009:"100-102.
- 劉玉鳳,"王珍琪,"鹿嘉智,"張耀豐,"劉翰林,"王峰,"齊明芳,"李天來."葉綠體NAD(P)H脫氫酶復合體調控光合作用的研究進展[J]."植物生理學報,"2019,"55(7):"932-940."LIU"Y"F,"WANG"Z"Q,"LU"J"Z,"ZHANG"Y"F,"LIU"H"L,"WANG"F,"QI"M"F,"LI"T"L."Regulation"of"chloroplast"NAD(P)H"dehydrogenase"complex"in"photosynthesis[J]."Plant"Physiology"Journal,"2019,"55(7):"932-940."(in"Chinese)
- DALCORSO"G,"PESARESI"P,"MASIERO"S,"ASEEVA"E,"SCHüNEMANN"D,"FINAZZI"G,"JOLIOT"P,"BARBATO"R,"LEISTER"D."A"complex"containing"PGRL1"and"PGR5"is"involved"in"the"switch"between"linear"and"cyclic"electron"flow"in"Arabidopsis[J]."Cell,"2008,"132(2):"273-285."
- PENG"W,"WEI"D,"TAKABAYASHI"A,"ENDO"T,"SHIKANAI"T,"YE"J"Y,"MI"H"L."Chloroplastic"NAD(P)H"dehydrogenase"in"tobacco"leaves"functions"in"alleviation"of"oxidative"damage"caused"by"temperature"Stress[J]."Plant"Physiology,"2006,"141(2):"465-474.
- KIM"S"K,"RAHMAN"A,"MASON"J"T,"HIRASAWA"M,"CONOVER"R"C,"JOHNSON"M"K,"MIGINIAC-MASLOW"M,"KERYER"E,"KNAFF"D"B,"LEUSTEK"T."The"interaction"of"5′-adenylylsulfate"reductase"from"Pseudomon"asaeruginosa"with"its"substrates[J]."Biochimica"et"Biophysica"Acta,"2005,"1710:"103-112."
- 陳候鳴,"陳躍,"王盾,"蔣德安."核酮糖-1,5-二磷酸羧化酶/加氧酶活化酶在植物抗逆性中的作用[J]."植物生理學報,"2016,"52(11):"1637-1648.CHEN"H"M,"CHEN"Y,"WANG"D,"JIANG"D"A."The"role"of"ribulose-1,5-bisphosphate"carboxylase/oxygenase"activase"in"resistance"of"plant"to"abiotic"stresses[J]."Plant"Physiology"Journal,"2016,"52"(11):"1637-1648."(in"Chinese)

