miR-30a 在胃腸道間質瘤中的表達及其調控細胞增殖、侵襲和凋亡的機制
任 華 馬 明 王 超 王昭君
1.山西省大同市第五人民醫院普外科,山西大同 037000;2.山西醫科大學生理學系,山西晉中 030600
胃腸道間質瘤(gastrointestinal stromal tumor,GIST)是最普遍的肉瘤類型,約占全部胃腸道腫瘤的0.2%,多發于50 歲以上人群[1]。資料顯示,GIST 的發生率在不同地區和人群中有所差異,以中國、韓國及挪威發病率最高[2-3]。GIST 可并發嘔吐、消化道出血等癥,嚴重時可誘發消化道梗阻及穿孔,導致嚴重腹部疼痛及感染,危及生命健康。現階段,GIST 治療方式主要包括手術切除和靶向藥物治療,其中伊馬替尼是目前不可切除性原發性及轉移復發性GIST 的一線治療藥物,但并非所有患者均對其敏感,且部分患者存在耐藥問題,導致預后不甚理想[4-5]。尋找新的治療策略是目前GIST 領域的重要課題。微RNA-30(microRNA-30,miR-30)a 是廣泛表達于人體各種組織中的一種miRNA,在多種腫瘤中發揮抑制或促進的作用[6-8]。miR-30 家族中的其他成員也在GIST 中發揮著重要的調節作用,如miR-30c 可以通過靶向基因來抑制GIST 細胞的增殖和遷移,表明miR-30 家族是在GIST 發展和治療中具有潛在價值的生物標志物和藥物靶點[9]。然而,目前關于其在GIST 中的作用及相關機制報道尚少。研究miR-30a 在GIST 中的作用和機制,有助于揭示GIST 的發病機制,尋找新的治療靶點和策略。本研究采用脂質體轉染法轉染miR-30a 基因過表達質粒、沉默質粒至GIST-T1 細胞中,檢測細胞行為學變化,并分析可能機制。
1 資料與方法
1.1 一般資料
選取2021 年11 月至2022 年11 月在山西省大同市第五人民醫院進行手術切除治療的GIST 患者30 例,男19 例,女11 例;年齡51~72 歲,平均(65.61±9.53)歲。所選受試者均通過病理學檢查證實為GIST,排除術前放化療或藥物治療者。選取患者手術切除的正常組織(距離GIST 組織邊緣>5 cm)作為對照,經手術切除的GIST 組織、正常組織均投入液氮保存。本研究經山西省大同市第五人民醫院倫理委員會批準(2021-030),患者或家屬對研究內容知情同意。
1.2 細胞株
人GIST-T1 細胞株購自美國Sigma-Aldrich 公司。
1.3 藥物、主要試劑、儀器
miR-30a NC、mimics、inhibitor 質粒,大連華醫基因生物技術有限公司構建;LipofectamineTM3000 試劑盒(貨號:R0084-100ML,常州三友生物工程有限公司);雙螢光素酶檢測試劑盒、實時熒光定量聚合酶鏈反應(real-time quantitative polymerase chain reaction,qRT-PCR)試劑盒(貨號:E1910、A5001,美國Promega公司);MTT 試劑盒、細胞凋亡檢測試劑盒、Annexin V-FITC 液(貨號:M6494、A35109、A13199,美國Thermo Fisher Scientific 公司);二甲基亞砜(dimethyl sulfoxide,DMSO)(貨號:A120227,長春新興藥業集團有限責任公司);兔抗人轉化生長因子β1(transforming growth factor β1,TGF-β1)、Smad2、p-Smad2 一抗(貨號:ab92486、ab40855、ab53100,美國Abcam 公司)。Transwell 小室(美國康寧公司);SpectraMax 酶標儀(美國Molecular Devices 公司);Attunenxt 流式細胞儀(美國Thermo Fisher Scientific 公司)。
1.4 qRT-PCR 法檢測GIST 組織及正常組織中miR-30a 表達量
取液氮中保存組織,充分粉碎,提取總RNA,用瓊脂糖凝膠電泳或者比色分析等方法鑒定RNA 純度與完整性。將提取的總RNA 采用stem-loop 法逆轉錄成cDNA,逆轉錄溫度為16~18℃,時間30 min。設計miR-30a 和內參基因的qPCR 引物序列,miR-30a:正向為5’-GCGTCACGTGCCCGCGCATCCGAC-3’;反向為5’-GCGACTGTACGTGTCACCGACT-3’;U6:正向為5’-CTGCACGTGCTGCTCAA-3’;反向為5’-GAGGTAAC-GTGCAGTGTGTG-3’。用qRT-PCR 試劑盒,將cDNA 混合物進行熒光定量PCR 分析。通過qPCR數據分析軟件對實驗結果進行計算和比較,2-△△Ct法計算miR-30a 相對表達量。
1.5 細胞培養、轉染及分組
將GIST-T1 細胞株培養于含有10%胎牛血清、1%青鏈霉素的RPMI-1640 培養基中,標準條件下培養箱內常規培養,隔天換液,貼壁后胰酶消化傳代,對數期細胞用于后續實驗。調整細胞密度為1×106個/ml,接種于6 孔板,待細胞生長至貼壁,分別將miR-30a陰性對照質粒miR-30a NC、過表達量質粒miR-30a mimics、沉默質粒miR-30a inhibitor 轉染至GIST-T1細胞,分別設為miR-30a NC 組、miR-30a mimics 組、miR-30a inhibitor 組,另取對數期GIST-T1 細胞設為對照組,培養24 h 用于后續實驗。
1.6 qRT-PCR 檢測miR-30a 表達量
取各組細胞,操作同“1.4”。
1.7 MTT 法檢測增殖能力
取各組細胞,預冷PBS 漂洗、重懸,分別種植于96 孔板中,每孔5 000 個細胞,在完全培養液中培養24、48、72 h 后分別加入新制備的MTT 溶液(5.00 g/L,20 μl),孵育4 h,棄上清并加入150 μl DMSO,充分振蕩至甲瓚晶體溶解,檢測490 nm 波長處各組細胞增殖率,細胞增殖率=(實驗組吸光度值-空白組吸光度值)/(對照組吸光度值-空白組吸光度值)×100%,其中空白組為不含細胞和待測物質的培養基和MTT溶液。
1.8 Transwell 實驗檢測細胞侵襲能力
Matrigel 基質凝膠融化后涂抹至Transwell 小室,取各組細胞加入無血清培養液調節細胞密度至1×106個/ml,取200 μl 各組細胞懸液加入Transwell 小室上層,下層中加入完全培養液趨化,置于37℃、5%CO2標準環境恒溫培養箱中孵育24 h,用棉簽去除上層腔中未通過Matrigel 基底膜的細胞,用甲醇固定通過細胞,并用0.1%結晶紫染色,在顯微鏡下隨機選擇5 個不重復視野,計算侵襲染色細胞數/視野數。
1.9 流式細胞術檢測細胞凋亡率
取各組細胞,清洗、重懸,調整細胞密度為1×105個/ml 接種至6 孔板,加入完全培養液培養2 d,PBS 清洗兩次,低溫離心2 min(3 500 r/min,半徑為8 cm),吸棄上清,按照凋亡試劑盒說明書要求進行后續實驗過程,binding buffer 液重懸細胞,Annexin V-FITC 液染色后,再加入PI 液二次染色,遮光孵育15 min,流式細胞儀檢測細胞凋亡情況,計算各組凋亡率。
1.10 Western blot 法檢測細胞TGF-β1、Smad2、p-Smad2蛋白表達量
取各組細胞,充分裂解,低溫10 000 r/min 離心10 min,取上清并定量蛋白。取少量樣本蛋白,混合4倍量上樣緩沖液,水浴加熱變性蛋白,按照每孔20~30 μg 的量加載到凝膠槽中,加入預染色蛋白作為分子量標準,用恒壓電源進行電泳分離;將分離好的蛋白從凝膠轉移到聚氟乙烯膜上,用轉印儀或半干法進行轉印;將轉印好的膜用5%牛奶在室溫或4℃封閉1~2 h,防止非特異性結合;將封閉好的膜用含有適當稀釋比例的TGF-β1、Smad2、p-Smad2 一抗溶液在4℃過夜或室溫2 h 孵育,使一抗與目標蛋白結合;將孵育好的膜用含有Tween-20 的TBST 緩沖液洗滌3次,10 min/次,去除未結合的一抗;將洗滌好的膜用含有適當稀釋比例的熒光標記的二抗溶液在室溫1 h孵育,使二抗與一抗結合;洗滌:重復上述洗滌步驟,去除未結合的二抗;將洗滌好的膜用熒光成像儀進行掃描和分析,根據熒光信號的強度和分子量判斷目標蛋白的表達水平。
1.11 雙螢光素酶實驗驗證miR-30a 靶向基因
經TargetScan 預測,miR-30a 與TGF-β1 3’UTR存在結合位點,由百通生物科技(天津)有限責任公司鑒定。構建合成野生型TGF-β1 3’-UTR-WT 及突變型TGF-β1 3’-UTR-MUT 載體,與miR-30a 質粒(miR-30a mimics、miR-30a NC)共同轉染至293T 細胞,48 h后收集細胞,加入火鯊魚螢光素酶底物使報告基因發出熒光信號,記錄該酶的熒光強度,加入停止緩沖液,停止螢光素酶反應,加入Renilla 螢光素酶底物使內參基因產生螢光,記錄該酶的熒光強度。計算出對應的相對熒光單位。相對螢光素酶活性=火鯊魚螢光素酶活性/Renilla 螢光素酶活性。
1.12 統計學方法
采用SPSS 24.0 統計學軟件進行數據分析。計量資料采用均數±標準差(±s)表示,比較采用t 檢驗,多組間比較采用單因素方差分析,兩兩比較采用LSD-t 檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 GIST 組織及正常組織中miR-30a 表達量比較
與正常組織比較,GIST 組織中的miR-30a 表達量降低(P<0.05)。見表1。
表1 GIST 組織及正常組織中miR-30a 表達量比較(±s)
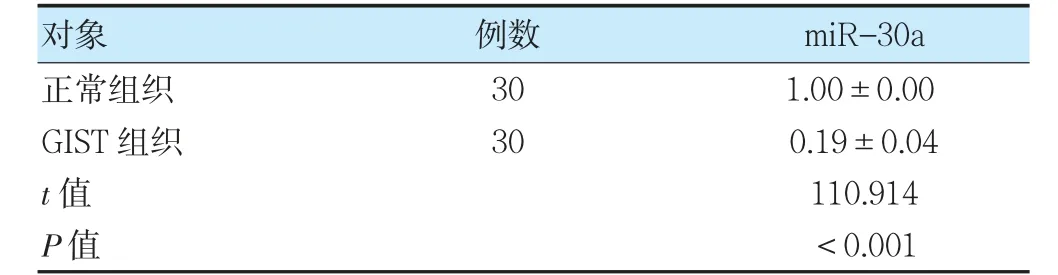
表1 GIST 組織及正常組織中miR-30a 表達量比較(±s)
注GIST:胃腸道間質瘤;miR-30a:微RNA-30a。
2.2 各組細胞miR-30a 表達量比較
miR-30a NC 組細胞miR-30a 表達量與對照組比較,差異無統計學意義(P>0.05)。與對照組比較,miR-30a mimics 組miR-30a 表達量升高,miR-30a inhibitor 組miR-30a 表達量降低(P<0.05)。見表2。
表2 各組細胞miR-30a 表達量比較(±s)

表2 各組細胞miR-30a 表達量比較(±s)
注 與對照組比較,aP<0.05。miR-30a:微RNA-30a。
2.3 各組細胞增殖能力比較
miR-30a NC 組24、48、72 h 細胞增殖率與對照組比較,差異無統計學意義(P>0.05);與對照組比較,miR-30a mimics 組24、48、72 h 細胞增殖率降低,miR-30a inhibitor 組24、48、72 h 細胞增殖率升高(P<0.05);與24 h 比較,miR-30a mimics 組、miR-30a inhibitor 組48、72 h 細胞增殖率升高(P<0.05);與48 h比較,miR-30a mimics組、miR-30a inhibitor 組72 h 細胞增殖率升高(P<0.05)。見表3。
表3 各組細胞培養24、48、72 h 后細胞增殖率比較(%,±s)
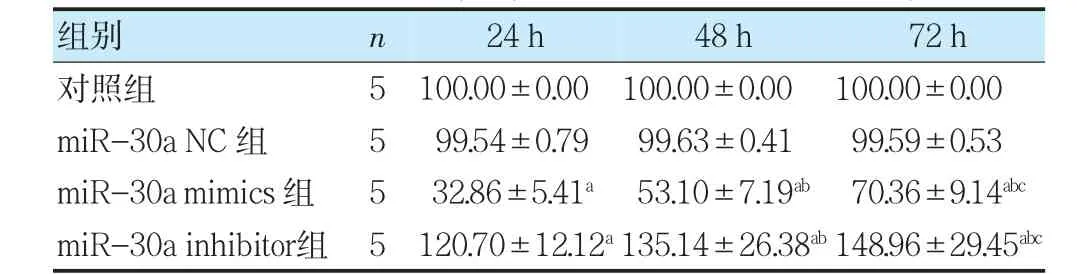
表3 各組細胞培養24、48、72 h 后細胞增殖率比較(%,±s)
注 與對照組同期比較,aP<0.05;與本組24 h 比較,bP<0.05;與本組48 h 比較,cP<0.05。
2.4 各組侵襲能力比較
對照組、miR-30a NC 組、miR-30a mimics 組、miR-30a inhibitor 組穿膜染色細胞數分別為(70.40±12.48)、(71.20±13.26)、(29.20±5.26)、(96.40±13.59)個/視野。miR-30a NC 組穿膜染色細胞數與對照組比較,差異無統計學意義(P>0.05)。與對照組比較,miR-30a mimics 組穿膜染色細胞數減少(P<0.001);miR-30a inhibitor 組穿膜細胞數增加(P<0.001)。見圖1。
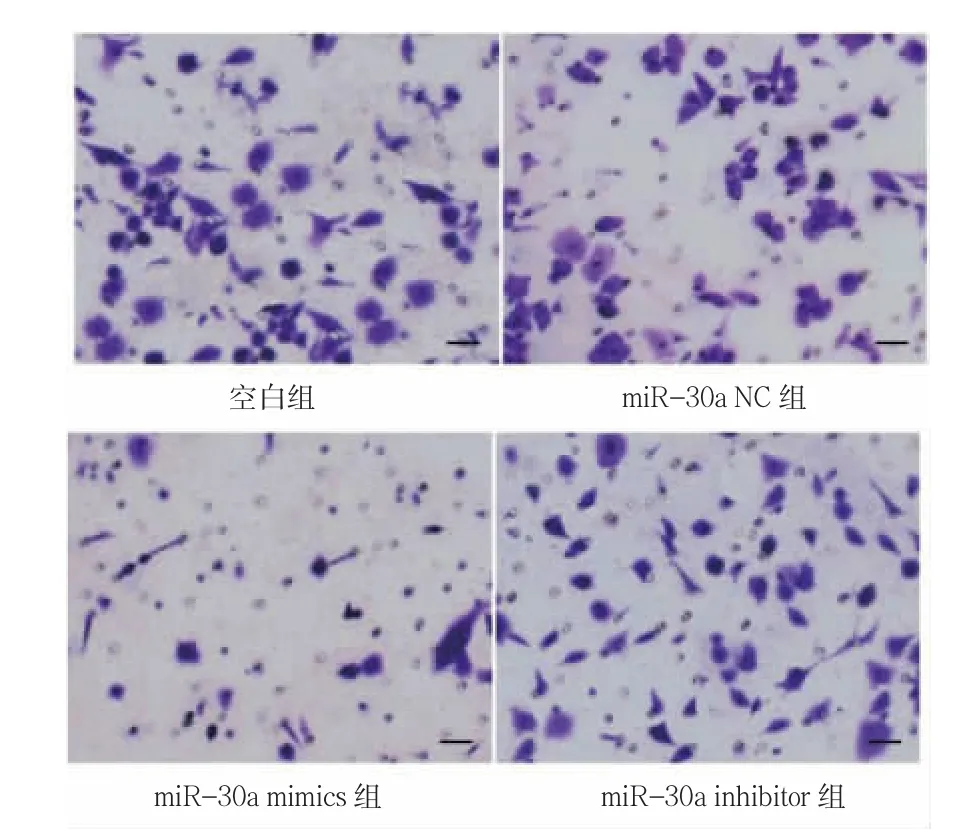
圖1 Transwell 實驗檢測細胞侵襲能力(400×)
2.5 各組細胞凋亡率比較
miR-30a NC 組細胞凋亡率與對照組比較,差異無統計學意義(P>0.05)。與對照組比較,miR-138-5p mimics 組凋亡率升高,miR-30a inhibitor 組凋亡率降低(P<0.05)。見圖2、表4。
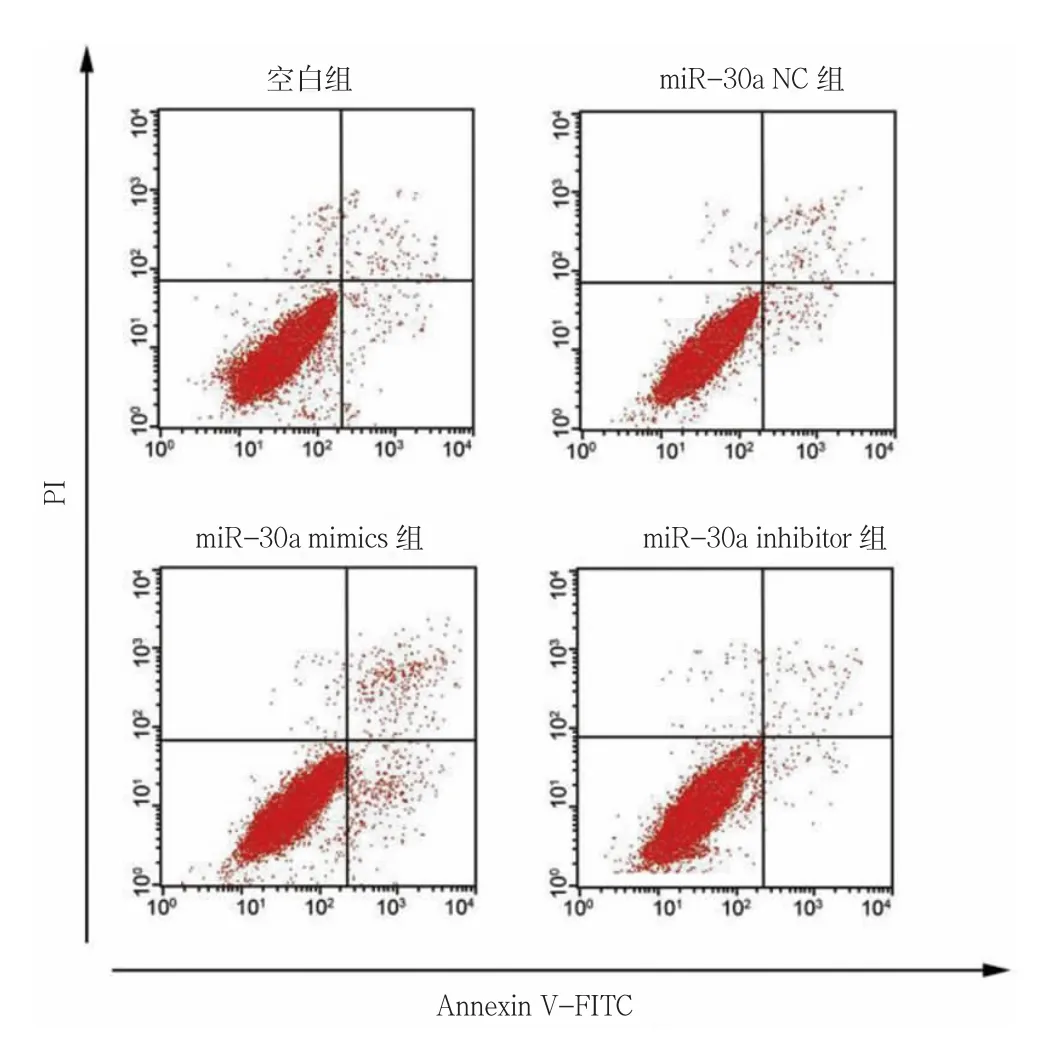
圖2 細胞凋亡率流式圖(n=5)
表4 各組細胞凋亡率比較(%,±s)

表4 各組細胞凋亡率比較(%,±s)
注 與對照組比較,aP<0.05。
2.6 各組細胞TGF-β1、p-Smad2/Smad2 蛋白表達量比較
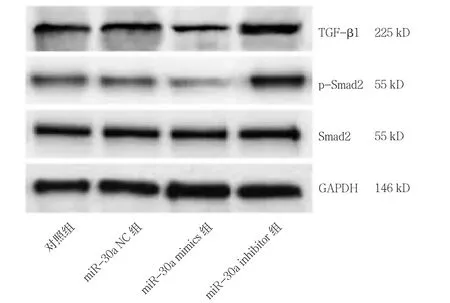
圖3 各組細胞TGF-β1、Smad2、p-Smad2 蛋白表達條帶圖
miR-30a NC 組TGF-β1、p-Smad2/Smad2 蛋 白表達量與對照組比較,差異無統計學意義(P>0.05);與對照組比較,miR-30a mimics 組TGF-β1 蛋白表達量、p-Smad2/Smad2 降低,miR-30a inhibitor 組TGF-β1蛋白表達量、p-Smad2/Smad2 升高(P<0.05)。見圖3、表5。
表5 各組細胞TGF-β1 蛋白表達量、p-Smad2/Smad2 比較(±s)
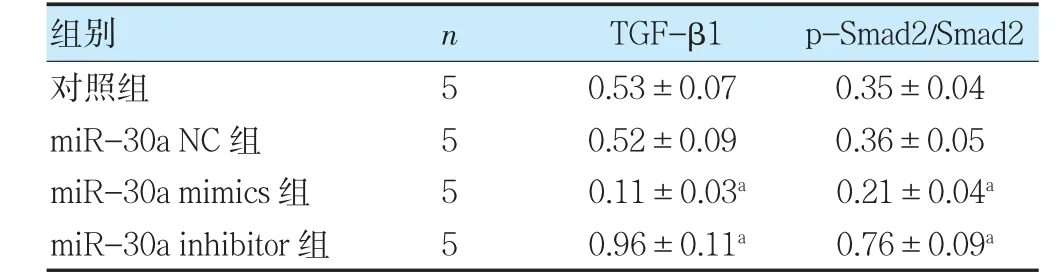
表5 各組細胞TGF-β1 蛋白表達量、p-Smad2/Smad2 比較(±s)
注 與對照組比較,aP<0.05。TGF-β1:轉化生長因子β1。
2.7 雙螢光素酶實驗結果
miR-30a 與TGF-β1 存在互補序列,見圖4。與miR-30a NC 組比較,miR-30a mimics 組TGF-β1-WT熒光酶活性降低(P<0.05),對突變型TGF-β1-MUT熒光酶活性無影響(P>0.05)。見圖4、表6。

圖4 miR-30a 與TGF-β1 互補序列
表6 兩組熒光酶活性比較(±s)
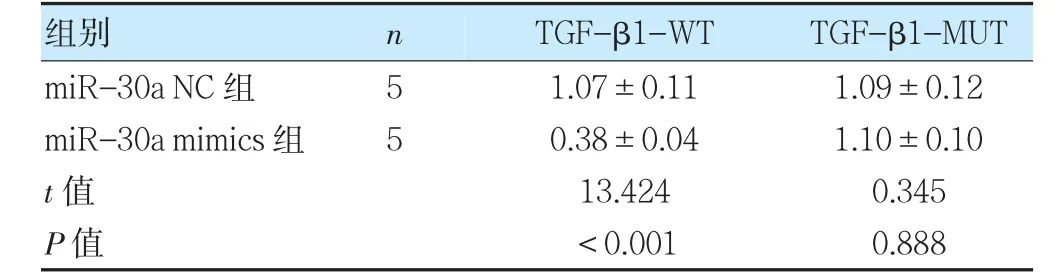
表6 兩組熒光酶活性比較(±s)
注TGF-β1:轉化生長因子β1。
3 討論
GIST 是一種起源于胃腸道壁內的間葉組織的腫瘤,通常表現為良性或低度惡性,但有時也表現為高度惡性[10]。年齡及家族性GIST 綜合征、神經纖維瘤病、Carney-Stratakis 綜合征等也會增加GIST 的發生風險[11-12]。其發病機制主要與KIT 及PDGFRA 基因突變有關,突變基因可編碼酪氨酸激酶受體,在細胞增殖、分化和凋亡等過程中發揮重要作用[13-14]。正常情況下,酪氨酸激酶受體只有結合相應配體后才會被激活,從而調節細胞功能,但當KIT 或PDGFRA 基因發生突變時,會導致受體失去對配體的依賴性,持續維持激活狀態,從而促進細胞無限制增殖及存活,形成腫瘤。高增殖、高侵襲及低凋亡性是GIST 發生及進展的主要原因,探尋抑制GIST 細胞增殖、侵襲并促進其凋亡的有效方式是治療該病的關鍵。
本研究結果顯示,GIST 組織miR-30a 表達量低于正常組織,通過轉染發現miR-30a mimics 組24、48、72 h 增殖率降低,穿膜染色細胞數減少,凋亡率升高,miR-30a inhibitor 組反之,提示miR-30a 在GIST組織中表達降低,上調其表達可抑制GIST 細胞增殖、侵襲,并促進其凋亡。miRNA 是一非編碼小分子RNA,近年來多項研究表明其在GIST 的發病中起重要作用[15-17]。miR-30a 是一種長度為70 個核苷酸的發夾狀結構,位于人類第6 號染色體的6q13 區域,主要由MIR30A-1 和MIR30A-2 兩個轉錄本產生,由Drosha 酶在細胞核內切割而成被轉運到細胞質中,由Dicer 酶進一步切割為成熟的miR-30a。目前關于miR-30a 與腫瘤關系的研究較多。如Ren 等[18]發現,在透明細胞腎組織和細胞中,miR-30a 明顯下調,與晚期TNM 分期和預后不良相關,且表現出有效的抗腫瘤特性。Cai 等[19]認為,在順鉑化療后卵巢癌患者血清以及順鉑耐藥細胞中,miR-30a 的表達顯著降低,其過表達可抑制順鉑誘導的自噬并促進耐藥細胞凋亡。關于miR-30a 在GIST 中的作用,有研究報道顯示其在GIST 中水平較低,并且與伊馬替尼的敏感性呈正相關,并被證實是一種伊馬替尼敏化劑,為克服該病的化療耐藥性提供了新的希望,提示miR-30a 可能與該病的發生及化療敏感性有關[20]。
TGF-β/Smad2 信號通路是一種在細胞內發揮多種功能的信號轉導途徑,包括細胞增殖、分化、遷移、凋亡、細胞穩態及其他細胞功能[21-23]。TGF-β 是機體內常見的一種分泌性細胞因子,作為一組多功能性多肽,其家族中以TGF-β1 活性最高,可被整連蛋白復合物激活,與TGF-β2 受體結合后磷酸化TGF-β1 受體的胞內區域,磷酸化TGF-β1 受體又進一步磷酸化Smad2 蛋白,使其與Smad4 蛋白結合,形成Smad2/4復合物,后者轉運到細胞核內與其他轉錄因子或輔助因子相互作用,調節下游基因表達。既往研究發現,TGF-β 信號通路在腫瘤中被激活,且與miRNA 具有一定關聯,具體表現為誘導上皮間質轉化,使腫瘤細胞獲得更強的遷移和侵襲能力,促進腫瘤轉移;刺激血管生成,為腫瘤提供充足的營養和氧氣,促進腫瘤生長;抑制免疫系統的抗腫瘤反應,使腫瘤細胞逃避免疫監視和清除;調節基因組穩定性,促進染色體不穩定性和微衛星不穩定性,導致基因突變和表達異常[24-26]。本研究結果顯示,上調miR-30a 表達可抑制TGF-β 信號通路蛋白表達,且TGF-β1 是miR-30a的一個靶基因,提示miR-30a 可能通過靶向調控TGF-β 信號通路參與GIST 細胞生物學行為的調控。
綜上所述,miR-30a 在GIST 中表達降低,提高其表達可能通過靶向抑制TGF-β 信號通路活性抑制GIST 細胞增殖、侵襲,促進其凋亡。

