凡納濱對蝦細菌的分離與鑒定
錢詩悅 王興強 鄒易恒 曹梅 劉栩華 李永
摘要以凡納濱對蝦(Litopenaeus vannamei)為研究對象,通過DNA提取和PCR擴增分離鑒定樣本中的歐文斯弧菌(Vibrio owensii)、哈維氏弧菌(V.harveyi)、溶藻弧菌(V.alginolyticus)、副溶血性弧菌(V.parahaemolyticus)、新喀里多尼亞弧菌(V.neocaledonicus)、創傷弧菌(V.vulnificus)、坎式弧菌(V.campbellii)、霍亂弧菌(V.cholerae)、含CTX腸毒素霍亂弧菌(V.cholera CTX)、擬態弧菌(V.mimicu)和河流弧菌(V.fluvialis)11種致病性弧菌。根據樣本TCBS平板檢測結果,統計樣本中所檢測弧菌的重復出現率,按出現頻率逐級分析,對檢出率較高的歐文斯弧菌(V.owens)、哈維氏弧菌(V.harveyi)和溶藻弧菌(V.alginolyticus)進行詳細探討,并根據養殖過程出現的具體情況制定相應的預防和控制策略,為凡納濱對蝦細菌性疾病的防治提供技術支撐。
關鍵詞凡納濱對蝦;細菌;分離;鑒定
中圖分類號S 945.4+9文獻標識碼A
文章編號0517-6611(2023)24-0074-04
doi:10.3969/j.issn.0517-6611.2023.24.016
Isolation and Identification of Bacteria from Litopenaeus vannamei
QIAN Shiyue,WANG Xingqiang,ZOU Yiheng et al
(College of Marine Science and Fisheries,Jiangsu Ocean University,Lianyungang,Jiangsu 222005)
AbstractIn this paper,Litopenaeus vannamei were taken as the research object,11 pathogenic Vibrios,including V.owensii,V.harveyi,V.alginolyticus,V.parahaemolyticus,V.neocaledonicus,V.vulnificus,V.campbellii,V.cholerae,V.cholera CTX,V.mimicu and V.fluvialis were isolated and identified by DNA extraction and PCR amplification.According to the detection results of the sample TCBS plate,the repeated occurrence rate of vibrios detected in the sample were counted,analyzing step by step according to the occurrence frequency.V.owens,V.harveyi and V.alginolyticus with high detection rate were discussed in detail,formulating the corresponding prevention and control strategies according to the specific situation in the breeding process and providing technical support for the prevention and treatment of bacterial diseases of L.vannamei.
Key wordsLitopenaeus vannamei;Bacteria;Separation;Identification
凡納濱對蝦(Litopenaeus vannamei)是目前產量最高的養殖甲殼類,它具有生長速度快、抗病能力強和出肉率高等優點。從2010年開始,在人工養殖過程中病害頻發,導致成活率顯著降低甚至絕收,嚴重影響其養殖的經濟效益。凡納濱對蝦常患的病害包括細菌性疾病,病毒性疾病以及寄生蟲病,其中細菌性疾病較為常見,如副溶血性弧菌(Vibrio parahaemolyticus)、鰻弧菌(V.anguillarum)、歐文斯弧菌(Vibrio owensii)、哈維氏弧菌(V.harveyi)、溶藻弧菌(V.alginolyticus)、新喀里多尼亞弧菌(V.neocaledonicus)、創傷弧菌(V.vulnificus)、坎式弧菌(V.campbellii)、霍亂弧菌(V.cholerae)、含CTX腸毒素霍亂弧菌(V.cholera CTX)、擬態弧菌(V.mimicu)和河流弧菌(V.fluvialis)以及假單胞菌(Pseudomonas)等引起的相關疾病,其主要表現有紅體、紅腿、腸炎和爛鰓等癥狀。
陳健舜等[1]對浙江地區凡納濱對蝦紅體病病原研究后,從病蝦體內分離出的病原體大多為弧菌,包括副溶血性弧菌、坎氏弧菌和需鈉弧菌(V.natriegens),病菌主要分布在凡納濱對蝦體內、甲殼上皮和結締組織等部位,處于急性期的對蝦通體呈紅色,特別是尾扇和游泳足最為明顯。研究表明,對蝦的肝胰腺受到破壞后能夠分泌出大量的肝胰腺類胡蘿卜素,引起紅體癥狀[2]。夏秋季雨水較多,養殖水體鹽度較低,而養殖水溫明顯升高,凡納濱對蝦易受嗜水氣單胞菌(Aeromonas hydrophila)的感染,可誘發紅腿病;當凡納濱對蝦患嚴重的紅腿病時,它的胃壁會呈現紅色,肝部表現橙黃色[3]。張玲宏等[4]通過顯微鏡檢查發現,紅腿病蝦患部紅色素細胞呈擴張狀態,鰓絲末端也存在大量活動的短桿菌,即弧菌。腸炎病多發于7—8月,主要由嗜水氣單胞菌、大腸桿菌(Escherichia coli)和沙門氏菌(Salmonella)等細菌感染引起,腸道、胃部呈血紅色,中腸紅腫、后腸渾濁[5]。該時期水體溫度偏高,加上未按時清理餌料和糞便,易引起缺氧和呼吸困難。當凡納濱對蝦細菌性腸炎發病后,輕則營養吸收能力下降導致對蝦營養不良、脫殼困難、生長緩慢和空腸空胃等現象,重則導致凡納濱對蝦體質與抗病力下降,容易繼發其他細菌病或病毒病,導致偷死或大面積死亡。黃雪敏[6]對2018年廣東省湛江地區春夏季凡納濱對蝦爛鰓病主要病原進行探討,發現為非發光哈維氏弧菌,加上水體污染進一步引起藻類死亡,病原菌的大量蓄積于對蝦鰓部,進一步破壞其組織;病蝦鰓絲腫大呈灰色,潰爛,缺氧,影響吃食,呼吸艱難和食欲不振;水中大量的藻類顆粒能夠通過呼吸進入鰓部,長時間蓄積則會引起黑鰓病以及爛鰓病。
鑒于凡納濱對蝦細菌性疾病頻發的現狀,該研究通過DNA提取和PCR擴增分離鑒定樣本中的歐文斯弧菌、哈維氏弧菌、溶藻弧菌、副溶血性弧菌、新喀里多尼亞弧菌、創傷弧菌、坎式弧菌、霍亂弧菌、含CTX腸毒素霍亂弧菌、擬態弧菌和河流弧菌11種致病性弧菌,以期為凡納濱對蝦細菌性疾病病原菌的確定和對癥下藥提供技術支撐。
1材料與方法
1.1DNA提取
利用試劑盒提取弧菌DNA,提取的DNA可置于2~8 ℃保存,3 d內使用,或-20 ℃以下長期凍存。
1.2PCR擴增
PCR管中分別加入17 μL的擴增反應液,然后向每個PCR管的液面下加入3 μL對蝦樣本DNA模板或陰性對照,加入后對樣本進行輕輕吸打,之后將蓋子蓋上,離心數秒備用。根據PCR標準程序擴增,50 ℃ 2 min;94 ℃ 4 min;(94 ℃ 30 s,52 ℃ 30 s,72 ℃ 20 s),40循環;(94 ℃ 30 s,68 ℃ 30 s,72 ℃ 20 s),3循環;4 ℃保存。當擴增反應完成后,馬上檢測PCR產物或置于-20 ℃保存。
1.3弧菌芯片鑒定
必須在其他的通風房間內進行,切勿與樣本DNA提取、PCR擴增的操作在同一環境內進行。試驗過程中,需提前20 min把微孔板恒溫振蕩器打開,溫度控制在45 ℃。將對應樣本數量的晶格取出,進行標記編號。每份樣本應將600 μL 反應液1和待檢樣本的20 μL PCR擴增產物加入反應槽中。將晶格轉入微孔板恒溫振蕩器,1 500 r/min 振蕩10 min。反應結束后,把晶格取出,打開蓋子,然后將晶格稍微傾斜,讓反應槽內的液體都被吸凈。根據實際的檢測數量,將預先準備好的混合反應液1和反應液2放置到15 mL的試管中,反應液1每份取量為600 μL,反應液2每份取1 μL。向每個反應槽內分別加入600 μL反應液1和反應液2預混合液,振蕩儀1 500 r/min振蕩3 min。打開蓋子,把晶格稍微傾斜,以使反應槽內的液體被吸收干凈。在每個反應槽中加入2 mL的buffer,蓋蓋,置于恒溫振蕩儀,1 500 r/min,2 min。為確保將芯片完全浸沒,需要在反應槽內加入500 μL的反應液3,然后在恒溫條件下,用1 500 r/min 的振蕩儀振蕩3 min。把自來水依次加入每個反應槽后,緩慢搖晃晶格5 s,觀察水中不同芯片上的試驗結果。質量控制標準為陰性對照品的膜芯片除HC(用于質控雜交過程的)存在顏色的位置顯示外,其他的均不出現任何顯色,出現顏色的顯示則表示該區域可能存在環境污染情況。
1.4結果判讀試驗結果如果HC呈陽性,NC探針呈陰性,則可以判斷試驗結果滿足條件,再將不同菌種鑒定試驗樣本的顏色與芯片探針排布圖進行對比,判讀致病性弧菌的種類。
2結果與分析
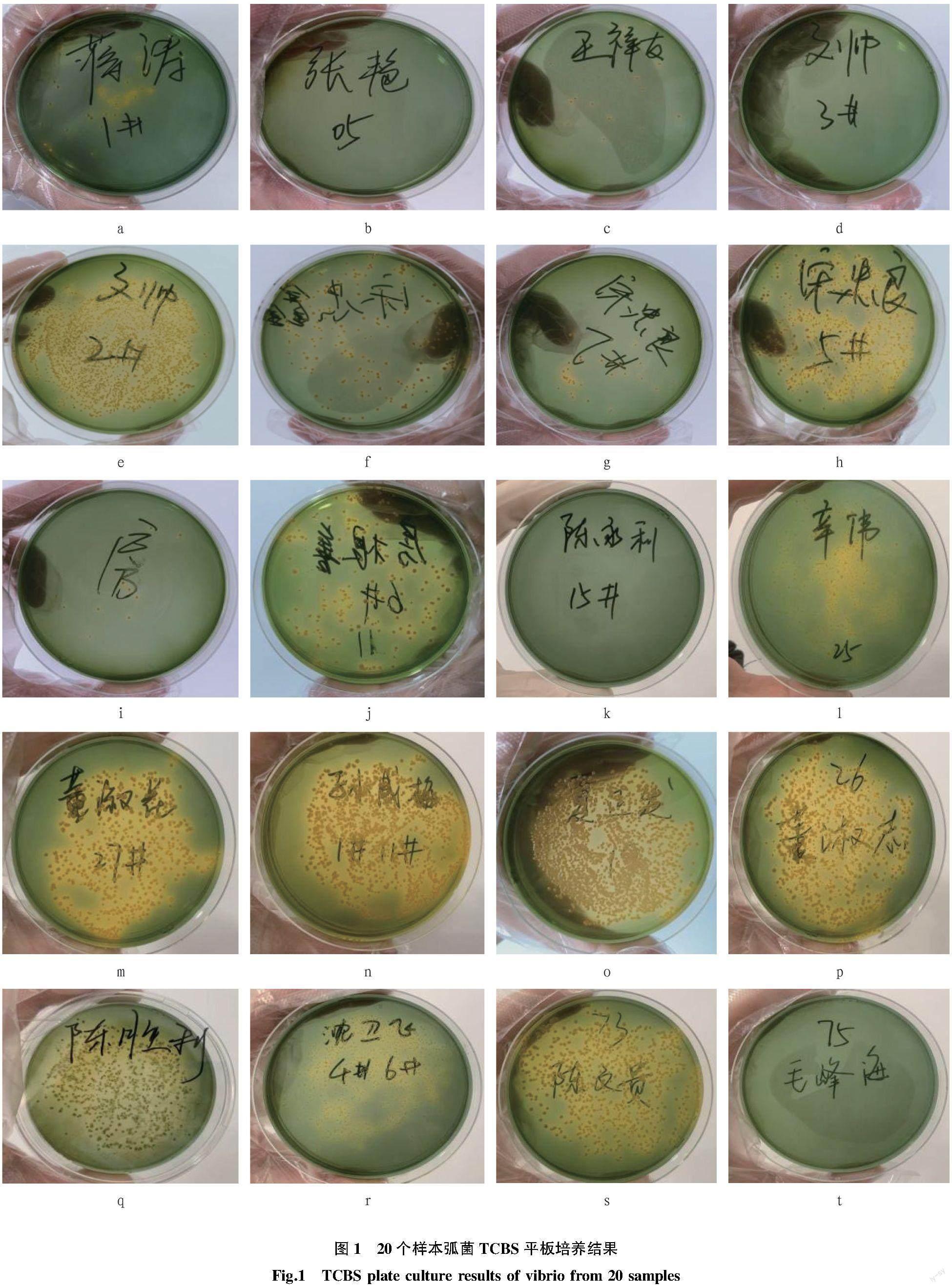
由圖1可以看出,蔣濤樣本在檢測指標內其優勢弧菌為哈維氏弧菌和歐文斯弧菌(圖1a)。張艷樣本TCBS平板培養顯示未見黃色菌落與綠色菌落,在檢測指標內其存在弧菌為溶藻弧菌和歐文斯弧菌(圖1b)。王祥友樣本TCBS平板培養顯示黃色菌落,在檢測指標內其存在弧菌為副溶血性弧菌和歐文斯弧菌(圖1c)。文帥第2個樣本TCBS平板培養顯示為少量黃色菌落,在檢測指標內未檢出弧菌(圖1d);第2個樣本TCBS平板培養顯示黃色菌落,在檢測指標內其存在優勢弧菌為副溶血性弧菌,存在弧菌為哈維氏弧菌(圖1e)。宋忠鑫樣本TCBS平板培養顯示為黃色菌落和綠色菌落,在檢測指標內其存在弧菌為溶藻弧菌、創傷弧菌和歐文斯弧菌(圖1f)。宋忠良第1個樣本TCBS平板培養顯示為黃色菌落,在檢測指標內其優勢弧菌為哈維氏弧菌,存在弧菌為溶藻弧菌(圖1g);第2個樣本TCBS平板培養顯示黃色菌落,在檢測指標內其存在弧菌為溶藻弧菌、新喀里多尼亞弧菌和歐文斯弧菌(圖1h)。房根善第1個樣本TCBS平板培養顯示為黃色菌落,在檢測指標內其存在弧菌為副溶血性弧菌、溶藻弧菌和歐文斯弧菌(圖1i);第2個樣本TCBS平板培養顯示為黃色菌落和少量綠色菌落,在檢測指標內其優勢弧菌為溶藻弧菌,存在弧菌為哈維氏弧菌和歐文斯弧菌(圖1j)。陳永利樣本TCBS平板培養未顯示菌落,在檢測指標內未檢出弧菌(圖1k)。辛偉樣本TCBS平板培養顯示為黃色菌落,在檢測指標內存在弧菌為哈維氏弧菌和歐文斯弧菌(圖1l)。董淑花樣本TCBS平板培養顯示為黃色菌落,在檢測指標內其優勢弧菌為哈維氏弧菌和歐文斯弧菌(圖1m)。孫成梅樣本TCBS平板培養顯示為黃色菌落,在檢測指標內其優勢弧菌為副溶血性弧菌、哈維氏弧菌和歐文斯弧菌(圖1n)。夏正發樣本TCBS平板培養顯示為黃色菌落,在檢測指標內其優勢弧菌為溶藻弧菌和哈維氏弧菌,存在弧菌為副溶血性弧菌和新喀里多尼亞弧菌(圖1o)。董淑志樣本TCBS平板培養顯示為黃色菌落和綠色菌落,在檢測指標內其優勢弧菌為歐文斯弧菌,存在弧菌為溶藻弧菌和哈維氏弧菌(圖1p)。陳勝利樣本TCBS平板培養顯示為綠色菌落,在檢測指標內其存在弧菌為新喀里多尼亞弧菌和歐文斯弧菌(圖1q)。沈衛飛樣本TCBS平板培養顯示為黃色菌落,在檢測指標內未發現弧菌(圖1r)。陳文貴TCBS平板培養顯示為黃色菌落,在檢測指標內優勢弧菌為新喀里多尼亞弧菌和歐文斯弧菌,存在弧菌為副溶血性弧菌和溶藻弧菌(圖1s)。毛峰海TCBS平板培養顯示無菌落,在檢測指標內未檢測出弧菌(圖1t)。
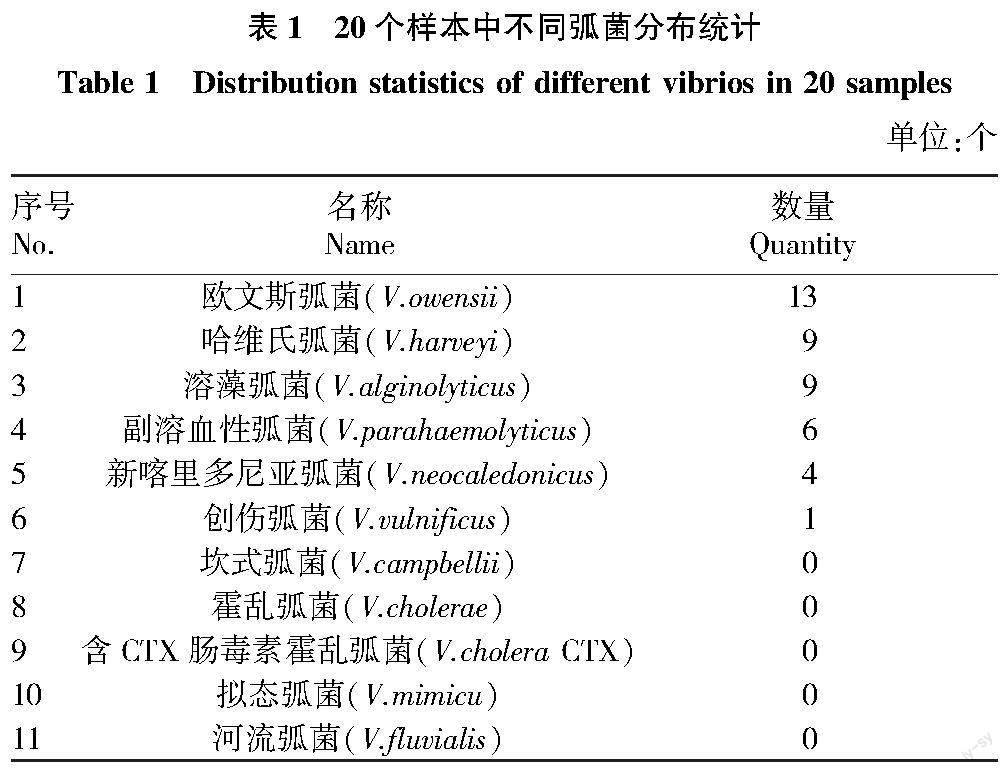
經過對20個樣本中不同弧菌分布統計發現,歐文斯弧菌在樣本中存在數量為13個,哈維氏弧菌和溶藻弧菌存在數量均為9個,副溶血性弧菌存在數量為6個,新喀里多尼亞弧菌存在數量為4個,創傷弧菌存在數量為1個,其余弧菌種類在樣本中未能發現(表1)。
3結論與討論
歐文斯弧菌可能帶導致急性肝胰腺壞死癥(EMS)的毒力因子,存在ACMM642等高致病性毒株,水體中含有100 CFU/mL該毒株,即可導致對蝦死亡,需要嚴格防控[7]。哈維氏弧菌是一種重要的致病性海洋弧菌之一,為近海海洋動物體表或體內正常菌群,其在水體或蝦體內載量較高時容易導致對蝦發光病和胰島細胞壞死病,該弧菌數量較少時屬正常范圍[8]。溶藻弧菌是養殖水體主要弧菌病原,數量較多容易直接或間接導致蝦苗幼體菌血癥、對蝦紅體癥、細菌白斑病,數量較少屬于正常[9]。副溶血性弧菌是養殖水體主要病原,即使有少量數量時若在養殖過程中出現毒理蛋白toxinA/B,也可能爆發EMS;由于EMS死亡率較高,故需要嚴格防控[10]。新喀里多尼亞弧菌在今年最新的報道中指出,該弧菌可能是引發“玻璃苗”的重要病源之一,在玻璃苗中,該菌和溶藻弧菌、副溶血性弧菌為優勢菌種[11]。坎氏弧菌可以導致EMS,但世界動物組織尚未將其列入EMS病原菌,但考慮EMS具有較強的致病性,故暫將其定位為需要較嚴格防控的弧菌種[12]。霍亂弧菌數量較多時易導致對蝦紅體病,在多處對蝦養殖水體中爆發,導致較高的對蝦排塘率,該弧菌數量少時屬于正常范圍[13]。含CTX腸毒素霍亂弧菌致病性較普通霍亂弧菌更強,發病癥狀為行動呆滯,時而浮頭,隨著病情加重全身肌肉發白,一般在1周內死亡,需要嚴格控制[14]。河流弧菌可引發對蝦的紅體綜合征,容易在短期內迅速增殖,故需要嚴格控制[15]。擬態弧菌能引起水產動物的多種弧菌病,如蟹類的氣泡病,黃顙魚潰爛病等,雖目前未見其對蝦養殖影響的明顯案例報道,單考慮其含有溶血素、黏附素、外毒素和腸毒素等多種毒素,存在與其他弧菌協同致病的可能,對蝦養殖的潛在病原,數量較少時屬正常范圍[16]。創傷弧菌是三大致病性弧菌之一,同時也是一種人魚共患病原菌,是人類和水產養殖動物的重要病原弧菌。在水產養殖中,若創傷弧菌超標,可使許多種經濟動物患病,如羅非魚、金鯧魚、安圭拉鰻魚、鱘魚、草魚和南美白對蝦等,該細菌對對蝦養殖而言,數量少時屬正常范圍[17]。
根據20個樣本弧菌TCBS平板檢測結果,歐文斯弧菌在樣本中存在數量最多,哈維氏弧菌和溶藻弧菌存在數量居中,副溶血性弧菌和新喀里多尼亞弧菌存在數量較少,創傷弧菌存在數量最少,因而在購買蝦苗時,要選擇能提供檢驗檢疫合格證的正規渠道,才能有效地從源頭控制病原體進入塘中。蝦苗的放養數量不能過大,否則容易減小蝦的活動空間,從而蝦的攝食量會減少影響營養的吸收,蝦的生長將會放慢;同時活動空間減少,會增加蝦的相互碰撞刺傷,受傷的蝦容易感染病原體從而引發疾病[18]。王淑生[19]研究發現,好的水質對養蝦十分重要,想要養好蝦需要將水質養好,良好的水質就是水質中具有良好的藻相,這是養殖對蝦成功的關鍵環節。在養殖模式上,主要選用生態養殖方式。生態養殖模式具有水體空間進行了合理的利用,水體的自然凈化能力強,從而減少蝦的患病等優勢,同時生態養殖方式可以減少投入成本,從而提高經濟效益。為進一步防治紅腿、紅體病,應于季節交替時全面消毒養殖池,預防腸炎病的有效措施是定期向水池中潑灑有益活菌,包括EM菌、芽孢桿菌、硝化細菌等。這樣可以保持水質優良,水中的氨、氮和亞硝酸鹽等含量不超標,同時保持水質中的菌種平衡,不會造成藍藻過量繁殖[20]。
參考文獻
[1]陳健舜,朱凝瑜,丁雪燕,等.浙江省主要養殖區凡納濱對蝦(Litopenaeus vannamei)紅體病病原研究[J].浙江大學學報(農業與生命科學版),2014,40(6):697-708.
[2] 周燕俠,余開.說說關于養殖南美白對蝦病害的那些事[J].科學養魚,2013(6):13-16,93.
[3] 姚洪,張吉鵬,楊川,等.遼寧一例凡納濱對蝦大規模死亡的病原研究[J].大連海洋大學學報,2016,31(3):256-260.
[4] 張玲宏,古田.南美白對蝦養殖技術與病害防治[J].河南水產,2002(4):17-18.
[5] 王濤.凡納濱對蝦無公害養殖的病害防治技術[J].動物醫學進展,2006,27(5):109-111.
[6] 黃雪敏.凡納濱對蝦育苗系統細菌資源挖掘及溶藻弧菌基因組初步分析[D].湛江:廣東海洋大學,2020.
[7] LIU F,LI S H,YU Y,et al.Pathogenicity of a Vibrio owensii strain isolated from Fenneropenaeus chinensis carrying pir AB genes and causing AHPND[J].Aquaculture,2021,530:1-9.
[8] ZHAO N,JIA L,HE X,et al.Proteomics of mucosal exosomes of Cynoglossus semilaevis altered when infected by Vibrio harveyi[J].Developmental and comparative immunology,2021,119:1-10.
[9] YIN X L,ZHUANG X Q,LIAO M Q,et al.Andrographis paniculata improves growth and nonspecific immunity of shrimp Litopenaeus vannamei,and protects it from Vibrio alginolyticus by reducing oxidative stress and apoptosis[J].Developmental and comparative immunology,2023,139:1-12.
[10] SANTHOSH P,KAMARAJ M,SARAVANAN M,et al.Dietary supplementation of Salvinia cucullata in white shrimp Litopenaeus vannamei to enhance the growth,nonspecific immune responses,and disease resistance to Vibrio parahaemolyticus[J].Fish and shellfish immunology,2023,132:1-10.
[11] 王印庚,于永翔,劉瀟,等.凡納濱對蝦蝦苗細菌性玻化癥(BVS)的病原、病理分析[J].水產學報,2021,45(9):1563-1573.
[12] PHUKET T R N,CHAROENSAPSRI W,AMPARYUP P,et al.Antibacterial activity and immunomodulatory role of a prolinerich antimicrobial peptide SpPRAMP1 against Vibrio campbellii infection in shrimp Litopenaeus vannamei[J].Fish and shellfish immunology,2023,132:1-9.
[13] JOSEPH T C,MURUGADAS V,REGHUNATHAN D,et al.Isolation and characterization of Vibrio cholerae O139 associated with mass mortality in Penaeus monodon and experimental challenge in postlarvae of three species of shrimp[J].Aquaculture,2015,442:44-47.
[14] KORALAGE M S G,ALTER T,PICHPOL D,et al.Prevalence and molecular characteristics of Vibrio spp.isolated from preharvest shrimp of the North Western Province of Sri Lanka[J].Journal of food protection,2012,75(10):1846-1850.
[15] ALAVANDI S V,VIJAYAN? K K,SANTIAGO T C,et al.Evaluation of Pseudomonas sp.PM 11 and Vibrio fluvialis PM 17 on immune indices of tiger shrimp,Penaeus monodon[J].Fish and shellfish immunology,2004,17(2):115-120.
[16] MUNKONGWONGSIRI N,PRACHUMWAT A,EAMSAARD W,et al.Propionigenium and Vibrio species identified as possible component causes of shrimp white feces syndrome (WFS) associated with the microsporidian Enterocytozoon hepatopenaei[J].Journal of invertebrate pathology,2022,192(1):1-10.
[17] JI H,CHEN Y,GUO Y C,et al.Occurrence and characteristics of Vibrio vulnificus in retail marine shrimp in China[J].Food control,2011,22(12):1935-1940.
[18] 高晶,馬力,陳隆升,等.油茶粕制備復合茶皂素清塘劑產品對魚和蝦毒殺效能的研究[J].湖南林業科技,2021,48(3):61-68.
[19] 王淑生.北方地區南美白對蝦“135”二茬分級接續養殖技術[J].科學養魚,2019(6):29-30.
[20] 田國昌.南美白對蝦養殖技術與病害防治措施[J].新農業,2022(23):61-62.

