不同凋落葉和磷添加對亞熱帶馬尾松土壤有機碳氮組分的影響
吳曉霞 元曉春 梅孔燦 劉苑苑 陳文偉 陳岳民

摘要[目的]探究凋落葉、P添加及其交互作用對有機碳(SOC)和有機氮(SON)組分的影響。[方法]以馬尾松土壤為研究對象,通過為期125 d的室內培養(yǎng)試驗,探究了3種凋落葉添加(馬尾松、火力楠和楓香)和P添加(KH2PO4)對土壤SOC和SON組分的影響。[結果]凋落葉添加和P添加均顯著降低了惰性碳(RP-C)組分的含量,兩者共同添加時表現(xiàn)出較強的交互作用。凋落葉對SOC和SON的影響受土壤P有效性的影響,P添加加速了凋落葉添加下土壤微生物對原有RP-C的分解。冗余分析顯示,氨態(tài)氮(NH+4-N)和有效磷(AP)是SOC組分重要的影響因子,而SON組分重要的預測因子是可溶性有機氮(DON)和微生物生物量磷(MBP)。[結論]P添加會促進凋落葉在土壤的分解和轉化,且凋落葉的輸入增加了對RP-C的分解,這將進一步加速SOC的周轉。
關鍵詞凋落葉;P添加;兩步酸水解;土壤有機碳、氮組分;酶活性
中圖分類號S 714文獻標識碼A文章編號0517-6611(2023)24-0104-07
doi:10.3969/j.issn.0517-6611.2023.24.023
Effects of Different Litter Leaves and Phosphorus Addition on Soil Organic Carbon and Nitrogen Components of Pinus massoniana Soil in Subtropics
WU Xiaoxia1,2, YUAN Xiaochun1,2,3, MEI Kongcan1,2 et al
(1. College of Geographical Science, Fujian Normal University, Fuzhou, Fujian? 350007;2. Cultivation Base of State Key Laboratory of Humid Subtropical Mountain Ecology, Fuzhou, Fujian 35000;3.College of Tourism, Wuyi University,? Wuyishan, Fujian 354300)
Abstract[Objective] To investigate the effects of leaf litter, P addition, and their interactions on changes in SOC and SON components.[Method]The effects of three kinds of withered leaf additions (Michelia macclurei, Pinus masson and Liquidam fortiana) and P addition (KH2PO4) on SOC and SON components were investigated through a 125day indoor culture experiment with the soil of Pinus massoniana as the research object. [Result]The results showed that both leaf litter addition and P addition significantly reduced the content of recalcitrant C (RPC) component, and they showed a strong interaction. The effects of leaf litter on SOC and SON were influenced by soil P availability, and P addition accelerated the decomposition of original recalcitrant C by soil microorganisms under leaf litter addition.Redundancy analysis showed that ammonia nitrogen (NH+4N) and available phosphorus (AP) were the most important influencing factors of SOC fraction, while dissolved organic carbon (DON) and microbial biomass phosphorus (MBP) were the most important predictors of SON fraction. [Conclusion]P addition can promote the decomposition and transformation of leaf litter in soil, and the input of leaf litter increases the decomposition of recalcitrant C, which will further accelerate the turnover of SOC. This study will provide a scientific basis for the study of carbon and nitrogen cycling in subtropical soil with increased litter input and P limitation and forest soil management in Daiyunshan Nature Reserve.
Key wordsLeaf litter;Phosphorus addition;Twostep acid hydrolysis;Carbon and nitrogen components;Enzyme activity
土壤有機碳(SOC)和土壤有機氮(SON)對維持生態(tài)系統(tǒng)功能具有重要作用,尤其在提高土壤和生態(tài)系統(tǒng)的可持續(xù)性和生產力方面至關重要[1]。土壤碳庫是陸地生態(tài)系統(tǒng)中最大的碳庫,其碳儲量約為1 550 Gt(深可達 1 m),是大氣或植被碳庫的2.5~3.0倍[2]。作為生態(tài)系統(tǒng)碳循環(huán)的關鍵因子,SOC微小的動態(tài)變化會對外界CO2的排放產生重大影響,最終導致氣候的正反饋[3];而SON是礦質氮的源和庫,占全氮 90% 以上,是土壤供氮潛力的主要貢獻者。因此,識別和控制SOC和SON 的動態(tài)變化對于評估陸地生態(tài)系統(tǒng)碳、氮通量及全球碳氮模型的預測至關重要。
SOC和SON成分復雜多樣,目前對其不同成分動態(tài)的單獨研究仍存在技術挑戰(zhàn)。通常,活性組分是植物和微生物所需養(yǎng)分的直接供應庫;而頑固性組分更多地表現(xiàn)為土壤碳、氮的長期儲存狀態(tài)[4]。根據(jù)難易降解程度及分解速率,兩步酸水解法可以將SOC和SON劃分為活性組分和頑固性組分(包括慢性、惰性組分)[5]。這將為探究SOC和SON不同組分動態(tài)變化,厘清SOC和SON組分對環(huán)境變化的響應及其關鍵影響因素提供可能。
全球氣候變暖情境下,植物光合作用的加強將促進植物生物量增長,引起植物生命周期過程中凋落物增加。通常而言,由于不同森林類型的凋落葉數(shù)量和質量不同,其SOC和SON的含量會存在差異。現(xiàn)有研究表明,凋落物增加會顯著降低SOC和SON中的活性組分,增加惰性組分,從而增強土壤碳、氮穩(wěn)定性[6]。其可能原因在于凋落葉輸入會改變土壤-凋落葉層的理化性質和生物特性,如有效氮的含量、微生物群落和酶活性[7-8],但對其具體影響過程還缺乏系統(tǒng)認識。此外,近20年亞洲和歐洲大氣磷(P)沉降呈顯著上升趨勢[9],也增加了森林土壤P元素的供應。P元素是植物生長不可或缺的重要養(yǎng)分,P供應增加可以提供有效的P源,減少微生物為獲取P而對SOC的利用,從而減少SOC的分解[8]。有研究表明,P添加對SOC的貢獻可能是由于通過增加殘體分解酶的活性來改變土壤微生物生物量[10-11]。Fang等[12]研究發(fā)現(xiàn),P添加會通過改變微生物群落和纖維生物苷酶活性增加SOC積累。劉仁[13]研究表明,NH+4-N、N∶P、全P等理化性質是調控土壤微生物群落的主導因子。但目前對P添加如何調控SOC和SON組分變化還不夠深入。由此可見,凋落葉添加和P添加對SOC和SON組分均存在重要影響,但其作用機制仍有待進一步探索,特別是對兩者共同添加如何影響SOC和SON組分還知之甚少。
馬尾松(Pinus massoniana,PM)是我國重要的鄉(xiāng)土樹種之一,具有分布面積廣,經濟價值高,用途廣,適應性強等特點,廣泛分布于我國亞熱帶地區(qū),并延至北熱帶[14]。前期試驗發(fā)現(xiàn),針葉樹種馬尾松、闊葉樹種火力楠(Michelia macclurei,MM)和闊葉樹種楓香(Liquidambar formosana,LF)的凋落葉因C∶N不同而質量差異較大[14]。因此,筆者采用雙因素試驗設計,在亞熱帶馬尾松林土壤中單獨或共同添加不同質量凋落物和P,通過125 d的室內培養(yǎng)試驗,探究馬尾松、火力楠和楓香3種凋落葉和P添加對SOC和SON的影響過程及機制,并闡明影響有機碳氮組分的關鍵因子,以期預測環(huán)境變化對亞熱帶土壤SOC、SON循環(huán)過程的影響,為亞熱帶森林土壤碳氮循環(huán)過程及機制研究提供科學依據(jù)。
1材料與方法
1.1研究區(qū)域與樣地概況
試驗土壤樣品采集于福建戴云山國家級自然保護區(qū)(25°38′07″~25°43′40″N,118°05′22″~118°20′15″E),該區(qū)屬于典型的亞熱帶海洋性季風氣候,海拔為700~1 500 m。年均溫為19.5 ℃,年降水量為1 700~2 000 mm(主要集中在3—9月),年霧日達220 d[15],土壤以花崗巖風化發(fā)育而成的紅壤為主。2019年5月在馬尾松林下去除表面凋落葉后隨機選點取樣,多點混合成1個土壤樣品,研磨過2 mm土壤篩,混勻后4 ℃保存?zhèn)溆谩?/p>
1.2試驗設計與培養(yǎng)
采用雙因素試驗設計,選擇馬尾松、火力楠和楓香3個樹種進行凋落葉添加,同時分別做施P和不施P處理。試驗共8個處理,包括對照(CT),P單獨添加(P),馬尾松凋落葉單獨添加(PM),火力楠凋落葉單獨添加(MM),楓香凋落葉單獨添加(LF),馬尾松凋落葉+P共同添加(PM+P),火力楠凋落葉+P共同添加(MM+P),楓香凋落葉+P共同添加(LF+P),每處理3次重復。具體操作如下:每個處理稱取經含水率換算后含100 g干土重的鮮土于500 mL培養(yǎng)瓶中,將不同樹種葉片風干磨碎后按照原有SOC 2%的比例進行凋落葉C的添加(20 mg/g SOC),能刺激微生物活性[16]。P添加形式為KH2PO4,依據(jù)田間管理方式施P量為30 mg/kg[17]。每處理3次重復,將培養(yǎng)瓶置于25 ℃培養(yǎng)箱中培養(yǎng),調節(jié)土壤含水率到田間最大持水量的60%。培養(yǎng)125 d后測定各項指標數(shù)據(jù)。
1.3測定項目與方法
土壤基本理化性質的測定:pH采用電位法,以土∶水為1∶2.5進行混合,振蕩靜置后用pH計(PHS-3B)測定;可溶性有機碳(DOC)用去離子水以土∶水為1∶4浸提,振蕩離心,上清液用0.45 μm濾膜過濾后,用總有機碳分析儀(TOC-VCPH/CPN,Japan)測定;氨態(tài)氮(NH+4)和硝態(tài)氮(NO-3)用KCl溶液浸提后,經振蕩、離心、過濾,于24 h內使用連續(xù)流動分析儀(SKALAR San++,Netherlands)測定[18];總磷(TP)采用凱式消煮法提取后用連續(xù)流動分析儀(SKALAR San++,Netherlands)測定;土壤有機碳(SOC)和總氮(TN)等采用碳氮元素分析儀(Elementar Vario MAX,Germany)測定[19];有效磷(AP)用0.5 mol/L NaHCO3提取[20],采用連續(xù)流動分析儀(SKALAR San++,Netherlands)測定。
土壤SOC、SON的測定:采用2步酸水解法酸解SOC、SON組分[21],即在 1 g通過 0.149 mm 篩的風干土樣中加入20 mL 5 mol/L H2SO4,在密封的消煮管中用105 ℃水解30 min,離心、過濾回收水解產物。用20 mL去離子水洗滌殘渣,并將洗滌物加入水解液中。將水解產物作為不穩(wěn)定庫I(LPI),分析不穩(wěn)定庫I的C(活性碳,LPI-C)和N(活性氮,LPI-N)。剩下的殘渣用2 mL 26 mol/L H2SO4在室溫下連續(xù)搖動水解過夜。然后用去離子水稀釋酸的濃度到2 mol/L,在105 ℃下水解3 h,多次振蕩。水解產物的回收方式與LPI相同。將第2個水解產物作為不穩(wěn)定庫II(LPII),分析其C(慢性碳,LPII-C)和N(慢性氮,LPII-N)。不穩(wěn)定庫I主要含有植物來源的多糖(如半纖維素和淀粉)和微生物來源的多糖(主要是微生物細胞壁),而不穩(wěn)定庫II主要由纖維素組成[22-23]。頑固性C(RP-C)和N(RP-N)庫計算為總SOC、SON庫(即SOC或TN)與不穩(wěn)定庫(LPI和LPII之和)的差值。
土壤微生物生物量的測定:微生物生物量碳(MBC)用氯仿熏蒸-浸提法[24]提取,用總有機碳分析儀(TOC-VCPH/CPN,Japan)測定。微生物生物量氮(MBN)提取方法同MBC,采用連續(xù)流動分析儀(SKALAR San++,Netherlands)測定。微生物生物量磷(MBP)采用氯仿熏蒸-NaHCO3浸提法[25]提取,測定儀器同MBN。土壤 MBC、MBN及MBP的計算見梅孔燦等[14]的文獻。
土壤微生物酶活性的測定:測定4種水解酶[纖維素水解酶(CBH)、β-葡萄糖苷酶(βG)、β-N-乙酰氨基葡萄糖苷酶(NAG)和酸性P酸酶(ACP)]活性和2種氧化酶[酚氧化酶(PHO)和過氧化物酶(PEO)]活性。測定方法參考Saiya-Cork[26-27]的文獻。
1.4數(shù)據(jù)分析
數(shù)據(jù)處理和統(tǒng)計分析采用Excel 2019和SPSS 25.0軟件,冗余分析(RDA)采用Canoco 5軟件,作圖采用Origin 9.0軟件。不同處理間各指標的差異顯著性采用單因素方差分析(One-way ANOVA)和鄧肯方差分析法(Duncan)計算。凋落葉、P添加以及兩者交互作用對土壤理化性質、SOC、SON組分、土壤微生物生物量和土壤酶活性等指標的影響采用雙因素方差分析(Two-way ANOVA)進行分析處理。RDA以不同凋落葉和P添加處理的SOC組分和SON組分為響應變量,以基本理化性質、土壤微生物生物量和酶活性為解釋變量進行分析。
2結果與分析
2.1土壤基本理化性質
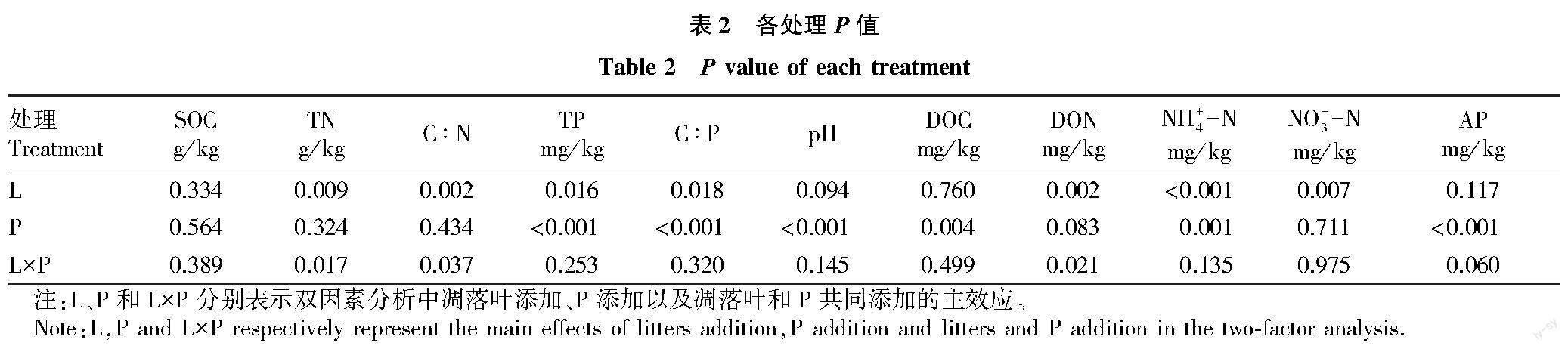
培養(yǎng)結束時,凋落葉添加對N有效性的影響顯著,凋落葉添加顯著降低了DON(P=0.002)、NH+4-N(P<0.001)和NO-3-N(P=0.007)的含量,凋落葉和P共同添加時,進一步降低了土壤中DON和NH+4-N的含量。P添加處理對TN和C∶N無影響,但當?shù)蚵淙~添加TN和C∶N極顯著降低(P<0.01),且凋落葉和P添加交互作用顯著(P<0.05)。凋落葉添加對TP和C∶P的影響與TN和C∶N一致(P<0.05),但P添加整體上提高了土壤TP的含量和AP含量(P<0.001),降低了C∶P的含量(P<0.001),且極顯著降低了DOC的含量(P<0.01)(表1、2)。
2.2不同處理對SOC和SON的影響
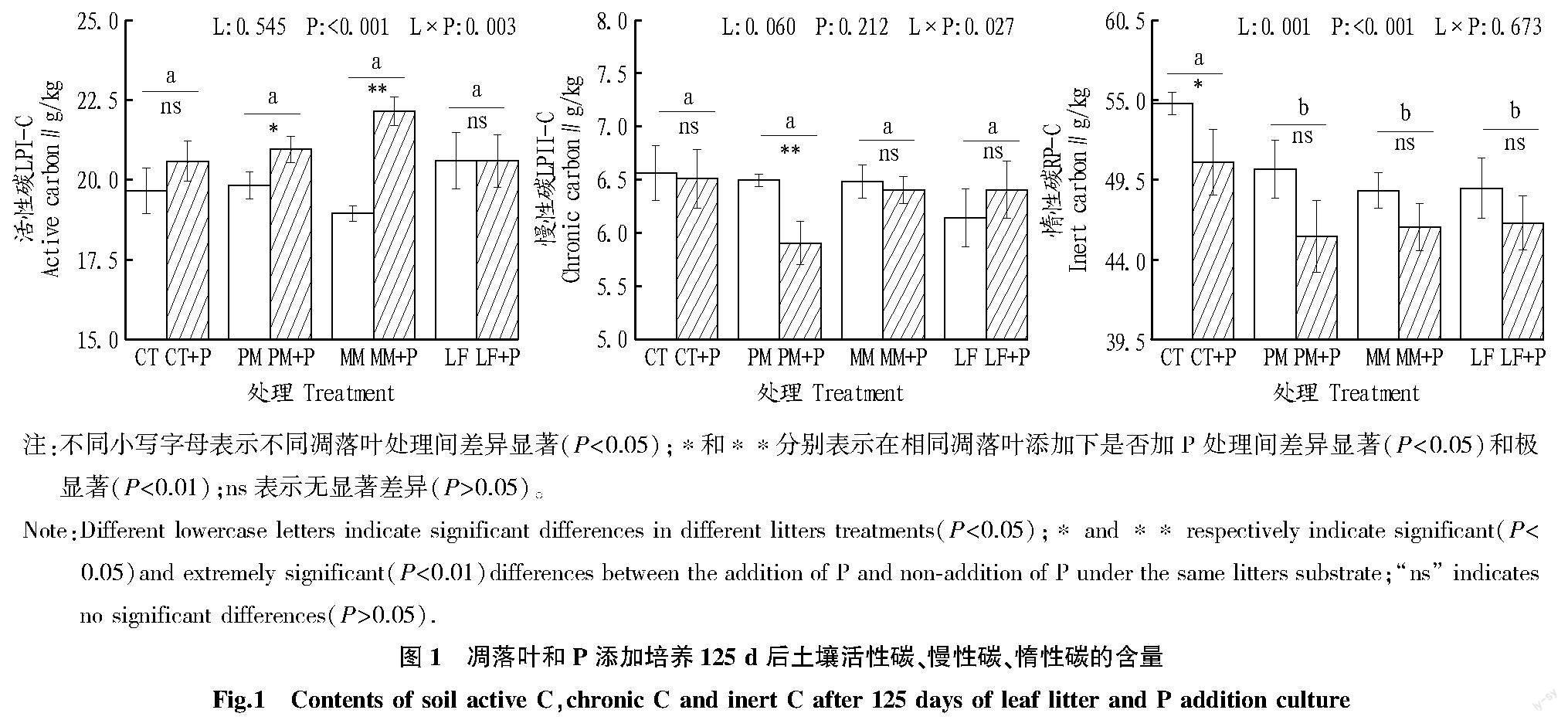
結果顯示,單獨凋落葉添加和單獨P添加均極顯著降低了RP-C組分的含量(P<0.01)。相比于單獨凋落葉添加,凋落葉和P共同添加對活性碳LPI-C和慢性碳LPII-C的影響更加顯著。具體而言,相比于PM單獨添加,PM+P處理下LPI-C組分的含量顯著增加,而LPII-C組分的含量極顯著降低(P<0.01);相比于MM處理,MM+P處理則極顯著增加了LPI-C組分含量(P<0.01)(圖1)。
凋落葉添加對各SON組分有顯著影響(P<0.05),但各處理之間,只有MM和LF 2種凋落葉添加顯著增加了土壤中RP-N組分的含量(P<0.05)。單獨P添加對各SON組分均無顯著影響,但相比單獨凋落葉添加處理,PM+P處理顯著增加了LPI-N組分,而降低了LPII-N組分(P<0.05);MM+P處理極顯著提高了LPI-N組分(P<0.01),顯著提高了RP-N組分(P<0.05)的含量;LF+P處理也顯著提高了RP-N組分的含量(P<0.05)。此外,凋落葉和P添加處理對各SON組分均有極顯著交互作用(P<0.01)(圖2)。
2.3土壤微生物生物量和酶活性的變化
P和凋落葉添加對微生物影響顯著,且不同凋落葉添加具有一定差異。具體而言,P添加處理對3種微生物生物量均有極顯著影響(P<0.01),P添加極顯著降低了MBC,而極顯著增加了MBN和MBP(P<0.01)。單獨凋落葉添加時,對MBC和MBP影響不顯著(P>0.05),而PM和LF 2種凋落物添加極顯著增加了MBN的含量(P<0.01)。比較單獨添加與共同添加對微生物量影響發(fā)現(xiàn),其影響效應具有一定差異,對MBN表現(xiàn)出較強的交互作用(圖3)。
經125 d培養(yǎng)后,對土壤中6種酶活性進行測定。結果顯示,凋落葉添加對4種土壤水解酶作用極顯著(P<0.001),對2種土壤氧化酶作用顯著(P<0.05);而P添加處理除對PHO影響不顯著外(P=0.848),對另外5種酶均具有顯著(P<0.05)或極顯著影響(P<0.01);同時,P和凋落葉共同添加對6種土壤酶均具有極顯著的交互作用(P<0.001)。具體而言,單獨P添加顯著增加了βG和NAG 2種水解酶的含量(P<0.05),對其他土壤酶則影響不顯著(P>0.05)(圖4)。
2.4SOC和SON與環(huán)境因子的相關性
土壤環(huán)境因子對SOC組分的解釋度達78.99%,其中第1軸解釋度為75.37%,第2軸解釋度為3.62%。對SOC組分存在顯著影響的因子包括NH+4-N、AP、PEO和C∶P,其中NH+4-N(64.7%)解釋度最高,其次為AP(9.2%)。在所有SOC組分中,RP-C與環(huán)境因子相關程度最高,其次為LPI-C組分。從RDA結果可以看出,相同處理的平行樣在RDA1軸上分布較為集中,而在RDA2軸上分布較為分散,可見NH+4-N和AP 2個環(huán)境因子在不同處理間的影響效果更為顯著,而PEO和C∶P的差異更易造成同一處理的平行樣品間SOC組分的差異(圖5A)。
土壤環(huán)境因子對SON組分的解釋度達73.30%,其中第1軸解釋度為73.17%,第2軸解釋度為0.13%。對SON組分存在顯著影響的因子包括DON、MBP、TN、MBC和βG,其中對SON組分解釋度最高的是DON(44.6%),其次是MBP(10.2%)。在所有SON組分中,RP-N與環(huán)境因子相關程度最高,其次為LPI-N組分。這與SOC組分與環(huán)境因子關系情況類似,RP-N易受到環(huán)境因子的影響,其次是LPI-N組分(圖5B)。
3討論
3.1凋落葉添加對SOC和SON的影響
該研究中凋落葉添加僅顯著降低了RP-C組分,表明相比于LPI-C組分,難降解C組分更易受到不穩(wěn)定碳輸入的影響,這與Chen等[28]的研究結果一致。這可能是由于分解難降解C組分的土壤微生物,其C限制閾值相對較高,微生物休眠比例較大,當新鮮C輸入時,這種微生物更高比例被激活從而加速難降解C的分解。陳子豪等[29]研究發(fā)現(xiàn),在有新鮮碳輸入的生態(tài)系統(tǒng)中,活性碳的含量會增加。但該研究中,土壤中總的SOC并無顯著變化,這可能是由于新鮮碳的輸入激活了更多微生物分泌更多胞外酶,從而增加了對SOC的利用。
此外,不同凋落葉添加對LPI-N和LPII-N 2種SON組分無顯著性影響,但MM和LF 2種凋落葉添加顯著提升了土壤RP-N組分的含量。可能的原因在于MM和LF 2種均為闊葉樹種凋落葉,相對于PM具有更高的C/N,通常較高的C/N更難釋放活性有機質,而傾向于產生難降解有機質。因此,低質量凋落葉(高C/N)的輸入可降低對土壤RP-N的利用,說明凋落葉質量也是影響土壤N組分的重要因素之一。但MM和LF 2種凋落葉添加后N循環(huán)相關的水解酶的含量變化差異較大,表明 2種凋落葉輸入對SON組分的影響途徑不盡相同。
3.2P添加對SOC和SON組分的影響
該研究中,單獨P添加顯著降低了土壤中RP-C組分,表明P養(yǎng)分有效性對惰性碳組分影響顯著,這與Liu等[30]的研究結果一致。這可能是由于土壤難降解C組分分解微生物更易受P限制的影響。有研究表明,與N有效性相比,P有效性對熱帶和亞熱帶森林土壤的C循環(huán)影響更大[31]。與此同時,當?shù)蚵淙~與P共同添加時,RP-C組分相比于對照組均顯著降低,這與Hartman等[32]的研究結果一致。這可能是由于P與凋落物共同添加進一步緩解了土壤難降解C分解微生物的C、N以及P限制。P添加顯著調節(jié)微生物活性和代謝率,對土壤C的周轉具有不可或缺的反饋作用[33]。
單獨P添加對SON各組分無顯著影響,這與Feng等[34]的研究結果一致。而凋落葉與P共同添加時,則更易增加RP-N和LPI-N組分的含量,說明P對土壤SON組分存在重要影響,且不同凋落葉對土壤SON組分影響具有顯著差異。這可能是凋落葉質量差異形成土壤碳氮化學計量不同而引起的微生物群落結構變化造成的。凋落葉和P的輸入還促進了微生物對無機氮的同化,特別是當?shù)蚵淙~添加時,無機氮的含量大幅降低,MBN 含量顯著提高,這與董冬玉等[35]的研究結果一致。這可能是由于無機氮被微生物同化為有機氮或固定在微生物體內。
3.3凋落物和P添加下SOC和SON組分的影響因子
C和其他營養(yǎng)物質(如P)的有效性常常限制土壤中異養(yǎng)微生物的生長和活性[36],因此可以強烈影響C的轉化和損失,以及SON礦化和隨后的N轉化。冗余分析發(fā)現(xiàn),不同處理間的SOC組分具有較好的聚類結果,SOC組分與土壤NH+4-N含量呈顯著正相關,這與吳玥等[37]研究結果一致。NH+4-N作為有效N的重要組成部分,微生物可對其快速利用而增加自身活性,更快分解土壤有機質,從而改變SOC組分含量和結構。N含量與SOC間的重要關系已得到很多驗證[38-39],基于水稻土的研究也顯示LPI-C和RP-C含量與土壤全氮、C/N間存在顯著線性關系。該結果表明,SON組分與DON呈顯著負相關,可見無機氮有效性對SON組分也具有重要影響。
此外,需要強調的是微生物和胞外酶對SOC和SON的作用。RDA分析結果顯示,MBP、MBC、βG和PEO等生物特性對SOC和SON也具有重要影響。微生物是森林生態(tài)系統(tǒng)凋落葉分解的驅動者,凋落葉分解過程基本上是由土壤酶控制的。楓香凋落葉作為高C/N有機物添加,造成土壤N素相對匱乏,進而引起微生物多分泌NAG胞外酶來穩(wěn)定自身C/N,這可以從LF+P添加NAG酶含量顯著高于其他處理得到驗證。此外,土壤胞外酶活性是影響土壤呼吸的主要因素,而土壤呼吸的強弱直接反映了土壤有機質分解速率,因而胞外酶的活性也是影響土壤C組分的重要因素。沒有胞外酶,土壤微生物難以分解復雜的結構性碳[40],如與難降解的木質素和腐殖質有關的PHO和過氧化物酶PEO[41]。此外,C、N的有效性變化對土壤有機質變化的影響可能是通過酶活性的變化來調節(jié)的[42]。
4結論
該研究結果表明,凋落葉添加顯著降低了惰性碳(RP-C)組分,而改變了土壤碳庫的組成結構,但對SON組分作用受凋落葉質量及與P添加交互作用的影響。P添加進一步緩解了微生物P限制對SOC、SON組分利用的抑制,說明P有效性是P限制亞熱帶森林土壤碳循環(huán)的重要影響因素之一。凋落葉和P添加均可直接或間接改變土壤環(huán)境因子,而NH+4-N和DON等環(huán)境因子是影響土壤C、N組分的重要影響因素。
參考文獻
[1] FANG Y Y,NAZARIES L,SINGH B K,et al.Microbial mechanisms of carbon priming effects revealed during the interaction of crop residue and nutrient inputs in contrasting soils[J].Global change biology,2018,24(7):2775-2790.
[2] POST W M,KWON K C.Soil carbon sequestration and landuse change:Processes and potential[J].Global change biology,2000,6(3):317-327.
[3] HEIMANN M,REICHSTEIN M.Terrestrial ecosystem carbon dynamics and climate feedbacks[J].Nature,2008,451(7176):289-292.
[4] 王蓓,孫庚,羅鵬,等.模擬升溫和放牧對高寒草甸土壤有機碳氮組分和微生物生物量的影響[J].生態(tài)學報,2011,31(6):1506-1514.
[5] MCLAUCHLAN K K,HOBBIE S E.Comparison of labile soil organic matter fractionation techniques[J].Soil science society of America,2004,68(5):1616-1625.
[6] 郭曉偉.凋落物處理和氮添加對森林土壤碳氮組分和微生物過程的影響[D].北京:北京林業(yè)大學,2020.
[7] 張燕,強薇,羅如熠,等.氮磷添加對土壤微生物生長、周轉及碳利用效率的影響研究進展[J].應用與環(huán)境生物學報,2022,28(2):526-534.
[8] ZHAO Q,CLASSEN A T,WANG W W,et al.Asymmetric effects of litter removal and litter addition on the structure and function of soil microbial communities in a managed pine forest[J].Plant soil,2017,414(1/2):81-93.
[9] PAN Y P,LIU B W,CAO J,et al.Enhanced atmospheric phosphorus deposition in Asia and Europe in the past two decades[J].Atmospheric and oceanic science letters,2021,14(5):1-5.
[10] CAMENZIND T,HTTENSCHWILER S,TRESEDER K K,et al.Nutrient limitation of soil microbial processes in tropical forests[J].Ecological monographs,2018,88(1):4-21.
[11] YUAN Y,LI Y,MOU Z J,et al.Phosphorus addition decreases microbial residual contribution to soil organic carbon pool in a tropical coastal forest[J].Global change biology,2021,27(2):454-466.
[12] FANG X M,ZHANG X L,CHEN F S,et al.Phosphorus addition alters the response of soil organic carbon decomposition to nitrogen deposition in a subtropical forest[J].Soil biology and biochemistry,2019,133:119-128.
[13] 劉仁.凋落物添加和去除對杉木林土壤剖面有機碳組分及微生物特性的影響[D].南昌:江西農業(yè)大學,2021.
[14] 梅孔燦,陳岳民,范躍新,等.凋落葉和磷添加對馬尾松林土壤碳激發(fā)效應的影響[J].土壤學報,2022,59(4):1089-1099.
[15] SONG X Z,CHEN X F,ZHOU G M,et al.Observed high and persistent carbon uptake by Moso bamboo forests and its response to environmental drivers[J].Agricultural and forest meteorology,2017,247:467-475.
[16] BLAGODATSKAYA Е,KUZYAKOV Y.Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure:Critical review[J].Biology and fertility of soils,2008,45(2):115-131.
[17] ZHU Z K,GE T D,LUO Y,et al.Microbial stoichiometric flexibility regulates rice straw mineralization and its priming effect in paddy soil[J].Soil biology and biochemistry,2018,121:67-76.
[18] HUANG Z Q,WAN X H,HE Z M,et al.Soil microbial biomass,community composition and soil nitrogen cycling in relation to tree species in subtropical China[J].Soil biology and biochemistry,2013,62:68-75.
[19] GUO M X.Soil sampling and methods of analysis[J].Journal of environmental quality,2009,38(1):375.
[20] OLSEN S R,SOMMERS L E.Phosphorus[M]∥PAGE A L.Methods of soil analysis,part 2.2nd Edition.Madison,WI:American Society of Agronomy,Inc.,1982:403-431.
[21] LI Y Q,QING Y X,LYU M K,et al.Effects of artificial warming on different soil organic carbon and nitrogen pools in a subtropical plantation[J].Soil biology and biochemistry,2018,124:161-167.
[22] OADES J M,KIRKMAN M A,WAGNER G H.The use of gasliquid chromatography for the determination of sugars extracted from soils by sulfuric acid[J].Soil science society of America proceedings,1970,34(2):230-235.
[23] ROVIRA P,VALLEJO V R.Labile,recalcitrant,and inert organic matter in Mediterranean forest soils[J].Soil biology and biochemistry,2007,39(1):202-215.
[24] VANCE E D,BROOKES P C,JENKINSON D S.An extraction method for measuring soil microbial biomass C[J].Soil biology and biochemistry,1987,19(6):703-707.
[25] BROOKES P C,POWLSON D S,JENKINSON D S.Measurement of microbial biomass phosphorus in soil[J].Soil biology and biochemistry,1982,14(4):319-329.
[26] SAIYACORK K R,SINSABAUGH R L,ZAK D R.The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil [J].Soil biology and biochemistry,2002,34(9):1309-1315.
[27] SINSABAUGH R L,TURNER B L,TALBOT J M,et al.Stoichiometry of microbial carbon use efficiency in soils[J].Ecological monographs,2016,86(2):172-189.
[28] CHEN L Y,LIU L,QIN S Q,et al.Regulation of priming effect by soil organic matter stability over a broad geographic scale[J].Nature communications,2019,10(1):1-10.
[29] 陳子豪,焦?jié)杀颍瑒⒅{,等.凋落物季節(jié)性輸入對川西亞高山森林土壤活性有機碳的影響[J].應用與環(huán)境生物學報,2021,27(3):594-600.
[30] LIU L,GUNDERSEN P,ZHANG T,et al.Effects of phosphorus addition on soil microbial biomass and community composition in three forest types in tropical China[J].Soil biology and biochemistry,2012,44(1):31-38.
[31] CHEN Y,LIN H,SHEN N,et al.Phosphorus release and recovery from Feenhanced primary sedimentation sludge via alkaline fermentation[J].Bioresource technology,2019,278:266-271.
[32] HARTMAN W H,RICHARDSON C J.Differential nutrient limitation of soil microbial Biomass and metabolic quotients(qCO2):Is there a biological stoichiometry of soil microbes?[J].PLoS One,2013,8(3):1-14.
[33] MOOSHAMMER M,WANEK W,SCHNECKER J,et al.Stoichiometric controls of nitrogen and phosphorus cycling in decomposing beech leaf litter[J].Ecology,2012,93(4):770-782.
[34] FENG J G,ZHU B.Global patterns and associated drivers of priming effect in response to nutrient addition[J].Soil biology and biochemistry,2021,153:1-11.
[35] 董冬玉,王丹婷,馬紅亮,等.添加葡萄糖對中亞熱帶闊葉林土壤氮轉化的影響[J].土壤,2019,51(1):19-24.
[36] CLEVELAND C C,TOWNSEND A R,SCHMIDT S K.Phosphorus limitation of microbial processes in moist tropical forests:Evidence from shortterm laboratory incubations and field studies[J].Ecosystems,2002,5(7):680-691.
[37] 吳玥,趙盼盼,林開淼,等.戴云山黃山松林土壤碳組分的海拔變化特征及影響因素[J].生態(tài)學報,2020,40(16):5761-5770.
[38] 向慧敏,溫達志,張玲玲,等.鼎湖山森林土壤活性碳及惰性碳沿海拔梯度的變化[J].生態(tài)學報,2015,35(18):6089-6099.
[39] 梅孔燦.凋落葉和磷添加對馬尾松林土壤激發(fā)效應的影響及機制[D].福州:福建師范大學,2021.
[40] 廖丹,于東升,趙永存,等.成都典型區(qū)水稻土有機碳組分構成及其影響因素研究[J].土壤學報,2015,52(3):517-527.
[41] SINSABAUGH R L.Phenol oxidase,peroxidase and organic matter dynamics of soil[J].Soil biology and biochemistry,2010,42(3):391-404.
[42] MEYER N,WELP G,RODIONOV A,et al.Nitrogen and phosphorus supply controls soil organic carbon mineralization in tropical topsoil and subsoil[J].Soil biology and biochemistry,2018,119:152-161.

