高粱鎘脅迫響應基因sbbHLH168的表達特征及生物信息學分析
于文慧 鄭佳 李楊華 楊明川 王雅利 張子路 龔利娟 康振輝

摘要[目的]以高梁基因sbbHLH168為研究對象,探究其耐鎘脅迫發熱分子機制,對培育耐鎘高粱提供了理論參考。[方法]從高粱品種“BTx623”鎘脅迫下轉錄組數據(RNA-seq)中篩選出一個受鎘脅迫后顯著上調表達的基因sbbHLH168,使用在線軟件對其生物信息進行分析;通過洋蔥表皮侵染進行亞細胞定位;構建pGBKT7-sbbHLH168載體驗證sbbHLH168基因的轉錄激活活性;將水培至四葉一心的高粱置于NaCl、PEG、ABA、ACC、GA和JA溶液處理,分別在0、1、12、24和48 h提取RNA,通過RT-qPCR檢測sbbHLH168基因的相對表達量。[結果]sbbHLH168基因的開放閱讀框長度為567 bp,編碼189個氨基酸殘基,蛋白分子量為20.55 kD,理論等電點(PI)為8.86,為堿性帶正電的蛋白,定位于細胞核,具有較強的轉錄激活活性。sbbHLH168基因在鹽、干旱和植物激素脅迫下表達量整體呈上升趨勢,但表達量在不同處理時間存在明顯差異。對sbbHLH168基因在不同組織中的表達發現,該基因在高粱的根和葉中均有表達,其中在鹽、干旱、ABA、GA和JA脅迫下,sbbHLH168基因在處理12 h時表達量最高。而在ACC處理時,則在處理24 h時表達量最高。[結論]sbbHLH168基因是一個定位在細胞核有轉錄激活活性的轉錄因子,屬于bHLH家族。
關鍵詞高粱;sbbHLH168;生物信息學分析;表達特征;轉錄激活活性
中圖分類號Q 81文獻標識碼A文章編號0517-6611(2023)24-0086-07
doi:10.3969/j.issn.0517-6611.2023.24.019
Expression and Bioinformatics Analysis of Cadmium Stress Response Gene sbbHLH168 in Sorghum bicolor
YU Wenhui1, ZHENG Jia2, LI Yanghua2 et al
(1.College of Bioengineering,Sichuan University of Science & Engineering,Yibin,Sichuan 644000;2. Wuliangye Group Co., Ltd., Yibin, Sichuan 644000)
Abstract[ Objective ]The study aimed to explore the molecular mechanism of cadmium stress tolerance in Sorghum bicolor gene sbbHLH168, which plays an important role in plant response to biotic and abiotic stresses, it provides a theoretical reference for breeding cadmiumtolerant Sorghum bicolor. [Method]A significantly upregulated sbbHLH168 was screened from the transcriptome data (RNAseq) of Sorghum bicolor cultivar ‘BTx623 under cadmium stress, and its biological information was analyzed by online software subcellular localization of sbbHLH168 gene was carried out by infection of onion epidermis, PGBKT7sbbHLH168 vector was constructed to verify the transcriptional activation activity of sbbHLH168 gene, and Sorghum bicolor plants cultured in water were treated with NaCl, PEG, ABA, ACC, GA and JA solutions, RNA was extracted at 0,1,12,24 and 48 hours respectively, and the relative expression of sbbHLH168 gene was detected by RTqPCR. [Result]The open reading frame length of sbbHLH168 gene was 567 bp, encoding 189 amino acid residues. The molecular weight of sbbHLH168 protein was 20.55 kDa, and the theoretical isoelectric point (PI) was 8.86. sbbHLH168 was a basic protein with positive charge, which was located in the nucleus of cells, it has strong transcriptional activation activity. The expression level of sbbHLH168 was increased under salt, drought and plant hormone stress, but the expression level was significantly different at different treatment time. The expression of sbbHLH168 gene in different tissues showed that sbbHLH168 gene was expressed in root and leaf of Sorghum bicolor, and the highest expression level was observed under salt, drought, ABA, GA and JA stress for 12 h. In ACC treatment, the highest expression level was observed at 24 h. [Conclusion]sbbHLH168 gene is a transcription factor with transcriptional activation activity located in the nucleus and belongs to bHLH family.
Key wordsSorghum bicolor;sbbHLH168;Bioinformatics analysis;Expression characteristics;Transcriptional activation activity
高粱[Sorghum bicolor(L.) Moench]屬于禾本科單子葉植物,具有較強的耐鹽堿、耐高溫和抗旱等抗逆特性。高粱的生產和生物量相較于其他糧食作物更高,因此是許多非洲和許多發展中國家的重要食物來源[1]。近年來,高粱受到真菌、重金屬、低溫、干旱等逆境脅迫的影響,嚴重影響高粱的產量和品質[2]。其中,鎘是植物生長發育的一種非必需元素,它很容易被根吸收,并通過木質部運輸到葉中。植物內鎘的積累會引起各種毒性癥狀,例如葉片變黃、萎蔫、生物量減少和細胞死亡等[3]。因此,對高粱抗逆脅迫基因進行研究具有重要意義。
自然界的植物在生長發育過程中不可避免地會受到許多生物和非生物脅迫的影響[4]。為了生存,植物本身必須利用廣泛的生理生化過程來應對各種壓力[5],這些反應通過激活或抑制基因特異性表達來進行調節[6]。基因特異性表達途徑之一是轉錄因子與順式元件的相互作用,特異性表達與環境脅迫有關的基因,以維持植物的正常生命活動[7]。轉錄因子(transcription factor,TF)又稱反式作用因子,其主要功能是激活或抑制基因的轉錄效應。通過轉錄因子的調控作用,可以利用轉錄因子來改良植物的抗逆性[8]。根據其DNA保守結構域的不同,可以分為AP2/EREBP、MADS、bZIP和MYB等若干個家族[9],在與植物抗逆性相關的轉錄因子家族中,bHLH家族是植物中僅次于MYB家族的第二大家族[10],它是由bHLH特征結構域定義的DNA結合蛋白超家族,該結構域包含參與DNA結合的基本區域和HLH區域充當的二聚結構域[11]。隨著分子生物學的發展和基因組序列的增加,越來越多的bHLH轉錄因子被鑒定出來。例如,花生(Arachis hypogaea Linn.)、短柄草[Brachypodium sylvaticum(Huds.) Beauv.]、蘋果(Malus pumila Mill.)和大豆[Glycine max(Linn.) Merr.]的基因組分別包含261、146、188和155個bHLH基因[9,12-13]。植物bHLH轉錄因子調節大量基因的表達,涉及廣泛的調節途徑[14],如植物次生代謝:水稻(Oryza sativa L.)bHLH家族成員OsbHLH148被證明通過調節茉莉酸信號參與介導耐寒性[15]。bHLH112增加了擬南芥(Arabidopsis thaliana)細胞的ABA 水平。擬南芥AtbHLH40則與赤霉素的合成轉導有關[16]。響應逆境脅迫:如AtbHLH12基因可以正向調控擬南芥對鹽、干旱及滲透脅迫的抵抗力[17];IbHLH1在蘋果對冷脅迫的適應中發揮重要作用[18]。控制細胞的生長:如水稻的稀穗突變體LAX是控制植株頂端分生組織的主要調節因子[19]。擬南芥SPATULA基因參與花形態建成和角果發育等多種發育過程[20]。AtbHLH95基因通過控制胚胎發育延緩植物的生長[21];擬南芥的AtbHLH21和水稻的OsbHLH164對花粉粒的形成及絨氈層細胞的發育有著關鍵的調控作用[22]。這些結果表明,bHLH轉錄因子除了調節植物生長發育之外,還在植物應對各種非生物脅迫中起著關鍵作用。已知的植物bHLH基因序列主要來源于水稻和擬南芥2種模式植物,對其他植物bHLH蛋白的功能研究還比較少[23]。
筆者從高粱鎘脅迫下的轉錄組數據中篩選出一個顯著上調表達的基因sbbHLH168。通過生物信息學等方法分析該基因的基本特征,并通過實時熒光定量PCR(quantitative real.time PCR,RT-qPCR)檢測sbbHLH168基因在不同非生物脅迫處理下在高粱根和葉中的相對表達量,了解其在抗逆脅迫中的作用,以期為sbbHLH168基因的研究提供理論依據。
1材料與方法
1.1試驗材料及主要試劑
試驗材料包括實驗室提供的高粱品種“BTx623”和P30-GFP載體,以及市場上購買的洋蔥(Allium cepa L.)。試驗所用試劑包括TRIzol試劑和DNA Maker DL 2000購自天根生化科技(TIANGEN)有限公司;PrimeScriptTM RT reagent kit with gDNA Eraser反轉錄試劑盒,TB Green Premix Ex TaqTM Ⅱ購于寶日醫(北京)生物技術有限公司,2×EasyTaq PCR SuperMix購自北京全式金(TransGen Biotech)生物技術有限公司。試驗所用設備為Genesy 96T基因擴增熱循環儀(西安天隆科技有限公司),TG16高速離心機(四川蜀科儀器有限公司),EF-UPR激光共聚焦顯微鏡(麥克奧迪實業集團有限公司),Nano Drop 2000分光光度計(Thermo Scientific,美國),凝膠成像系統(Bio-Rad,美國),RQH智能人工氣候培養箱(鄭州生元儀器有限公司),CFX96 Real-Time PCR System定量熒光PCR儀(Bio-Rad,美國),JY300E電泳儀(北京君意東方電泳設備有限公司)。
1.2試驗方法
1.2.1多種非生物脅迫處理。
將高粱種子置于水培盒中培養至四葉一心時進行鹽脅迫(100 mmol/L NaCl)和干旱脅迫(20% PEG 2 000)以及100 μmol/L ABA(脫落酸)、100 μmol/L ACC(乙烯合成前體)、100 μmol/L GA(赤霉素)和100 μmol/L JA(茉莉酸)處理。并在處理后的0(CK)、1、12、24和48 h分別取其根和葉組織樣品,置于液氮中速凍,剩余樣品于-80 ℃冰箱保存備用。每組試驗設置3次生物學重復[24]。
1.2.2高粱sbbHLH168基因的獲取和克隆。
通過對高粱品種“BTx623”進行鎘脅迫,從RNA-seq數據篩選到1個受鎘脅迫誘導顯著上調表達的sbbHLH168基因。根據Trizol試劑法提取各處理高粱根和葉組織樣品的RNA,并根據PrimeScriptTM RT reagent kit with gDNA Eraser反轉錄試劑盒說明書將RNA反轉錄為cDNA,使用Primer Premier 5.0設計引物(sbbHLH168F/R)(表1)。PCR反應體系為20.0 μL∶2.0 μL cDNA、上下游引物(10 μmol/L)各0.4 μL、2×EasyTaq PCR SuperMix 10 μL、6.4 μL ddH2O。PCR反應程序為預變性:95 ℃ 1 min;95 ℃ 20 s,58.6 ℃ 20 s,72 ℃ 30 s,進行35個循環;72 ℃ 5 min,4 ℃保存。將PCR產物用1%瓊脂糖凝膠電泳檢驗,將目的片段用DNA純化回收試劑盒回收后連接至PMD19-T(Simple)載體上,并轉化大腸桿菌trans5a感受態細胞,然后挑取陽性克隆提交至華大基因生物科技(重慶)有限公司測序。
1.2.3高粱sbbHLH168基因的相對表達量。
使用Beacon Designer 8.0設計定量引物(QsbbHLH168F/R)(表1)。以cDNA為模板,高粱sbPP2A基因為內參,通過Bio-Rad CFX96對樣品sbbHLH168的相對表達量進行檢測。反應體系為20.0 μL∶7.4 μL ddH2O、10 μL SYBR/TB Green II、7.4 μL RNase-free ddH2O、1.0 μL cDNA模板及定量引物(10 μmol/L)各0.8 μL,反應程序為預變性:95 ℃ 30 s,變性:95 ℃ 5 s,退火:60 ℃ 30 s,循環40次后進行融解曲線分析。每組試驗設3次生物學重復。使用GraphPad Prism 9.0軟件作圖,同時進行差異顯著性分析。
1.2.4sbbHLH168蛋白生物信息學分析。
利用NCBI在線工具查找sbbHLH168基因的CDS序列,通過Translate將其翻譯成氨基酸序列。使用Protein Blast對該氨基酸序列進行同源序列比對,將同源序列利用DNAMAN 8.0進行多重序列比對;使用MEGA 11.0軟件中的Neighbor-Joining構建同源序列的系統發育樹;利用Expasy在線工具Protparam和Protscale對sbbHLH168蛋白的等電點(PI)、分子量(MW)、不穩定系數、氨基酸組成和蛋白親水性進行分析;通過 TMpred Server程序預測sbbHLH168蛋白的跨膜區;利用SOPMA在線程序預測蛋白的二級結構。
1.2.5sbbHLH168蛋白的亞細胞定位。
通過引物sbbHLH168-SacI-F和sbbHLH168-BamHI-R(表1)進行PCR反應,得到含有SacI和BamHI酶切位點但不含終止密碼子的sbbHLH168全長CDS片段,經過雙酶切后連接到P30-GFP載體上。經過測序比對,將成功構建的質粒P30-sbbHLH168-GFP與P30-GFP 載體分別通過電擊法轉化到農桿菌EHA105中,并進行菌落PCR檢測。對驗證正確的陽性克隆置于YEB液體培養基中,于28 ℃,180 r/min振蕩培養至菌液OD600約為1.0,將菌液離心重懸后于無菌條件下侵染洋蔥下表皮細胞。將侵染后的洋蔥下表皮置于28 ℃暗培養,2 d后將洋蔥下表皮細胞分別在熒光顯微鏡的明場及綠色熒光通道下觀察。亞細胞定位載體P30-sbbHLH168-GFP構建見圖1。
1.2.6sbbHLH168蛋白的轉錄激活活性。
以cDNA為模板,用引物 sbbHLH168-BD-F/R(表1)進行PCR擴增,得到含有EcoRI和BamHI酶切位點的sbbHLH168全長cDNA,經雙酶切后連接到酵母雙雜交的誘餌載體pGBKT7上,酶切鑒定后通過PEG/LiAc法轉化至酵母Y2HGold感受態細胞中。同時轉化pGBKT7空質粒作為陰性對照,涂布于SD-Trp平板上,待菌落長出后挑取單菌落重懸于10 μL滅菌的雙蒸水中,取1 μL重懸液點在SD-Trp和SD-Trp/X-α-gal(α-半乳糖苷酶作用的發色底物)固體培養基上,通過觀察菌落是否變藍來檢測sbbHLH168蛋白的轉錄激活活性。
2結果與分析
2.1高粱sbbHLH168基因的表達量
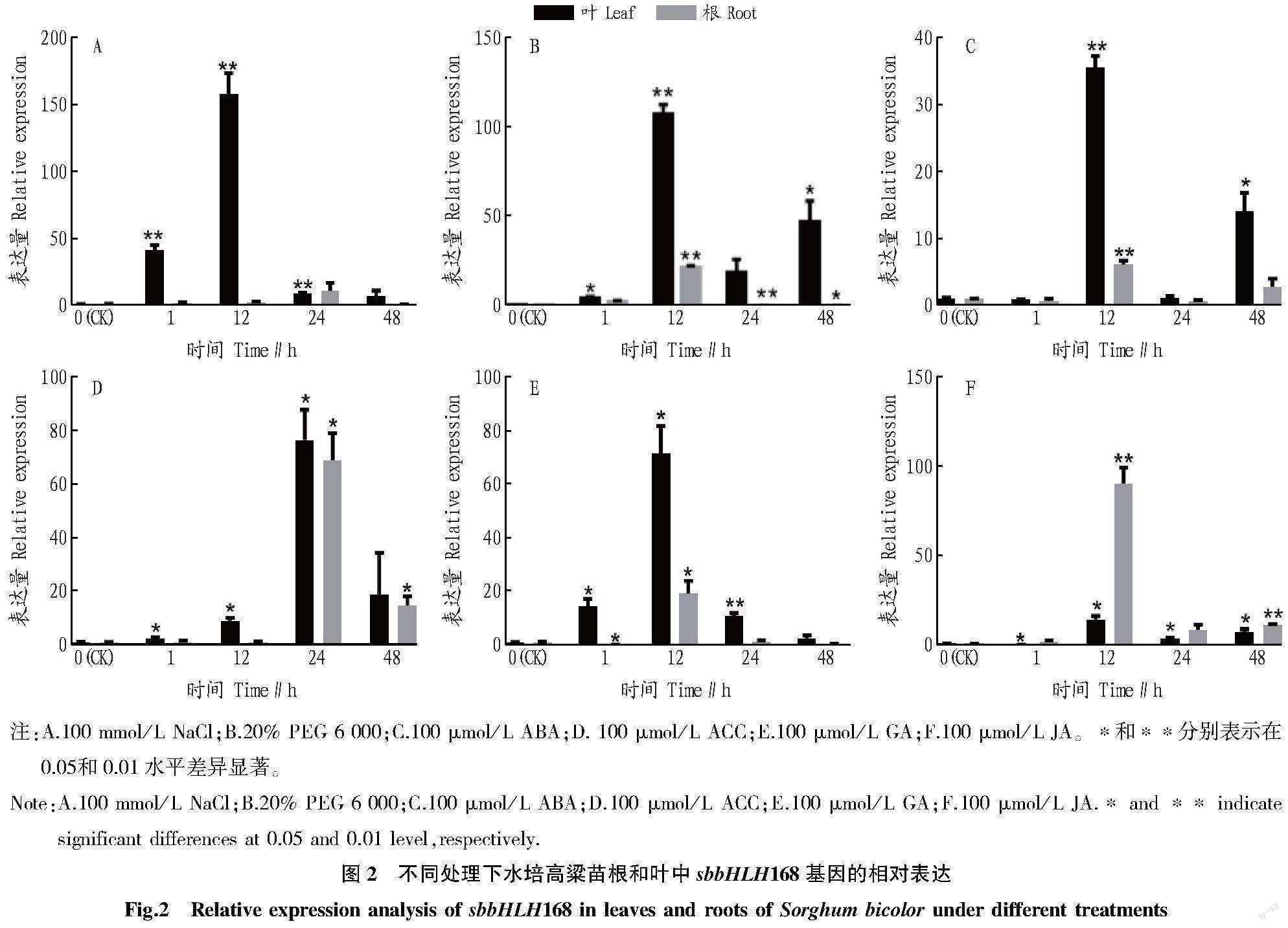
為進一步探究sbbHLH168基因的表達水平,將其進行不同非生物脅迫及植物生長物質處理。結果表明(圖2),sbbHLH168在根和葉中均有表達,并具有組織特異性,其中在葉中的表達量高,根中少。相較于CK,sbbHLH168均有差異性表達,其中鹽脅迫(NaCl)能顯著誘導其表達,呈先上升后下降的趨勢,對高粱葉的誘導在12 h達到最大值,根在24 h達到最大值。聚乙二醇(PEG)、脫落酸(ABA)和茉莉酸(JA)處理下,sbbHLH168基因的表達量呈上升—下降—上升的趨勢,均在12 h達到最大值。sbbHLH168在乙烯合成前體(ACC)和赤霉素(GA)處理下,其表達量呈現先上升后下降的趨勢,分別在24、12 h達到最大表達量。這表明NaCl、PEG、ABA、ACC、GA和JA等外源非生物脅迫處理可以誘導sbbHLH168的表達,從表達量看,sbbHLH168對NaCl的響應更加強烈。這表明sbbHLH168基因受NaCl、PEG、ABA、ACC、GA和JA等外源非生物脅迫處理的誘導,證明sbbHLH168基因參與高粱的非生物脅迫響應,正向調控其抵抗非生物脅迫的能力。
2.2蛋白的結構預測分析
sbbHLH168基因的開放閱讀框為567 bp,編碼189個氨基酸殘基。蛋白的一級結構預測表明,其分子量為20.55 kD,理論等電點為8.86。蛋白的氨基酸組成中陰性氨基酸(Asp + Glu)有25個,陽性氨基酸(Arg + Lys)有28個,屬于堿性蛋白,其不穩定系數為48.84,屬于不穩定蛋白。親/疏水性分析表明,sbbHLH168蛋白的平均親水系數為-0.286(圖3A),即該蛋白為疏水性蛋白。TMpred預測表明該蛋白不含跨膜區(圖3B)。保守結構域分析顯示,sbbHLH168基因的氨基酸序列在第1~60位有1個bHLH_SF結構域(圖3C),表明該蛋白屬于bHLH家族。
通過SOPMA對sbbHLH168氨基酸序列進行分析并預測其二級結構(圖4A、圖4B)。結果表明,sbbHLH168包含α螺旋、β轉角、無規則卷曲和延伸鏈,其中占比最多的是α螺旋(52.13%)和無規則卷曲(36.17%),其空間結構如圖所示(圖4C)。
2.3sbbHLH168蛋白定位在細胞核且有較強的轉錄激活活性
通過Cell-PLoc 2.0在線程序進行預測,結果表明該蛋白位于細胞核中。將sbbHLH168與GFP熒光信號融合表達,結果表明,GFP熒光蛋白在整個細胞中均有表達,而sbbHLH168和GFP融合蛋白僅在細胞核中表達(圖5A),說明sbbHLH168定位在細胞核中。轉錄激活活性分析表明,PGBKT7載體轉化的酵母僅能在SD/-Trp平板上生長,而PGBKT7-sbbHLH168轉化的酵母在SD/-Trp和SD/-Trp/X-a-gal平板上均能生長,且在含X-a-gal的平板上酵母菌落會變藍。說明sbbHLH168轉錄因子具有較強的轉錄激活活性(圖5B)。
2.4蛋白序列比對及系統發生樹分析
基于NCBI的Protein BLAST程序,比對與sbbHLH168同源的蛋白氨基酸序列。序列對比結果表明,sbbHLH168蛋白與南荻(Miscanthus lutarioriparius)的一致性最高,為77.5%。其次是穇[Eleusine coracana(Linn.) Gaertn.]64.4%、黍(Panicum hallii) 66.15%、黍稷(Panicum miliaceum)66.15%、柳枝稷(Panicum virgatum) 65.62%、小米(Setaria italica) 63.54%、彎葉畫眉草[Eragrostis curvula(Schrad.) Nees]62.23%、狗尾草(Setaria viridis)60.96%、二穗短柄草(Brachypodium distachyon) 57.98%等,均表現出較高的同源性。
運用MEGA 11.0軟件,通過Neighbor-Joining對篩選出的蛋白序列進行比對分析,構建系統發育樹,其中矯正參數值設置為1 000。高粱sbbHLH168和MICAD6211412.1、MICAD6203892.1、SbSORBI 3001G350300、SbBDA96 01G371800和MICAD6232386.1在同一分支,表明其與南荻親緣關系最近(圖6、7)。
3討論
植物在生長發育過程中易受到生物和非生物脅迫的影響,植物為了適應復雜的生長環境,在長期進化中,植物形成了多種抗脅迫的機制[25]。其中,bHLH基因參與植物代謝調節、生長發育及對環境信號反應等過程。該研究采用實時定量熒光PCR檢測高粱在NaCl、PEG、ABA、ACC、GA和JA處理下sbbHLH168基因的表達量,試驗結果表明,sbbHLH168基因在根和葉中的表達量整體呈上升趨勢,并且鹽脅迫能顯著誘導其表達,這表明sbbHLH168基因參與了高粱的非生物脅迫響應。目前許多前人的研究都可以證明bHLH基因響應植物的非生物脅迫,如在小麥中,通過TabHLH1基因對ABA途徑的調節,提高小麥對干旱的適應性[26]。水稻基因OsbHLH148過表達,調節JA途徑和OsJAZ(茉莉酸ZIM結構域)蛋白的功能[27]。PRE1的過表達激活了擬南芥中赤霉素依賴性反應[28]。bHLH39的過表達增加了小麥對鹽脅迫的耐受性[29]。35S:CSbHLH增強了轉基因擬南芥和黃瓜(Cucumis sativus L.)幼苗對NaCl和ABA的耐受性[30]。蘋果中的MdbHLH130通過維持ROS的穩態來提高轉基因煙草(Nicotiana tabacum L.)缺水脅迫的耐受性[31]。沙漠楊樹(Populus euphratica O.)的PebHLH35在擬南芥中的轉基因表達通過調節所得植物的氣孔發育和光合作用來增加對缺水脅迫的耐受性[32]。綜上所述,bHLH蛋白在植物響應逆境脅迫中發揮重要作用,可以提高植物抵抗不良環境的能力。今后可以通過構建sbbHLH168基因在植物中的過表達或敲除來進一步研究sbbHLH168基因在植物生長發育和抗逆脅迫過程的功能。
4結論
植物bHLH轉錄因子在植物的生長發育過程中發揮重要作用,但目前對于高粱bHLH轉錄因子的研究還缺乏深入研究。該研究以高粱sbbHLH168基因為研究對象,利用PCR技術成功克隆了該基因的cDNA全長序列,并在DNA水平上分析了其基因結構。采用各種生物信息學軟件對其編碼蛋白sbbHLH168的理化性質、親/疏水性、保守結構域和二級結構等進行分析,結果表明,sbbHLH168基因全長567 bp,編碼189個氨基酸;sbbHLH168蛋白二級結構多為無規則卷曲和a螺旋,是一種無跨膜區域的不穩定疏水性蛋白,具有HLH_SF結構域。系統進化關系分析表明,高粱sbbHLH168與南荻、穇和黍的親緣關系最近,與植物分類地位一致。
參考文獻
[1] 商靖,陸勁羽,逄洪波,等.SbGA20ox1·SbGA20ox3和SbGA2ox3基因對高粱品種赤霉素表達水平的影響[J].安徽農業科學,2022,50(2):105-108.
[2] 杜巧麗,蔣君梅,陳美晴,等.高粱轉錄因子SbWRKY71基因的克隆及其在逆境脅迫下的表達分析[J].核農學報,2021,35(7):1532-1539.
[3] CLEMENS S.Toxic metal accumulation,responses to exposure and mechanisms of tolerance in plants[J].Biochimie,2006,88(11):1707-1719.
[4] HOU L,LIU W,LI Z,et al.Identification and expression analysis of genes responsive to drought stress in peanut[J].Russ J Plant Physiol,2014,61(6):842-852.
[5] DENG Y Q,BAO J,YUAN F,et al.Exogenous hydrogen sulfide alleviates salt stress in wheat seedlings by decreasing Na+ content[J].Plant Growth Regul,2016,79(3):391-399.
[6] CHEN M,SONG J,WANG B S.NaCl increases the activity of the plasma membrane H+ATPase in C3 halophyte Suaeda salsa callus[J].Acta Physiol Plant,2010,32(1):27-36.
[7] 劉曉月,王文生,傅彬英.植物bHLH轉錄因子家族的功能研究進展[J].生物技術進展,2011,1(6):391-397.
[8] 楊致榮,王興春,李西明,等.高等植物轉錄因子的研究進展[J].遺傳,2004,26(3):403-408.
[9] 徐磊,胡小文,姚艷麗,等.甜高粱WRKY轉錄因子基因的克隆與表達分析[J].西南農業學報,2017,30(11):2429-2435.
[10] MAO K,DONG Q L,LI C,et al.Genome wide identification and characterization of apple bHLH transcription factors and expression analysis in response to drought and salt stress[J].Front Plant Sci,2017,8:1-15.
[11] CHEN W Q,ZHAO L R,LIU L,et al.Iron deficiencyinduced transcription factors bHLH38/100/101 negatively modulate flowering time in Arabidopsis thaliana[J].Plant Sci,2021,308:1-8.
[12] GAO C,SUN J L,WANG C Q,et al.Genomewide analysis of basic/helixloophelix gene family in peanut and assessment of its roles in pod development[J].PLoS One,2017,12(7):1-19.
[13] KAVAS M,BALOLU M C,ATABAY E S,et al.Genomewide characterization and expression analysis of common bean bHLH transcription factors in response to excess salt concentration[J].Mol Genet Genomics,2016,291(1):129-143.
[14] CASTELAIN M,HIR R L,BELLINI C.The nonDNAbinding bHLH transcription factor PRE3/bHLH135/ATBS1/TMO7 is involved in the regulation of light signaling pathway in Arabidopsis[J].Physiol Plant,2012,145(3):450-460.
[15] SEO J S,JOO J,KIM M J,et al.OsbHLH148,a basic helixloophelix protein,interacts with OsJAZ proteins in a jasmonate signaling pathway leading to drought tolerance in rice[J].Plant J,2011,65(6):907-921.
[16]ARNAUD N,GIRIN T,SOREFAN K,et al.Gibberellins control fruit patterning in Arabidopsis thaliana[J].Genes Dev,2010,24(19):2127-2132
[17] LIU W W,TAI H H,LI S S,et al.bHLH122 is important for drought and osmotic stress resistance in Arabidopsis and in the repression of ABA catabolism[J].New Phytol,2014,201(4):1192-1204.
[18] FENG X M,ZHAO Q,ZHAO L L,et al.The coldinduced basic helixloophelix transcription factor gene MdCIbHLH1 encodes an ICElike protein in apple[J].BMC Plant Biol,2012,12:1-14.
[19] KOMATSU K,MAEKAWA M,UJIIE S,et al.LAX and SPA:Major regulators of shoot branching in rice[J].Proc Natl Acad Sci USA,2003,100(20):11765-11770.
[20] HEISLER M G,ATKINSON A,BYLSTRA Y H,et al.SPATULA,a gene that controls development of carpel margin tissues in Arabidopsis,encodes a bHLH protein[J].Development,2001,128(7):1089-1098.
[21] KONDOU Y,NAKAZAWA M,KAWASHIMA M,et al.RETARDED GROWTH OF EMBRYO1,a new basic helixloophelix protein,expresses in endosperm to control embryo growth[J].Plant Physiol,2008,147(4):1924-1935.
[22] 鄭玲,代琪芳,陳雪冬.森林草莓bHLH家族基因的鑒定與分析[J].江蘇農業科學,2022,50(2):47-52.
[23] 楊夢婷,張春,王作平,等.玉米ZmbHLH161基因的克隆及功能研究[J].作物學報,2020,46(12):2008-2016.
[24] 李格,孟小慶,李宗蕓,等.甘薯鹽脅迫響應基因IbMYB3的表達特征及生物信息學分析[J].植物學報,2020,55(1):38-48.
[25] 樊鑄硼,羅興錄,單忠英,等.木薯SCARECROW-LIKE(SCL)基因克隆、生物信息學及非生物脅迫下表達分析[J].南方農業學報,2020,51(8):1888-1895.
[26] YANG T R,YAO S F,HAO L,et al.Wheat bHLHtype transcription factor gene TabHLH1 is crucial in mediating osmotic stresses tolerance through modulating largely the ABAassociated pathway[J].Plant Cell Rep,2016,35(11):2309-2323.
[27] KIRIBUCHI K,SUGIMORI M,TAKEDA M,et al.RERJ1,a jasmonic acidresponsive gene from rice,encodes a basic helixloophelix protein[J].Biochem Biophys Res Commun,2004,325(3):857-863.
[28] LEE S M,LEE S,YANG K Y,et al.Overexpression of PRE1 and its homologous genes activates Gibberellindependent responses in Arabidopsis thaliana[J].Plant Cell Physiol,2006,47(5):591-600.
[29] ZHAI Y Q,ZHANG L C,XIA C,et al.The wheat transcription factor,TabHLH39,improves tolerance to multiple abiotic stressors in transgenic plants[J].Biochem Biophys Res Commun,2016,473(4):1321-1327.
[30] LI J L,WANG T,HAN J,et al.Genomewide identification and characterization of cucumber bHLH family genes and the functional characterization of CsbHLH041 in NaCl and ABA tolerance in Arabidopsis and cucumber[J].BMC Plant Biol,2020,20(1):1-20.
[31] ZHAO Q,FAN Z H,QIU L N,et al.MdbHLH130,an apple bHLH transcription factor,confers water stress resistance by regulating stomatal closure and ROS homeostasis in transgenic tobacco[J].Front Plant Sci,2020,11:1-16.
[32] DONG Y,WANG C P,HAN X,et al.A novel bHLH transcription factor PebHLH35 from Populus euphratica confers drought tolerance through regulating stomatal development,photosynthesis and growth in Arabidopsis[J].Biochem Biophys Res Commun,2014,450(1):453-458.

