沉默長鏈非編碼RNA ANO1-AS1對食管鱗癌細胞遷移、侵襲的影響
張健 邵生輝 彭雅瓊 向輝 駱苗苗 石夢珍 鄭勇 陳衛剛
(石河子大學醫學院 1臨床醫學系,新疆 石河子 832000;2第一附屬醫院消化內科)
我國是世界上食管癌高發的國家,其中食管鱗狀細胞癌患者超過90%〔1〕。因食管癌早期多無明顯癥狀,使得大多數患者發現時已處于疾病晚期,從而導致該病預后較差,5年生存率為10%~20%〔2〕。在晚期或轉移性食管癌中,聯合化療的方案可明顯延長食管癌患者的生存率,但目前中位生存時間仍<1年〔3〕。因此,研究食管癌的分子機制,尋找可用于改善臨床診斷和治療的生物標志物至關重要。
長鏈非編碼RNA(LncRNA)是一類長度超過200個核苷酸的轉錄本,以前被認為是基因轉錄組的雜質,具有有限的蛋白質編碼潛能〔4〕。研究證實在腫瘤中,LncRNA可能成為調節癌基因和抑制癌基因之間的轉錄調節分子,并參與了許多癌癥細胞生長、遷移和血管生成等病理過程〔5〕。LncRNA的特異表現與癌癥的發生進展過程、轉移和化療耐藥有關,因此可以幫助確診、評估預后和提供診斷的靶點〔6〕。LncRNA ANO1-AS1位于人類染色體11q13.3上,大小為722個堿基。由鈣激活的氯離子通道基因反義鏈轉錄,為ANO1的反義LncRNA,其部分序列與ANO1基因編碼序列重疊,因此考慮LncRNA可能影響ANO1的功能表達。
本研究在前期研究中〔7,8〕,通過基因芯片技術分析比較食管鱗癌患者癌組織與癌旁正常組織中 LncRNA和mRNA的相對表達水平,發現食管鱗癌患者組織中有多種LncRNA、mRNA存在異常表達,其中LncRNA ANO1-AS1在食管鱗癌組織中表達較正常組織顯著上調,高達24倍,ANO1上調11倍(均P<0.05),實時熒光定量聚合酶鏈反應(qRT-PCR)實驗結果與芯片結果相一致。故推測LncRNA ANO1-AS1可能在食管鱗癌細胞中發揮重要作用。因此,本研究探討沉默LncRNA ANO1-AS1對食管鱗癌細胞遷移、侵襲的影響。
1 材料與方法
1.1主要材料與儀器 人食管鱗癌細胞系EC109、TE為石河子大學醫學院新疆地方與民族高發病重點實驗室留存;BI血清、胰蛋白酶、高糖DMEM 培養基均購于美國Gibco公司;RNA抽提試劑 Trizol、反轉錄試劑盒購于美國賽默飛公司;二甲基亞砜(DMSO)購于中國Solarbio公司;Transwell小室購于美國Corning公司;LncRNA ANO1-AS1、ANO1、和內參β-actin引物購于上海生工公司;qRT-PCR試劑盒購于德國QIAGEN公司;ANO1-AS1沉默(LV-sh-ANO1-AS1)慢病毒載體濃縮液購于漢恒生物科技(上海)有限公司;基質金屬蛋白酶(MMP)2、MMP9購于中國博奧森公司;ANO1、波形蛋白(Vimentin)、E-鈣黏蛋白(cadherin)購于英國 Abcam 公司;細胞外信號調節激酶(ERK)、p-ERK購于美國CST公司。
1.2細胞培養 37 ℃水浴鍋復蘇食管鱗癌EC109、TE細胞后,加入含有10%胎牛血清(FBS)的DMEM培養基,在37 ℃、50 ml/L CO2、95%濕度的培養箱內進行培養。細胞密度達到80%左右進行換液和傳代處理,細胞傳代2次后取狀態良好的細胞轉染LncRNA ANO1-AS1慢病毒實驗。
1.3細胞轉染及篩選 向食管癌細胞株(EC109、TE)轉染ANO1-AS1敲減慢病毒,細胞轉染所用 ANO1-AS1沉默慢病毒載體濃縮液均由漢恒生物科技(上海)有限公司完成,參照漢恒重組慢病毒使用手冊轉染慢病毒,沉默ANO1-AS1慢病毒序列為5′-GGAACCGGAATCAATCATTAT-3′、陰性對照序列為5′-TTCTCCGAACGTGTCACGT-3′。細胞接種于培養板,等細胞融合度為50%左右時加入病毒液,然后放入細胞培養箱,3~4 d后檢測熒光表達。沉默ANO1-AS1表達組命名為LV-sh-ANO1-AS1,陰性對照命名為LV-Con組,空白對照為Blank組。加入2~3 ng/ml嘌呤霉素于轉染慢病毒的細胞系中,逐代篩選出穩轉細胞株后,qRT-PCR實驗檢測各組細胞中LncRNA ANO1-AS1相對表達量。
1.4qRT-PCR檢測 培養食管鱗癌細胞,當細胞狀態較好且密度達到80%左右時收集待檢測細胞,磷酸鹽緩沖液(PBS)清洗后,采用Trizol試劑提取EC109和TE細胞中的總RNA。按照反轉錄試劑盒步驟要求合成cDNA后再進行qRT-PCR。根據羅氏qRT-PCR儀器的要求,反應條件為:95 ℃ 2 min;95 ℃ 10 s;60 ℃ 20 s;共40個循環。采用2-ΔΔCt法分析比較各組食管鱗癌細胞中目的基因的相對表達量。引物序列(5′-3′):LncRNA ANO1-AS1上游引物:CCAGTCCACAAAGTCGCTCA,下游:AGAGGTCAGGAGCACTTCCC;ANO1上游引物:GCTGTCTGG GCAGGCTTT,下游:CATCAGCCAGCAGATCCACA;β-actin上游引物:AACCGCGAGAAGATGACCCAG,下游:GGATAGCACAGCCTGGATAGCA。
1.5細胞劃痕實驗 將密度為5×105~10×105個/ml的食管鱗癌細胞懸液鋪在6孔板上,每孔加入含10% FBS的DMEM完全培養基2 ml,培養16~24 h。待其完全貼壁且細胞密度達到80%左右后,用1 ml移液器吸頭在細胞上呈“一”字劃痕,PBS清洗后,加入完全培養基,分別在0、48 h觀察并拍照。
1.6遷移和侵襲實驗 遷移實驗:采用Corming公司孔徑為0.8 μm的小室,在上室內加入200 μl細胞懸液;下室內加入600 μl含10 % FBS的完全培養基。于48 h后取出Transwell小室,棄去孔中培養液,PBS清洗3遍且每遍均用潔凈棉簽擦拭小室內測底面,4%多聚甲醛固定30~40 min,0.1%結晶紫染色30 min,沖洗染液后,用清潔棉簽再次擦拭上層未遷移細胞。將晾干的小室在顯微鏡下隨機取5個視野觀察并記錄遷移細胞數。侵襲實驗:稀釋基質膠與無血清培養基之比8∶1,鋪于小室內測底部,37 ℃、30 min使基質膠聚合成凝膠。加入無血清培養基使其液化,半小時后棄去培養基,其余操作方法與細胞遷移實驗相同。
1.7Western印跡法檢測蛋白表達 將6孔板中的各組細胞用PBS清洗后,每孔加入含有1%苯甲基磺酰氟(PMSF)的RIPA裂解液1 ml,提取細胞總蛋白,檢測提取液中蛋白濃度。在提取液中加入1/4蛋白樣品體積的5×上樣緩沖液,而后100 ℃、10 min進行煮沸,于-80 ℃冰箱儲存樣品。采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)進行蛋白電泳,80 V恒壓2 h后裁膠,將蛋白轉印到聚偏氟乙烯(PVDF)膜上。將PVDF膜放入含5%牛血清白蛋白(BSA)封閉液中封閉3 h,Tris鹽酸緩沖液吐溫(TBST)洗滌后,以1∶1 000濃度加入一抗,4 ℃冰箱搖床過夜。第二日回收一抗,1×TBST洗滌PVDF膜3次,每次10 min,加入不同濃度二抗,室溫孵育1 h,1×TBST洗膜3次后曝光。ImageJ軟件分析測定各蛋白條帶的灰度值,選擇β-actin蛋白條帶作為內參條帶進行標準化,計算各蛋白的相對表達量。
1.8統計學方法 采用Prism5.0和SPSS17.0軟件進行分析,兩組間比較采用獨立樣本t檢驗,3組間比較使用單因素方差分析(符合正態分布及方差齊性),不符合正態分布及方差不齊則使用非參數秩和檢驗。
2 結 果
2.1培養EC109和TE細胞并構建LncRNA ANO1-AS1慢病毒載體細胞 按照使用手冊轉染慢病毒,用嘌呤霉素篩選3次之后,在熒光倒置顯微鏡下觀察24孔板中的食管鱗癌細胞,記錄綠色熒光細胞數目,發現兩種食管癌細胞轉染率均在85%以上。見圖1。

圖1 熒光倒置顯微鏡下觀察綠色熒光 細胞數目(相差顯微鏡,×40)
2.2qRT-PCR檢測LncRNA ANO1-AS1、ANO1 mRNA表達 EC109及TE細胞中,LV-sh-ANO1-AS1組ANO1-AS1、ANO1 mRNA表達水平顯著低于LV-Con組和Blank組(P<0.05)。見表1。
2.3細胞劃痕實驗結果 在EC109和TE細胞中,LV-sh-ANO1-AS1組劃痕愈合率明顯低于LV-Con組和Blank組(P<0.05)。見表1、圖2。
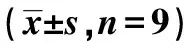
表1 各組EC109和TE細胞中劃痕愈合率、LncRNA ANO1-AS1和ANO1 mRNA相對表達量

圖2 3組EC109和TE細胞劃痕愈合率(相差顯微鏡,×40)
2.4遷移和侵襲實驗結果 LV-sh-ANO1-AS1組EC109和TE細胞遷移、侵襲細胞數明顯少于LV-Con組和Blank組(P<0.05)。說明抑制LncRNA ANO1-AS1表達可抑制EC109和TE細胞的遷移及侵襲能力。見表2、圖3。
2.5Western印跡檢測p-ERK和ANO1蛋白表達 在EC109和TE細胞中,LV-sh-ANO1-AS1組p-ERK、ANO1蛋白表達水平明顯低于LV-Con組和Blank組(P<0.05)。見表2、圖4。
2.6Western印跡檢測MMP2、MMP9及EMT相關蛋白表達 EC109和TE細胞中LV-sh-ANO1-AS1組MMP2、MMP9及Vitmentin蛋白表達顯著低于LV-Con組和Blank組(P<0.05)。EC109和TE細胞中LV-sh-ANO1-AS1組E-cadherin表達水平顯著高于LV-Con組和Blank組(P<0.05)。見圖4、表3。
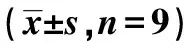
表2 EC109和TE細胞中遷移、侵襲細胞數及p-ERK、ANO1蛋白相對表達比較

圖3 敲低LncRNA ANO1-AS1表達對EC109和TE細胞遷移、侵襲能力的影響(結晶紫染色,×100)
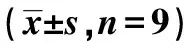
表3 EC109和TE細胞中MMP2、MMP9、Vimentin及E-cadherin蛋白相對表達比較
3 討 論
有研究表明,在人類基因組中,僅有少于2%的核酸序列可編碼各類蛋白質,其余98%的核酸序列均為不具備蛋白編碼功能的LncRNA〔9〕。食管鱗癌的發生發展過程與LncRNA密切相關,許多LncRNA參與了食管鱗狀細胞癌的疾病進程。如 LncRNA NKILA在食管鱗狀細胞癌中顯著下調,研究表明轉化生長因子(TGF)-β誘導的 NKILA可以通過抑制 IκBα和核轉錄因子(NF)-κB磷酸化來影響MMP14表達,從而抑制食管鱗癌細胞的轉移〔10〕。超級增強子驅動的LncRNA LINC01503在鱗狀細胞癌中表達明顯升高,受到TP63調控且可激活ERK通路,增強蛋白激酶B(AKT)信號傳導,促進食管鱗癌細胞增殖、遷移、侵襲和移植瘤的生長〔11〕。本研究證明,敲減LncRNA ANO1-AS1可抑制食管癌細胞的遷移和侵襲能力,推測其機制可能與腫瘤微環境中細胞外基質(ECM)的降解和基底膜(BM)的破壞有關。MMP是一類依賴鋅和鈣的內肽酶,它們分泌或錨定在細胞膜中,能夠降解ECM的多種成分,在癌癥的侵襲中起著突出的作用〔12〕。已有研究表明,MMPs與食管癌的侵襲、轉移關系密切〔13,14〕。MMP2、MMP9是MMPs家族中兩個重要組成因子,研究顯示,LncRNA CARLo-5可通過下調MMP2、MMP9的表達抑制ESCC的侵襲轉移〔15〕。本研究結果提示,LncRNA ANO1-AS1可能通過影響MMP2、MMP9的表達參與食管鱗癌細胞的遷移和侵襲進程,MMP9與MMP2一起被認為是與侵襲和轉移相關的一致進展標志物,MMPs之間存在交互激活作用,此交互激活可能增強其在上皮間質轉化(EMT)進程中的作用。EMT進程是指由于內皮源性腫瘤細胞的內皮黏附因子E-cadherin減少和收縮細胞骨架的蛋白Vimentin增加,導致細胞形態向間充質細胞轉變,這一過程將上皮細胞從基底膜上分離,從而為腫瘤細胞的遷移做準備〔16,17〕。E-cadherin和 Vimentin分別為上皮細胞和間質細胞的標志分子,多項研究發現,二者在多種上皮腫瘤中異常表達,并與癌細胞的分化、侵襲和轉移密切相關〔18,19〕。同樣,本研究結果也表明,LncRNA ANO1-AS1可能通過調控EMT進程影響食管鱗癌細胞遷移和侵襲能力。
ERK/絲裂原活化蛋白激酶(MAPK)信號通路與腫瘤發生關系密切,在腫瘤侵襲和轉移中起重要作用〔20〕。有研究表明,ERK/MAPK信號傳導途徑的激活可以通過上調MMPs表達增加腫瘤侵襲和轉移,而抑制該信號傳導途徑可減少腫瘤侵襲和轉移〔21,22〕,與本文結果相一致。ERK/MAPK 信號通路在多種癌癥中表達失調,本文發現,在食管癌中LncRNA ANO1-AS1可能通過p-ERK參與ERK/MAPK 信號通路的調控,但其具體機制仍有待研究。此外,本研究還提示,mRNA ANO1可能為LncRNA ANO1-AS1的下游靶基因,后期可進一步實驗探究LncRNA ANO1-AS1和ANO1在食管癌中具體的調控機制。
綜上,食管癌組織和細胞中高表達的LncRNA ANO1-AS1可能通過ERK/MAPK信號通路調控MMP2、MMP9、E-cadherin和Vimentin的蛋白表達,進而參與食管鱗狀細胞癌的遷移、侵襲過程。LncRNA ANO1-AS1在食管鱗狀細胞癌中扮演著促癌基因的作用,可能成為食管鱗狀細胞癌潛在早期診斷分子標志物及治療靶點。

