低溫燉煮燕窩增強免疫功能研究
陰佳璐,袁滿,鄂敬文,周時蒙,張悅,王東亮
1.河北省燕窩鮮燉技術創新中心(廊坊 065700);2.中國檢驗檢疫科學研究院綜合檢測中心(北京 100176)
免疫包含先天性免疫和適應性免疫,是人體重要的保護性生理功能[1]。免疫力低下容易受到外界病原體的感染,從而更容易患上各種疾病,因此增強免疫有助于預防感染性疾病、惡性腫瘤和自身免疫性疾病的發生,對維持人體健康具有重要意義[2-3]。免疫系統由免疫器官、免疫細胞和免疫因子三部分組成,這些指標的變化代表機體免疫功能的改變[4]。現代科學研究表明,功能性食品在增強人類健康狀況、降低患病風險方面起著重要作用,可作為滿足消費者提升免疫需求首要選擇[5]。
燕窩是金絲燕利用其唾液分泌物與羽毛或草屑而制成的巢穴,作為傳統中式滋補品,距今有600多年食用歷史[6]。燕窩因其營養價值、藥用價值和經濟價值,已成為我國重要的產業,據統計2021年燕窩行業總銷售額已突破400億元。燕窩主產地分布在印度尼西亞、馬來西亞、泰國等東南亞地區[7]。現代科學研究顯示,燕窩中含有蛋白質、唾液酸、礦物質等多種營養成分。蛋白質作為燕窩的主要成分,其含量可達到燕窩干重的42%~63%。此外,唾液酸在燕窩的生物活性中也起著重要作用,含量占比一般為7%~12%[8-10]。古籍記載燕窩具有潤肺滋陰、調補虛勞、化痰止咳、益氣補中、潤腸開胃等效用[11]。隨著現代科學技術的發展,研究顯示燕窩具有調節免疫、抗病毒、改善皮膚、抗氧化、促進神經發育、維護骨骼和關節健康等多種作用[12-13]。
體外及體內的研究表明,干燕窩可通過調節巨噬細胞、脾淋巴細胞等免疫細胞功能,以及調節IFN-γ、TNF等免疫因子水平起到增強免疫作用[14-17]。但仍缺乏對燉煮燕窩調節免疫作用相關研究,并且缺乏有效劑量證明。因此,采用正常小鼠模型進行試驗,探討低溫燉煮燕窩體內免疫調節作用,可為低溫燉煮燕窩進一步作為增強免疫功能性食品的開發和應用提供理論依據。
1 材料與方法
1.1 材料與儀器
低溫燉煮燕窩(北京小仙燉生物科技有限公司提供,經凍干處理后得到凍干粉)。超凈工作臺(蘇州安泰有限公司);二氧化碳培養箱(上海一恒有限公司);離心機(sigma有限公司);恒溫水浴鍋(力辰科技有限公司);酶標儀(賽默飛有限公司);綿羊紅細胞(SRBC)、雞紅細胞、生理鹽水、Hank’s液(pH 7.2)、RPMI-1640培養液、小牛血清、青鏈霉素、刀豆蛋白A(ConA)、1%冰醋酸、1mol/L的HCl、異丙醇、瓊脂糖、YAC-1細胞、MTT、PBS緩沖液、補體(豚鼠血清)、SA緩沖液、乳酸鋰、碘硝基氯化四氮唑、吩嗪二甲酯硫酸鹽、氧化型輔酶Ⅰ、Tris-HCl、文齊氏試劑、1% NP40、印度墨汁、0.1%Na2CO3、Giemsa染液等:所有試劑均采購自上海麥克林生化科技股份有限公司。
試驗使用體重18~22 g的SPF級雌性ICR小鼠[許可證號SCXK(京)2021-0006,北京維通利華實驗動物技術有限公司]。小鼠飼養期間自由攝入食物及飲水,飼料喂以塊狀標準(SPF級)飼料,動物飼料來自北京科澳協力飼料有限公司[許可證號SCXK(京)2019-0003]。動物房溫度恒定在20~26 ℃,濕度維持在40%~70%。
試驗設置空白對照組及低、中、高劑量低溫燉煮燕窩組。采用經口灌胃的方式進行,低、中、高劑量設為人體推薦低溫燉煮燕窩食用量的5,10和30倍,即0.188,0.375和1.125 g/kg。按0.2 mL/(10 g·Bw)給予灌胃。連續灌胃30 d,每周根據體重調整灌胃量。選用正常動物模型,隨機選取192只ICR小鼠,平均分為4個免疫指標組。免疫指標1組進行遲發型變態反應試驗、臟器/體重比值、半數溶血值測定和抗體生成細胞檢測;免疫指標2組進行碳廓清試驗;免疫指標3組進行巨噬細胞吞噬雞紅細胞能力試驗;免疫指標4組進行ConA誘導小鼠淋巴細胞轉化試驗和NK活性測定試驗。
1.2 試驗方法
1.2.1 小鼠臟器/體重比值測定
小鼠稱重后頸椎脫臼處死,取脾臟和胸腺,去盡筋膜,用濾紙吸干臟器表面血污,稱重,計算脾臟/體重比值和胸腺/體重比值。
1.2.2 足跖增厚法測定遲發型變態反應
取新鮮的脫纖維羊血,生理鹽水洗滌3次,每只小鼠腹腔注射0.2 mL 2%(V/V,用生理鹽水配制)SRBC,致敏后4 d測量左后足跖部厚度,同一部位測量3次,取平均值。在測量部位皮下注射20 μL 20%(V/V,用生理鹽水配制)SRBC,注射后于24 h測量左后足跖部厚度,同一部位測量3次取平均值,以攻擊前后足跖厚度的差值表示遲發型變態反應的程度。
1.2.3 ConA誘導的小鼠淋巴細胞轉化試驗
小鼠處死后在75%酒精的燒杯中滅菌10 min后,無菌取脾,置于裝有高壓滅菌的3 cm×3 cm的4層紗布的無菌平皿中,加入適量無菌Hank’s液,用紗布將脾包住,用彎頭鑷輕輕將脾磨碎,制成單細胞懸液,用Hank’s液洗3次,每次按1 000 r/min離心10 min,計數活細胞數,調整細胞濃度2×107個/mL,取0.4 mL細胞懸液分兩孔加入24孔板中,總體積每孔1 mL,其中一孔加入75 μL ConA液,另一孔作為對照,置于5% CO2,37 ℃培養72 h。在培養結束前4 h,每孔輕輕吸取0.7 mL上清液,加入0.7 mL不含小牛血清的RPMI1640培養液,同時每孔加入50 μL 5 mg/mL MTT,繼續培養4 h。培養結束后,每孔加入1 mL酸性異丙醇,吹打均勻,使紫色結晶完全溶解。移入96孔板中,在酶標儀上進行測定,波長為570 nm。
1.2.4 抗體生成細胞檢測試驗
取新鮮的脫纖維羊血,用生理鹽水洗滌3次,每只小鼠腹腔注射0.2 mL 2%(V/V,用生理鹽水配制)SRBC,致敏后4 d處死小鼠,取全脾制成細胞懸液,加入8 mL Hank’s溶液。將表層培養基加熱溶解后,與等量雙倍Hank’s液混合,分裝小試管,每管0.5 mL,向管內加50 μL 10%(V/V,用SA緩沖液配制)壓積SRBC和20 μL脾細胞懸液,迅速混勻,傾倒至已刷瓊脂糖薄層的玻片上;待瓊脂凝固后,將玻片水平扣放在片架上,放入CO2培養箱中繼續孵育1.5 h,用SA緩沖液稀釋的補體(1︰8)放入玻片架凹槽內,繼續孵育2.0 h,計數溶血空斑數。
1.2.5 血清溶血素半數溶血值(HC50)的測定
取新鮮的脫纖維羊血,用生理鹽水洗滌3次(2 000 r/min,10 min),每只鼠腹腔注射0.2 mL 2%(V/V,用生理鹽水配制)壓積SRBC,致敏后4 d,摘除眼球取血于1.5 mL離心管內,放置約1 h,使血清充分析出,按2 000 r/min離心10 min,收集血清。用SA緩沖液稀釋300倍,將0.1 mL稀釋后的血清置96孔板內,依次加入0.05 mL 10%(V/V)SRBC和0.1 mL(用SA緩沖液按1︰8稀釋)補體,置于37 ℃恒溫水浴保溫30 min,冰浴終止反應。按1 500 r/min離心10 min,取0.05 mL上清液,加0.15 mL文齊氏試劑,同時,取0.012 5 mL 10%(V/V,用SA緩沖液配制)壓積 SRBC,加文齊氏試劑至0.2 mL,至另一96孔板,充分混勻。放置10 min后,在540 nm波長下,用酶標儀分別測定各孔光密度。溶血素的量以半數溶血值(HC50)表示。
1.2.6 小鼠碳廓清試驗
給予小鼠尾靜脈注射用生理鹽水4倍稀釋的印度墨汁,待墨汁注入后,立即計時。分別在注入墨汁后的2 min和10 min后,從眼內眥靜脈叢取20 μL血,并將其加到2 mL 0.1% Na2CO3溶液中,用酶標儀在600 nm波長處測定光密度,以Na2CO3溶液作空白對照,其中注入墨汁后的2 min所取血標本光密度記為OD1,注入墨汁后的10 min所取血標本光密度記為OD2。小鼠稱重處死后取肝臟、脾臟稱重。根據動物體重、肝重和脾重計算吞噬指數。按式(3)和(4)計算吞噬指數a。
1.2.7 小鼠腹腔巨噬細胞吞噬雞紅細胞試驗
每只小鼠腹腔注射1 mL 5%壓積雞紅細胞懸液。間隔2.5 h,頸椎脫臼處死動物,將其仰位,正中剪開腹壁皮膚,經腹腔注射2 mL生理鹽水,轉動小鼠1 min。吸出1 mL腹腔洗液,平均分滴于2片載玻片上,放入墊有濕紗布的搪瓷盒內,移至37 ℃孵箱孵育30 min。孵畢,于生理鹽水中漂洗,以除去未貼片細胞,晾干。以1︰1丙酮-甲醇溶液固定(V/V,1︰1配制),經4%(V/V)Giemsa-磷酸鹽緩沖液染色3 min,用蒸餾水漂洗晾干。油鏡下計數吞噬雞紅細胞的巨噬細胞數及被吞噬的雞紅細胞總數,每張片計數100個,按式(5)和(6)計算吞噬百分率和吞噬指數。
1.2.8 NK細胞活性測定試驗
前24 h將靶細胞YAC-1進行傳代培養,用前以Hank’s液洗3次,用含10%胎牛血清的RPMI1640完全培養液調整細胞濃度為4×105個/mL。小鼠頸椎脫臼處死,無菌取脾,制成脾細胞懸液,用Hank’s液洗3次,按1 000 r/min離心10 min,用1 mL含10%小牛血清的RPMI1640完全培養基重懸,用臺盼藍活細胞染色計數(活細胞數應在95%以上),調整細胞濃度為2×107個/mL,使效靶比50︰1。取靶細胞和效應細胞各100 μL,加入U型96孔培養板中,靶細胞自然釋放孔加靶細胞和培養液各100 μL,靶細胞最大釋放孔加靶細胞和1% NP40各100 μL,上述均設3個平行孔,在37 ℃,5% CO2培養4 h,將96孔培養板以1 500 r/min離心5 min,每孔吸取100 μL上清液置平底96孔培養板中,同時加入100 μL LDH基質液,避光反應10 min,每孔加入30 μL 1 mol/L的HCl溶液終止反應,在酶標儀492 nm處測光密度。NK活性按式(7)計算。
1.3 數據處理
試驗所得數據均采用GraphPad Prism 9.4數據處理系統進行統計學分析。數據以“平均值±標準差”(Mean±SD)的形式表示。組間比較采用LSD檢驗。
2 結果與分析
2.1 低溫燉煮燕窩對小鼠免疫臟器/體重比值的影響
低溫燉煮燕窩對小鼠胸腺及脾臟質量比值的影響如表1所示。胸腺和脾臟是機體重要的免疫器官,可通過調節免疫反應在機體免疫功能中發揮重要作用,它們的質量比值在一定程度上表明機體先天免疫的能力[4]。試驗中,經口給予小鼠不同劑量低溫燉煮燕窩30 d,與空白對照組相比,小鼠胸腺/體重比值和脾臟/體重比值無顯著性差異(P>0.05),表明低溫燉煮燕窩對免疫器官指數無影響。
表1 低溫燉煮燕窩對小鼠臟器/體重比值的影響(±SD,n=12)
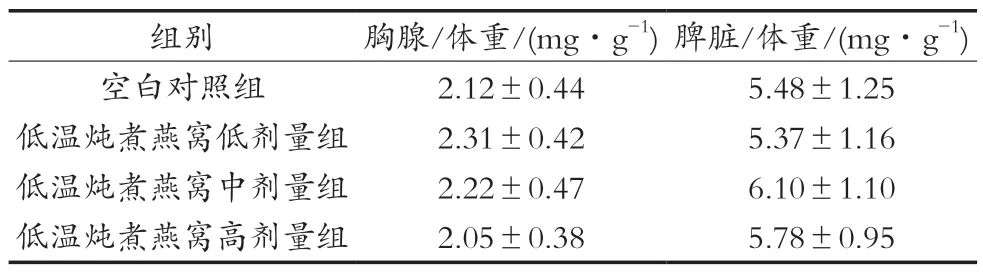
表1 低溫燉煮燕窩對小鼠臟器/體重比值的影響(±SD,n=12)
2.2 低溫燉煮燕窩對小鼠細胞免疫功能的影響
遲發型變態反應是由于抗原進入機體后,細胞在局部接受抗原信息轉化為致敏淋巴細胞。致敏淋巴細胞再次接觸相同抗原時,釋放出多種淋巴因子,促使血流中單核細胞向局部聚集和吞噬抗原。遲發型變態反應是以淋巴細胞和單核-巨噬細胞浸潤為主的滲出性炎癥,因此可通過測量皮膚再次受相同抗原刺激后的腫脹厚度反映細胞免疫功能的強弱[18]。試驗結果如表2所示,小鼠足趾腫脹度在各劑量組與對照組間比較無顯著性差異。
表2 低溫燉煮燕窩對小鼠足趾腫脹和ConA誘導的小鼠淋巴細胞轉化試驗的影響(±SD,n=12)
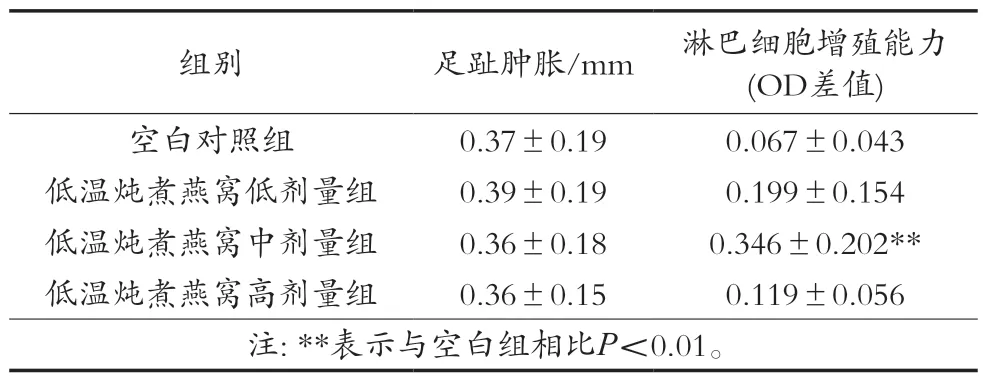
表2 低溫燉煮燕窩對小鼠足趾腫脹和ConA誘導的小鼠淋巴細胞轉化試驗的影響(±SD,n=12)
淋巴細胞是適應性免疫反應的關鍵參與細胞,主要負責激活抗原呈遞和有絲分裂原刺激過程。脾臟淋巴細胞增殖是激活細胞和體液免疫反應的重要生物標志物,而這種活性是由有絲分裂原ConA誘導,通常用于評估T或B淋巴細胞活性[19-22]。低溫燉煮燕窩對小鼠淋巴細胞增殖試驗結果如表2所示,低溫燉煮燕窩中劑量組可以顯著促進ConA刺激的脾淋巴細胞增殖(P<0.01)。
2.3 低溫燉煮燕窩對小鼠體液免疫功能的影響
溶血空斑試驗是一種定量測量樣品增強體液免疫反應的方法,可用于檢測和計數產生IgM及其他類型免疫球蛋白的抗體生成細胞(漿細胞),溶血空斑數即為抗體生成細胞數,可用于表征體液免疫功能強弱[23]。低溫燉煮燕窩對小鼠抗體生成細胞數如表3所示,各劑量組均可以顯著增加小鼠抗體生成細胞數(P<0.01)。此外,血清溶血素水平作為體液免疫的重要指標,可以反映B細胞與特定抗原接觸后分泌溶血素的能力[24]。小鼠半數溶血值(HC50)在高、中、低劑量與對照組間比較均無顯著性差異(P>0.05)。
表3 低溫燉煮燕窩對抗體生成細胞數和HC50的影響(±SD,n=12)
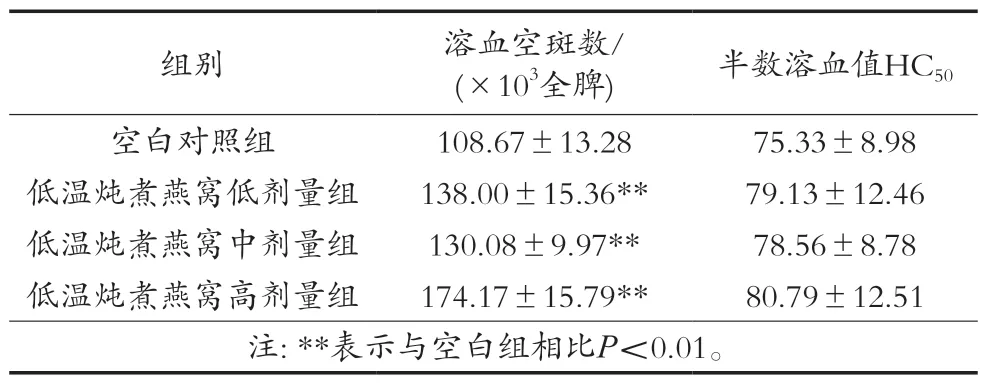
表3 低溫燉煮燕窩對抗體生成細胞數和HC50的影響(±SD,n=12)
2.4 低溫燉煮燕窩對小鼠單核-巨噬細胞吞噬功能的影響
碳廓清試驗可以評估樣品對網狀內皮系統(reticuloendothelial system,RES)的影響,RES是由吞噬細胞組成的彌散系統,RES細胞在從血流中清除顆粒方面起著至關重要的作用[25]。當小鼠靜脈注射含有膠體碳的墨水時,巨噬細胞會吞噬墨水中的碳顆粒,墨水(碳顆粒)從血液中清除的速度稱為吞噬指數,吞噬細胞在宿主防御中起著不可或缺的作用[26]。如表4所示,高劑量組低溫燉煮燕窩增加血液中膠體碳的清除率,顯著提高吞噬指數,這可能是因為高劑量組低溫燉煮燕窩組小鼠RES活性增加所致。
表4 低溫燉煮燕窩對小鼠單核-巨噬細胞碳廓清能力和小鼠巨噬細胞吞噬雞紅細胞能力的影響(±SD,n=12)
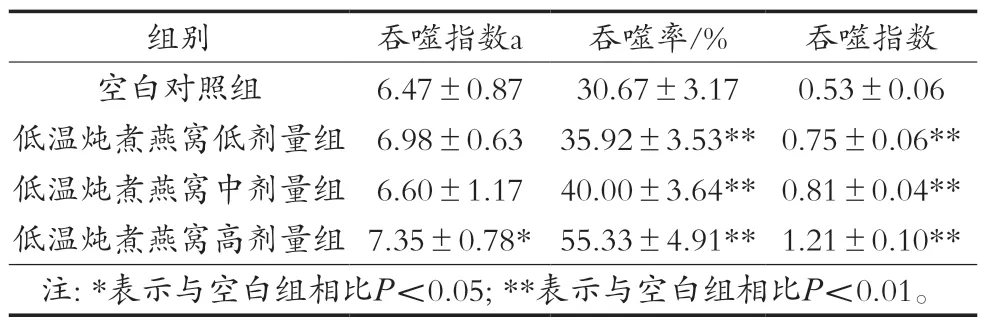
表4 低溫燉煮燕窩對小鼠單核-巨噬細胞碳廓清能力和小鼠巨噬細胞吞噬雞紅細胞能力的影響(±SD,n=12)
吞噬細胞包括單核巨噬細胞和中性粒細胞,具有對顆粒性異物進行吞噬和消化的功能,在機體固有性免疫中發揮重要作用。小鼠腹腔注射雞紅細胞后,會被腹腔中的巨噬細胞吞噬。因此通過計算腹腔巨噬細胞吞噬百分率和吞噬指數,可有效評估小鼠吞噬細胞的吞噬功能[27]。試驗結果如表4所示,各劑量組低溫燉煮燕窩均可以顯著提高小鼠巨噬細胞吞噬率及吞噬指數(P<0.01)。
2.5 低溫燉煮燕窩對小鼠NK細胞活性的影響
NK細胞處于保護機體免受病原體侵襲和感染的第一道防線,以非特異性殺死病原體和受感染細胞而聞名,證明NK細胞在免疫系統的早期階段控制感染中發揮作用[28-29]。NK細胞還可通過釋放免疫調節細胞因子和趨化因子、調節DC活性及粒細胞生長和分化調節免疫反應,NK細胞在先天性免疫反應中發揮重要作用,并起到從先天性免疫反應到適應性免疫反應的橋梁作用[30]。
因此為確定低溫燉煮燕窩對NK細胞活性影響,測定從共培養的脾細胞和YAC-1細胞獲得的上清液中乳酸脫氫酶(LDH)的相對量。試驗結果如表5所示,與空白對照組相比,低中劑量組低溫燉煮燕窩的NK細胞活性無顯著性影響,而高劑量組低溫燉煮燕窩可以顯著促進NK細胞活性(P<0.05),表明低溫燉煮燕窩具有通過NK細胞自身誘導的調節機制來改善免疫系統的潛力。
表5 低溫燉煮燕窩對小鼠NK細胞活性的影響(±SD,n=12)

表5 低溫燉煮燕窩對小鼠NK細胞活性的影響(±SD,n=12)
3 結論
綜上所述,試驗揭示低溫燉煮燕窩的免疫調節功能。依據動物試驗結果,低溫燉煮燕窩不僅可以顯著提高小鼠抗體生成細胞數,增強小鼠腹腔巨噬細胞吞噬雞紅細胞能力,還可有效提升NK細胞活性,結果表明低溫燉煮燕窩可作為一種增強免疫功能性食品。試驗結果進一步為燕窩保健食品開發利用提供科學的參考依據。

