中考化學“復分解反應”熱點題型解讀
許紅弟
(江蘇省連云港市新海初級中學,江蘇 連云港 222001)
復分解反應是四種基本反應類型之一,可用通式表示為AB+CD=AD+BC.復分解反應的實質是酸、堿、鹽在溶液中發生的離子之間互相交換成分的反應.但酸、堿、鹽之間并不是都能發生復分解反應,只有當兩種化合物互相交換成分,生成物中有水、沉淀或氣體之一時,復分解反應才可以發生[1].
1 對復分解反應概念的理解
例1 (2023·株洲)下列化學方程式書寫正確且屬于復分解反應的是( )
A.鐵與稀鹽酸反應:
B.鎂帶在空氣中燃燒:
C.在高溫下CaCO3分解:
D.氫氧化鋁治療胃酸過多:


答案:D
2 考查離子的共存
例2 (2023·龍東)能在pH=5的溶液中大量共存,且溶液無色透明的一組離子是( ).
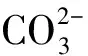
答案:D
3 考查物質的鑒別
例3 (2023·通遼)有A、B、C、D四種溶液,分別是硫酸銅溶液、氫氧化鈉溶液、稀硫酸和氯化鋇溶液中的一種.小明為鑒別以上溶液,進行如下實驗:
Ⅰ.觀察顏色,發現A呈藍色,其余為無色.
Ⅱ.將A分別與B、C混合,觀察到:A+C→藍色沉淀,A+B→無明顯現象.
回答下列問題.
(1)A為____.
(2)鐵與A反應的化學方程式為____.
(3)B與D反應的化學方程式為____,現象為____.


4 考查物質的分離與提純
例4 (2023·包頭)除去表1物質中含有的雜質,所用試劑和方法正確的是( ).

表1 各雜質的試劑和方法
解析足量的Ba(NO3)2溶液與H2SO4反應生成BaSO4沉淀和HNO3,雜質H2SO4除去了,但是又引入了新的雜質HNO3,A錯誤;濃硫酸具有吸水性,且不與氧氣反應,所以除去氧氣中混有的水蒸氣,將氣體通過足量的濃硫酸,干燥,B正確;碳酸鈣高溫分解生成氧化鈣和二氧化碳,沒有除去雜質反而除去了原物質,不符合除雜原則,C錯誤;Na2CO3溶液能與Ca(OH)2反應生成CaCO3沉淀和NaOH,雖然除去了Ca(OH)2雜質,但是又引入了新的雜質——過量的Na2CO3,D錯誤.
答案:B
5 考查物質的轉化
例5 (2023·廣西)下列物質間轉化均能通過一步反應實現的是( ).
A.Cu→Cu(NO3)2→KNO3
B.Fe→Fe2O3→FeCl2
C.Na2SO4→NaNO3→NaCl
D.KOH→Ba(OH)2→NaOH
解析A中的Cu能與AgNO3反應生成Cu(NO3)2和Ag,Cu(NO3)2能與KOH反應生成Cu(OH)2和KNO3,均能通過一步反應實現;B中的鐵通過生銹能生成氧化鐵,氧化鐵與鹽酸反應生成氯化鐵,不能生成氯化亞鐵;C中的硫酸鈉與硝酸鋇反應生成硝酸鈉和硫酸鋇,但硝酸鈉不能與其他物質通過一步反應生成氯化鈉;D中的KOH不能通過一步反應生成Ba(OH)2.
答案:A
6 考查物質的推斷
例6 (2023·遼陽)小麗構建了有關酸、堿與甲、乙、丙三種初中常見物質之間的反應關系圖(如圖1所示),圖中連線兩端的物質均能發生反應,其中甲為黑色固體,乙、丙為氧化物.請回答:

圖1 反應關系圖
(1)Ca(OH)2的俗稱為____.
(2)甲的化學式為____.
(3)乙與稀鹽酸反應得到黃色溶液,寫出該反應的化學方程式____.
(4)丙與甲反應過程會____(填“吸收”或“放出”)熱量.
解析氫氧化鈣能和酸、部分鹽以及部分非金屬氧化物發生反應;鹽酸能和堿、部分鹽以及金屬氧化物發生反應;又因為甲能和乙、丙發生反應且甲是黑色固體,則甲是碳,乙是金屬氧化物,丙是二氧化碳,代入驗證,推理正確.

7 有關復分解反應發生條件的探究
例7 (2023·金昌)某校化學興趣小組的同學利用稀鹽酸、碳酸鈉、Ba(OH)2溶液三種物質探究“復分解反應發生的條件”,做了如圖2所示實驗.

圖2 探究“復分解反應發生的條件”實驗
(1)大家一致認為在試管①中還需要加入____溶液才能證明發生了復分解反應.
(2)試管②中觀察到的現象是____,試管③中反應的化學方程式為____.
(3)通過三組實驗,同學們得出復分解反應發生的條件是____.
(4)興趣小組的同學將試管③反應后的物質過濾,對濾液中溶質的成分進一步探究.
【提出問題】濾液中溶質的成分是什么?
【猜想假設】猜想一:NaOH
猜想二:Ba(OH)2、NaOH
猜想三:____.
【設計實驗】驗證你的猜想正確(見表2).
【反思拓展】通過探究實驗,同學們發現Ba(OH)2和NaOH化學性質相似,你認為Ba(OH)2的保存方法是____.

表2 設計實驗
解析(1)試管①中的中和反應沒有明顯現象,所以需要滴入指示劑證明發生了反應,可以選擇無色酚酞或者是紫色石蕊試液.(2)試管②中是稀鹽酸和碳酸鈉發生反應生成二氧化碳、氯化鈉和水,實驗現象為固體溶解,有氣泡產生,試管③中是Na2CO3和Ba(OH)2反應生成NaOH和BaCO3沉淀.(3)通過三組實驗,同學們得出復分解反應發生的條件是要有沉淀或有氣體或有水生成.【猜想假設】 試管③中可能完全反應,濾液中溶質只含有NaOH;也可能Ba(OH)2過量,濾液中溶質是Ba(OH)2和NaOH;也有可能是Na2CO3過量,濾液中溶質是Na2CO3和NaOH.【設計實驗】若猜想三正確,則濾液中溶質成分為Na2CO3和NaOH,則步驟一中加入的CaCl2和Na2CO3反應生成CaCO3沉淀,所以實驗現象為有白色沉淀產生;步驟二中有藍色沉淀產生,說明生成了氫氧化銅沉淀,則加入的是含有銅離子的鹽,故可以滴加CuSO4或CuCl2、Cu(NO3)2等.【反思拓展】NaOH有吸水性,且在空氣中容易變質,因為和NaOH化學性質相似,所以氫氧化鋇需要密封干燥保存.
答案:(1)酚酞(或紫色石蕊) (2)固體溶解,有氣泡產生 Ba(OH)2+Na2CO3= BaCO3↓ +2NaOH (3)要有沉淀或有氣體或有水生成 (4)【猜想假設】NaOH、Na2CO3【設計實驗】白色沉淀 CuSO4[或 CuCl2、Cu(NO3)2等] 【反思拓展】密封干燥保存

