鎳基PtIr 涂層的制備及其電氧化氨的性能研究
董國斌
(沈陽中科惠友科技發展有限責任公司,遼寧 沈陽 110017)
氨(NH3)作為一種備受關注的氫載體,在“碳中和”領域中扮演著重要角色,氨分解過程中不產COx,產物只有氮氣和氫氣,更有利于氫氣的分離與純化,電解法制氫能耗較高,但其氣體純度也較高,陽極過電位過大是其能耗升高的主要原因[1-3]。
氨在堿液中電解,在陽極生成氮氣,陰極生成氫氣,氨的催化氧化過程是氨吸附在電極表面后生成氮氣的過程,但在電解過程中會與水中的氫氧根形成競爭反應,會使陽極析氮過電位增大,進而增加能耗[4],電氧化氨的陽極催化材料中,貴金屬中選擇性吸附N 的順序為Ru>Rh>Pd>Ir>Pt》Au,Ag,Cu,在上述貴金屬中只有Pt和Ir對氨選擇性氧化成氮的反應具有穩態活性,而且Pt 和Ir 的復合材料具有較強的脫氫性能[5-7],PtIr 雙金屬具有較低的析氮過電位和電化學穩定性[8]。
PtIr 催化層的制備一般是在基體上采用雙金屬共沉積的方式進行[9-10],該方法可使金屬顆粒均勻分布在基體表面,顆粒粒度均一,催化性能較好,但其沉積條件復雜,影響因素較多,且不利于大尺寸催化電極的制備[11-12]。為了解決上述問題,本文采用熱氧化方式,用耐堿蝕性能較好的鎳為基體,以涂制的方法,將PtIr 催化層制備在基體上,該方法操作簡單,利于工業化電極的制備。
1 實驗部分
1.1 試劑
鹽酸(分析純),氫氧化鈉 (分析純),氫氧化鉀(分析純),氨水(分析純),無水乙醇(分析純),正丁醇(分析純),異丙醇(分析純),以上均購于國藥集團化學試劑沈陽有限公司;氯銥酸(純度>99.9%), 氯鉑酸(純度>99.9%),購于北京研究總院有限公司; 超純水(電阻率不小于18.2 MΩ·cm),自制。
1.2 儀器
實驗所需儀器見表1。
2 實驗方法
2.1 電極的制備
2.1.1 基體前處理方法
將外形尺寸為25 mm×20 mm×1 mm 鎳板,經過200 目(75 μm)棕剛玉砂噴砂和在弱堿性溶液中除油處理后,用無水乙醇和水分別進行沖洗,風筒吹干,之后在10%的鹽酸溶液中酸洗60 min,失重量約為80~90 g/m2, 取出鎳片后,用水刷洗鎳片表面,去除殘余砂粒和酸液,再在100 ℃下烘干10 min,使之達到表觀狀態一致,待用。
2.1.2 涂層制備
配制鉑和銥的濃度比為90∶10 的混合溶液,單面涂敷在經過前處理的鎳基體表面,共涂敷14 次,使涂層的總增重量達到35 g/m2左右,熱氧化條件為每次涂敷結束后,在120 ℃下烘干30 min,后在520 ℃下燒結30 min,最后一次涂敷后需在530 ℃下燒結90 min,涂層最終的表觀狀態應為均一的灰白色。
3 結果與討論
3.1 Ni/PtIr 電極對氨的電氧化行為
Ni/PtIr 電極為工作電極, Pt 電極為對電極,Hg/HgO 電極為參比電極, 掃描速度為0.05 V/s,25 ℃下,掃描范圍為從-0.9 V 至0 V,在1 M KOH(曲線1)和0.5 M NH3+1 M KOH(曲線2)溶液中進行循環伏安掃描,如圖1 所示。通過曲線2 可知,從-0.9 V 至0 V 進行正掃時,發生了氧化反應,在-0.327 V 處,有一明顯的氧化峰,而曲線1 中在該處卻未發現明顯的氧化峰,說明Ni/PtIr 電極在KOH溶液中能夠將NH3吸附在Ni/PtIr 電極表面,進而電氧化生成N2。
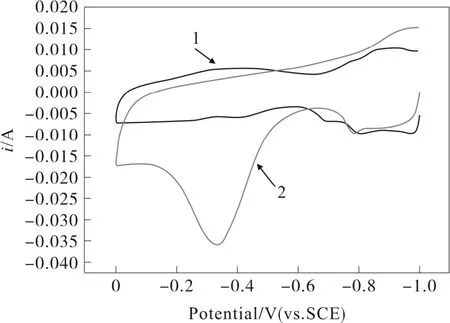
圖1 Ni/PtIr 電極電氧化氨的循環伏安曲線
3.2 Pt 和Ir 含量比對電氧化氨的影響
Ni/PtIr 電極為工作電極,其中Pt 和Ir 比分別為Pt25Ir75(曲線 1)、Pt50Ir50(曲線 2)、Pt75Ir25(曲線 3)、Pt90Ir10(曲線5)、Pt95Ir5(曲線4), Pt 電極為對電極,Hg/HgO 電極為參比電極, 掃描速度為0.05 V/s,25 ℃下,掃描范圍為從-0.9 V 至0 V,在0.5 M NH3+1 M KOH 溶液的進行循環伏安測試,如圖2 所示,隨著Pt∶Ir 的比值逐漸增大,循環伏安曲線中的峰電流在逐漸增大,當Pt∶Ir=90∶10 時,峰電流達到最大值,Pt∶Ir=95∶5 時的峰電流反而略小于Pt∶Ir=90∶10,說明Pt∶Ir=90∶10 的電氧化氨的能力達到最佳,如圖3 所示。

圖2 不同的PtIr 含量電氧化氨的循環伏安曲線
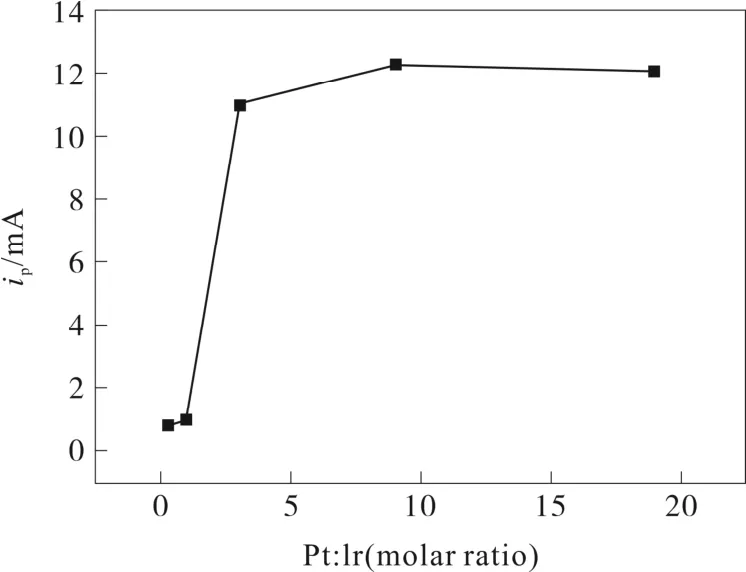
圖3 峰電流隨PtIr 含量比值的變化曲線
3.3 溫度的影響
Ni/Pt90Ir10電極為工作電極, 改變溫度在15 ℃、25 ℃、35 ℃、45 ℃、55 ℃、65 ℃下進行實驗,其他條件如3.2。如圖4 和圖5 所示,隨著溫度的逐漸升高,峰電流在逐漸增大,說明提高電解溫度有利于NH3氧化成N2,峰電流隨溫度呈線性關系,其回歸方程為ip=-11.89+0.945t,R=0.982, 但考慮到氨水的易揮發性,本實驗中,通常在25 ℃下進行。

圖4 不同溫度下電氧化氨的循環伏安曲線
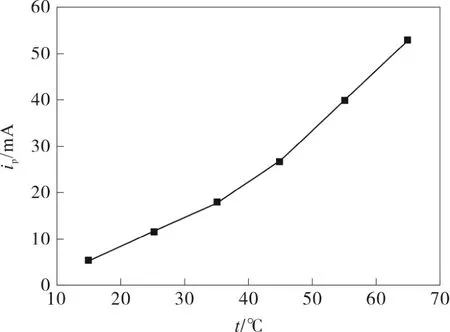
圖5 峰電流隨溫度的變化曲線
3.4 氨濃度的影響
Ni/Pt90Ir10為工作電極,在濃度為0.2~2.0 M NH3進行實驗,其他條件如3.2。如圖6 所示,隨著NH3濃度的逐漸升高,峰電流在逐漸增大,但當濃度超過1.4 M 時,峰電流的變化幅度變小,說明NH3在低濃度(0.2~1.4 M)時,Ni/Pt90Ir10電氧化氨的能力主要受電極表面控制,當NH3濃度超過1.4 M 時,Ni/Pt90Ir10電氧化氨的能力受電極表面和溶液擴散的共同控制,說明Ni/Pt90Ir10更適用于低濃度NH3的電氧化。

圖6 峰電流隨氨濃度的變化曲線
3.5 穩定性測試
Ni/Pt90Ir10為工作電極, Pt 為對電極, Hg/HgO 電極為參比電極, 掃速為0.05 V/s, 25 ℃,掃描范圍為從-0.9 至0 V,在1.0 M NH3+1 M KOH 溶液中進行循環伏安掃描,掃描1 000 圈。第1 000 圈較第1圈氧化峰電位正移了1.7 mV,峰電流僅減少了0.437 mA, 說明 Ni/Pt90Ir10電極具有較好的電化學穩定性。
4 結論
采用熱氧化法,在鎳體積上制備了Pt90Ir10陽極,在0.5 M NH3+1 M KOH 溶液中,電極電氧化氨的能力隨溫度的提升而升高,在低濃度氨溶液中,電極電氧化氨的能力受電極表面控制,在高濃度時,受電極和溶液共同控制,電極的穩定性較好。。

