Si,Ge,Zr和Sn摻雜SrTiO3的電子結構和光催化性能第一性原理研究
熊明姚,孔維靜,胡 斌,楊淑敏
(喀什大學 物理與電氣工程學院,喀什 844000)
1 引 言
由于持續的人類活動和工業化,水污染是一個全球性的嚴重問題,一直影響著人類社會的方方面面[1,2].從傳統技術,如消毒和污水回收等,到先進技術,如半導體光催化和生物吸附等[3,4].近年來,鈣鈦礦型化合物被廣泛用于光催化分解水.特別是,SrTiO3已被發現是該領域潛在的光催化劑之一[5,6].基于ABX3型晶體結構的鐵電材料,由于其介電性能,在理論和實驗研究中得到了廣泛的研究,SrTiO3具有鐵電性、半導體性和催化活性等物理特性,是非常重要的材料[7-10].
SrTiO3的電子和光學特性一直是研究人員的興趣所在,在這方面,科研工作者們使用了不同的摻雜劑,提高了SrTiO3材料的性能.如龔凌云[11]等采用第一性原理研究了不同濃度的Nb摻雜SrTiO3體系的電子結構、光學性質和力學性質,發現SrTiO3、SrTi0.875Nb0.125O3和SrTi0.75Nb0.25O3三種體系的帶隙分別為1.837 eV、1.924 eV和1.939 eV,摻雜使得SrTiO3體系的帶隙呈現增大的趨勢.薛衛東等[12]運用第一性原理計算了氧空位對SrTiO3薄膜電子結構的影響,氧空位導致SrTiO3體系的帶隙提高了1.75 eV,由順電轉換為鐵電.Yu等[13]采用溶膠凝膠水熱法制備了可見光響應的Cr/N共摻雜SrTiO3體系,在Cr/N共摻雜SrTiO3的制備過程中,Cr的加入有利于N的摻雜,Cr/N共摻雜的SrTiO3光催化劑比Cr摻雜的SrTiO3具有更高的光催化制氫活性.Zhang等[14]采用基于密度泛函理論(DFT)計算研究了N摻雜、S摻雜和N/S共摻雜SrTiO3體系的電子結構和光學性質,N/S共摻SrTiO3的帶隙值最小且可見光響應較高.Abdi 等[15]采用簡單的固相反應路線,成功合成了La和Fe摻雜的SrTiO3納米顆粒.研究了不同摻雜濃度(1、2、3、4和5 wt%)對制備樣品特性的影響,所有樣品都是立方鈣鈦礦結構,獲得的4 wt%的La-Fe離子作為摻雜元素的最佳濃度,以實現96 %降解效率的高性能光催化活性.
所以,目前無論是從實驗還是理論入手,SrTiO3在材料領域的都是研究熱點.由于Si,Ge,Zr和Sn的一般價態與SrTiO3中的Ti相同且價格低廉,而且從目前的研究進展來看,還沒有Si,Ge,Zr和Sn摻雜對SrTiO3性能影響的理論研究.因此,可用于SrTiO3材料的摻雜替代.在本文中,采用了QUANTUM ESPRESSO(QE)軟件包來實現基于密度泛函理論(DFT)的第一原理計算,以探究Si,Ge,Zr和Sn摻雜SrTiO3的Ti位的結構、電子結構和光催化特性.
2 理論模型與計算方法
圖1展示了文章采用的計算模型,由5個原子構成的SrTiO3體系為原胞,構建2×2×2的超胞,一共包括40個原子(8個Sr原子、8個Ti原子和 24個O原子),如圖1(a)所示.分別采用一個Si,Ge,Zr和Sn原子取代超胞中的一個Ti原子,生成摻雜濃度為12.5 %的四種摻雜體系,如圖1(b)所示,四種摻雜可以表示為SrTi0.875X0.125O3(X=Si,Ge,Zr,Sn).
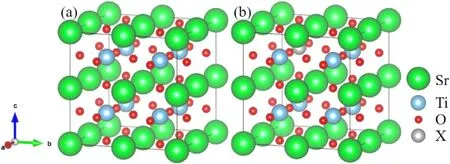
圖1 SrTiO3的超胞模型(a)未摻雜的SrTiO3,(b)一個X原子摻雜的 2×2×2的SrTiO3超胞模型
文章所涉及的計算均通過基于密度泛函理論(DFT)的開源免費軟件包QUANTUM ESPRESSO(QE)[16]實現.采用Perdew-Burke Ernzernhof (PBE)提出的廣義梯度近似(GGA)用于處理交換相關能[17],截止能量為50 Ry(1 Ry=13.6056923 eV)[18].采用Monkhorst-Pack方案[19]進行布里淵區積分,其中選擇3×3×3的k點進行自洽計算,非自洽計算使用6×6×6的k點.使用變胞弛豫方案,對五種體系進行優化,對于能帶結構和態密度,采用QE軟件包中包含的band.x和dos.x模塊代碼進行計算.
3 結果與討論
3.1 幾何優化結果
本征SrTiO3體系和SrTi0.875X0.125O3(X=Si,Ge,Zr,Sn)四種摻雜體系的晶格常數如表1中所示.本征SrTiO3的晶格常數計算值為3.928 ?,與實驗值3.905 ?[20]非常接近,晶格常數的誤差不到1 %.SrTi0.875Si0.125O3摻雜體系的晶格常數與本征SrTiO3的晶格常數相比略有下降,這與相關研究結果[21]一致,SrTi0.875Ge0.125O3晶格常數減小,其余兩種摻雜SrTiO3體系的晶格常數增加.

表1 SrTiO3摻雜前后的晶格常數a,b,c,密度ρ,總能量E以及形成能Ef
為了檢查四種摻雜結構的穩定性,根據公式(1)計算SrTi0.875X0.125O3(X=Si,Ge,Zr,Sn)的形成能Ef[22]:
(1)
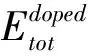
3.2 本征SrTiO3電子結構分析
在圖2(a)中,顯示了本征SrTiO3體系的能帶結構,其中費米能級存在于0 eV.價帶最大值出現在高對稱點G點處,導帶最小值也出現在G點處,這表明了G-G的直接帶隙性質,其計算帶隙為1.853 eV.這與SrTiO3的相關計算結果文獻一致:帶隙為1.838 eV的直接帶隙[23],但低于3.2 eV[24]的實驗結果,這主要是由于交換關聯函數在使用GGA近似描述激發態時會低估體系的帶隙值[25].然而,能帶結構的帶隙變化趨勢仍然是可靠的.本征SrTiO3體系的總態密度和分波態密度如圖2(b)所示,零點能量為費米能級.能量水平從價帶的-5 eV到0 eV主要由O-2p軌道和Ti-3d軌道貢獻,表現出明顯的雜化現象,導帶主要取決于Ti-3d軌道.能量范圍在-20 eV至-15 eV主要由O-2s軌道和Sr-3p軌道雜化貢獻.

圖2 (a)本征SrTiO3的能帶結構,(b)本征SrTiO3的態密度
3.3 Si,Ge,Zr和Sn摻雜SrTiO3的能帶結構分析
計算了摻雜SrTiO3體系的能帶結構,從能帶結構的角度分析 Si,Ge,Zr和Sn摻雜對SrTiO3的影響.從圖3可以看出,Si摻雜SrTiO3的帶隙大小為1.849 eV且仍然為直接帶隙,相比于本征SrTiO3體系的帶隙有所減小,這與Liu等[21]的研究結果基本吻合.而對于SrTi0.875X0.125O3(X=Ge,Zr,Sn)三種摻雜體系而言,從圖中可以看出Ge,Zr和Sn取代Ti位后,SrTi0.875X0.125O3(X=Ge,Zr,Sn)三種摻雜體系仍然具有直接帶隙特征.而三種摻雜體系的帶隙值相對于本征SrTiO3分別增加到1.916 eV,1.895 eV和1.925 eV.顯然,Ge,Zr和Sn取代Ti位時對SrTiO3的帶隙起到增大作用,Si取代Ti位起減小作用.

圖3 能帶結構:(a)SrTi0.875Si0.125O3;(b)SrTi0.875Ge0.125O3;(c)SrTi0.875Zr0.125O3;(d)SrTi0.875Sn0.125O3
3.3 Si,Ge,Zr和Sn摻雜SrTiO3的態密度分析
圖4(a-d)顯示了Si,Ge,Zr和Sn摻雜SrTiO3體系的分波和總的態密度圖.Si摻雜后觀察到SrTi0.875Si0.125O3的價帶仍然主要由O-2p軌道和Ti-3d軌道貢獻,導帶主要由Ti-3d態貢獻,Si對于總態密度的貢獻不明顯,SrTi0.875Si0.125O3的帶隙相對于本征SrTiO3體系帶隙減小.而對于SrTi0.875X0.125O3(X=Ge,Zr,Sn)三種摻雜體系可以明顯的看出,對于導帶部分,SrTi0.875Ge0.125O3體系的Ge-4s軌道,SrTi0.875Zr0.125O3體系的Zr-4d軌道和SrTi0.875Sn0.125O3體系的Sn-5s軌道,通過摻雜過程,都分別對自身的摻雜體系的總態密度加以貢獻.對于本文研究SrTiO3中的Ti位被X(X=Si,Ge,Zr,Sn)原子取代.從總體上來看,對于SrTi0.875X0.125O3(X=Si,Ge,Zr,Sn)四種摻雜體系而言,除去SrTi0.875Si0.125O3體系,對于本征SrTiO3體系來說,三種摻雜體系的帶隙變寬.也就是說,帶隙遵循Sr8Ti7SiO24(1.849 eV) 圖4 態密度:(a)SrTi0.875Si0.125O3;(b)SrTi0.875Ge0.125O3;(c)SrTi0.875Zr0.125O3;(d)SrTi0.875Sn0.125O3 為了描述本征SrTiO3和SrTi0.875X0.125O3(X=Si,Ge,Zr,Sn)四種摻雜體系相對于水氧化還原電位的帶邊,可以采用經驗公式(2)和公式(3)得到半導體的價帶帶邊的氧化電勢(EVB)和導帶帶邊的還原電勢(ECB)[26].能帶結構中GGA會低估帶隙,盡管五種SrTiO3體系的結果不影響帶隙的定性分析或電子結構等特性的研究,但是,在預測氧化還原電位和光吸收對應的半導體帶邊時,由于低估帶隙而引入的誤差將會變得很大.為了彌補這種低估,將引入“剪刀”算符這一方法.本文選用的剪刀算符的值為1.347 eV這是由本征SrTiO3的計算帶隙值與實驗值之間的差值決定的. ECB=X-EH-0.5Eg (2) EVB=Eg+ECB (3) 其中,X是本征SrTiO3和SrTi0.875X0.125O3(X=Si,Ge,Zr,Sn)四種摻雜體系對應的電負性.EH約為4.5 eV,是氫標度上自由電子的能量.Eg是五種SrTiO3體系對應剪刀算符的帶隙值.EVB等于Eg和ECB之和. 由表2可以看出,計算出本征SrTiO3和SrTi0.875X0.125O3(X=Si,Ge,Zr,Sn)四種摻雜體系的EVB分別為:2.418 eV、2.460 eV、2.487 eV、2.442 eV和2.481 eV.而五種SrTiO3體系對應的ECB分別是-0.782 eV、-0.736 eV、-0.776 eV、-0.800 eV和-0.791 eV.圖5給出了本征SrTiO3和SrTi0.875X0.125O3(X=Si,Ge,Zr,Sn)四種摻雜體系的帶邊位置.從氧化還原性質方面來看,本文包含的五種SrTiO3體系的EVB大于1.24 eV,ECB大于0.00 eV,均滿足光解水的基本條件.其中,SrTi0.875Zr0.125O3體系的還原性最高,SrTi0.875Ge0.125O3體系的氧化性最高.SrTi0.875X0.125O3(X=Zr,Sn)兩種摻雜體系的氧化還原性得到提高,而SrTi0.875Si0.125O3的還原性雖然降低,四種摻雜體系對于本征體系的氧化性都得到了提高. 表2 純和摻雜SrTiO3的帶隙能量(eV)(剪刀算符1.347 eV),電負性X,帶邊位置ECB和EVB. 采用QUANTUM ESPRESSO(QE)軟件包,利用廣義梯度近似(GGA)的第一原理模擬研究了Si,Ge,Zr和Sn摻雜SrTiO3的結構,電子結構和光催化性能.優化后的晶格常數值和實驗值吻合較好.通過分波和總態密度解釋了四種摻雜元素對能帶結構的具體影響.摻雜后,除了SrTi0.875Si0.125O3體系的帶隙值降低之外,SrTi0.875X0.125O3(X=Ge,Zr,Sn)三種摻雜體系的帶隙值增加,費米能級保持不變,四種摻雜體系的導帶底或者價帶頂未出現穿過費米能級的現象,這可能是由于Si,Ge,Zr和Sn四種原子的一般價態與Ti的相等的緣故.基于相對于未摻雜SrTiO3的帶邊位置,獲得了四種單摻SrTiO3體系的帶邊位置.對于摻Si的SrTiO3體系的還原性降低,Zr和Sn摻雜SrTiO3氧化還原性能提高,四種摻雜SrTiO3體系的帶邊位置仍然能夠在水分裂過程中生成H2和O2.
3.4 光催化性能分析

4 結 論

