熒光PCR-毛細管電泳法在人運動神經元存活基因1和運動神經元存活基因2檢測中的應用
李少英 何健淳 趙耿燁 冼嘉嘉 黃玲玲 何文智 馬曉燕 張慧敏 張敏聰 黎青
廣州醫科大學附屬第三醫院婦產科,廣東省產科重大疾病重點實驗室,婦研所實驗部 (廣州 510150)
脊髓性肌萎縮癥(spinal muscular atrophy,SMA)是由于運動神經元存活基因1(survival mo?tor neuron gene 1,SMN1)突變導致SMN 蛋白功能缺陷所致的遺傳性神經肌肉病,為常染色體隱性遺傳[1-3]。發病率為1/10 000 ~ 1/6 000,攜帶率為1/85 ~ 1/35[4-7]。
SMN基因(survival motor neuron)位于染色體5q11.2 ~ q13.3 上,全長約為27 kb,含有9 個外顯子,人基因組有兩個緊鄰的高度同源的SMN 基因,為SMN1基因(survival motor neuron gene 1,運動神經元存活基因1)與SMN2基因(survival motor neu?ron gene 2,運動神經元存活基因2),SMN1是主要功能基因,該基因突變可導致SMA 發病[8-9],SMN2為臨床表型的調節基因,影響病情的嚴重程度,其拷貝數增加可減輕SMA 表型[10-12]。臨床上,SMA診斷以分子遺傳學檢測為基礎。當患者因典型臨床癥狀被懷疑為SMA 時,應當首先考慮進行基因檢測,基因檢測結果明確的無須再進行肌活檢。約95%的SMA 患者由SMN1基因外顯子7、8 純合缺失導致,或只存在外顯子7 純合缺失。大多數患者的缺失遺傳自父母,有2%的患者SMN1兩個等位基因中的一個出現了新發缺失。有3% ~ 4%的病例,SMN1一個等位基因缺失,而另一個則出現了其他類型的突變[2-3]。目前已報道的檢測技術眾多,如SMN基因拷貝數檢測常見的方法有PCR 結合限制性片段長度多態性(PCR-RFLP)法、定量聚合酶鏈反應法(qPCR)、二代測序法(NGS)及多重連接探針擴增法(MLPA)[13-22];點突變技術有二代和三代測序[19-20,23-24];而SMN1基因2+0 型變異目前仍沒有直接檢測方法。間接方法有:采用三代測序平臺通過單倍型分析,推測受試者是否為2+0 型攜帶,因其研究的樣本數量相對較少,從單倍型分析中得結果仍有待進一步研究[23-24];采用滴式數字PCR 平臺,通過單精子檢測SMN1基因拷貝數,推算受試者是否為2+0 型攜帶,該方法只適用于男性受試者[25]。目前已報道的眾多的檢測技術均存在一定的局限性。由于SMN基因結構的復雜性,且約95%為缺失型變異基因致病特點,SMN基因拷貝數檢測已成為SMA 檢測的首選方法。SMN基因拷貝數檢測常見的方法性能有所差異。其中,MLPA 技術目前被認為是定量SMN1和SMN2拷貝數的金標準方法[21-22]。但MLPA 因試劑非國產化,其耗材貴、操作步驟較復雜和檢測時間長等缺點限制其在臨床中的應用。然而,以上的其他方法對于檢測SMN1和SMN2從0 ~ 4 的拷貝數均存在一定局限性[13-21]。
以熒光PCR-毛細管電泳(PCR/CE)為基礎的SMN1和SMN2基因檢測技術,比MLPA 技術快速、簡便,且為國產化試劑。在本研究中,我們同時采用PCR/CE 技術和MLPA 技術,對337 個樣本的SMN1和SMN2拷貝數進行檢測,比較其方法的性能。
1 材料與方法
1.1 研究對象 選擇自2010-2022年,就診于本院生殖醫學中心和產前診斷中心的患者共337 例,其中115 例為SMA 患兒或有SMA 家族史的患者,222 例為接受SMN1基因篩查的患者,所有研究對象均簽署了知情同意書,授權醫院在去掉所有個人信息后,檢測數據可供研究參考。本研究通過廣州醫科大學附屬第三醫院倫理委員會批準,倫理批號:醫倫專審[2021]第254 號。
1.2 方法
1.2.1 一致性分析 應用PCR/CE 方法與MLPA 法對同一樣本在各自檢測流程上進行平行測定,對兩者檢測結果進行一致性分析,在試驗操作過程中及判定結果時采用盲法,并將結果填入病例報告表中,用于統計分析。檢測結果以MLPA 方法檢測結果為最終檢測結果。
1.2.2 DNA 的提取 采用QIAmp DNA mini kit(QIAGEN,德國)快速DNA 提取試劑盒提取DNA樣本。
1.2.3 MLPA法 采用SALSA probe mix P021(MRC Holland)[2-4],經變性、雜交、連接反應、PCR 反應和ABI 3500 遺傳分析儀毛細管電泳分析產物,試驗檢測過程中各檢測方法的參數設定、檢測及結果判定均嚴格遵循相應的說明書或操作說明。
1.2.4 PCR/CE 方法 人類SMN1和SMN2基因檢測試劑盒(熒光PCR-毛細管電泳法)(廈門百歐迅生物科技有限公司),經PCR 反應和ABI 3500 遺傳分析儀毛細管電泳分析產物,試驗檢測過程中各檢測方法的參數設定、檢測及結果判定均嚴格遵循相應的說明書或操作說明。
1.3 統計學方法 采用4 × 4 交叉表用SPSS(19.0版)軟件分別統計SMN1 和SMN2 基因0、1、2、3、≥ 4檢測結果。
2 結果
共檢測337例樣本,1例因MLPA法檢測結果無法按照說明書判讀剔除,經PCR/CE 方法與MLPA法檢測并有完整的檢測結果的樣本共336 例,其中純合缺失型(患者)50 例(14.9 %),雜合缺失型(攜帶者)65 例(19.3%),無缺失型221 例(65.8%)。熒光PCR-毛細管電泳法試劑檢出SMN1和SMN2基因拷貝數為0、1、2、3、≥ 4 的結果與MLPA 方法檢測結果完全一致。見表1。336 例樣本采用4×4 交叉表用SPSS 軟件分別統計SMN1和SMN2基因0、1、2、3 ≥ 4 檢測結果,Kappa:1,總符合率:100%,見表2-5。
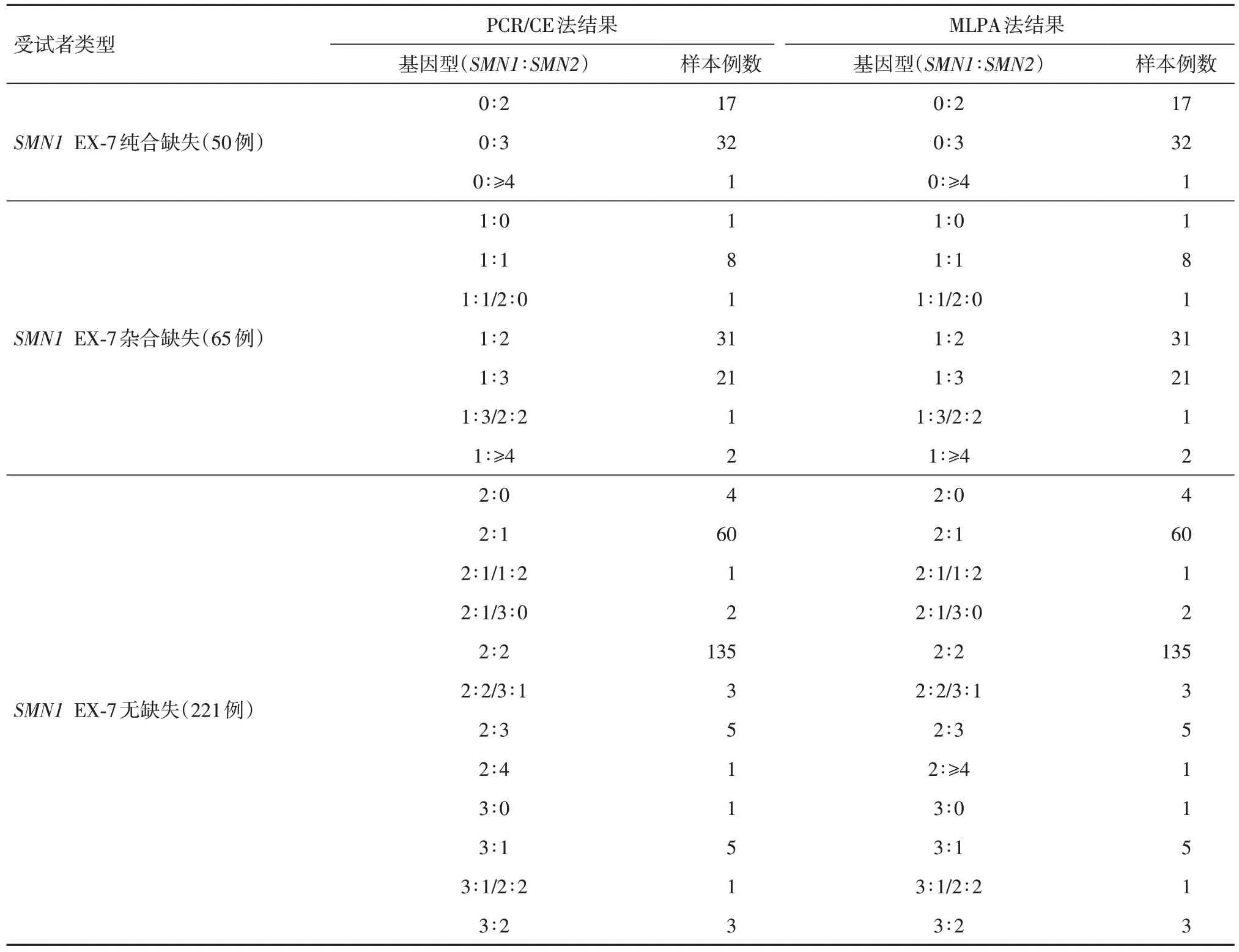
表1 PCR/CE 法與MLPA 法檢測各不同樣本類型結果匯總表Tab.1 Summary of results for different sample types Detected by PCR/CE and MLPA
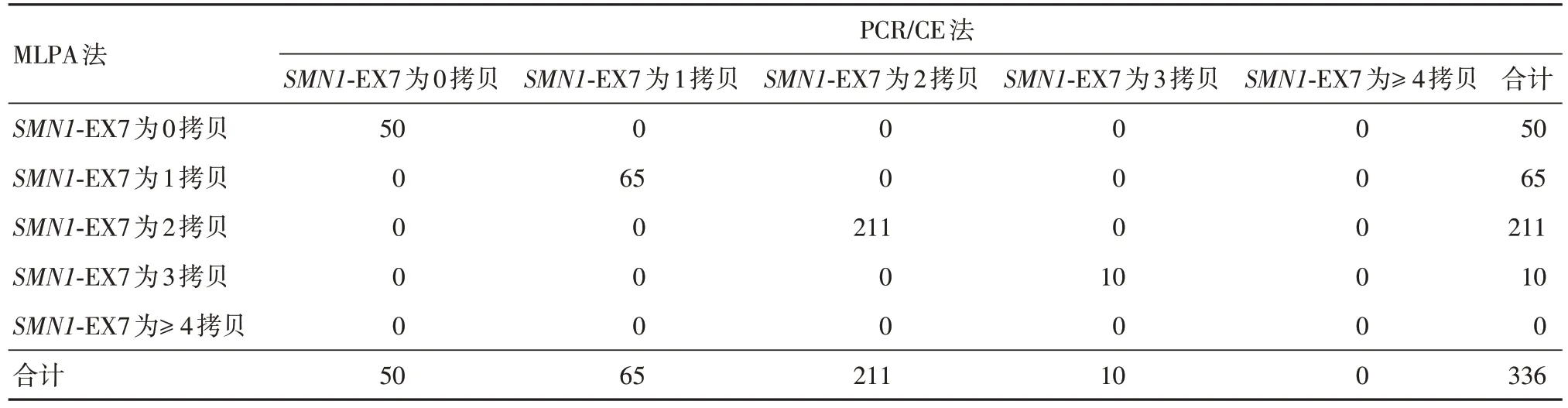
表2 SMN1 基因外顯子7 檢測結果統計分析Tab.2 Statistical analysis of SMN1 gene exon 7 detection results
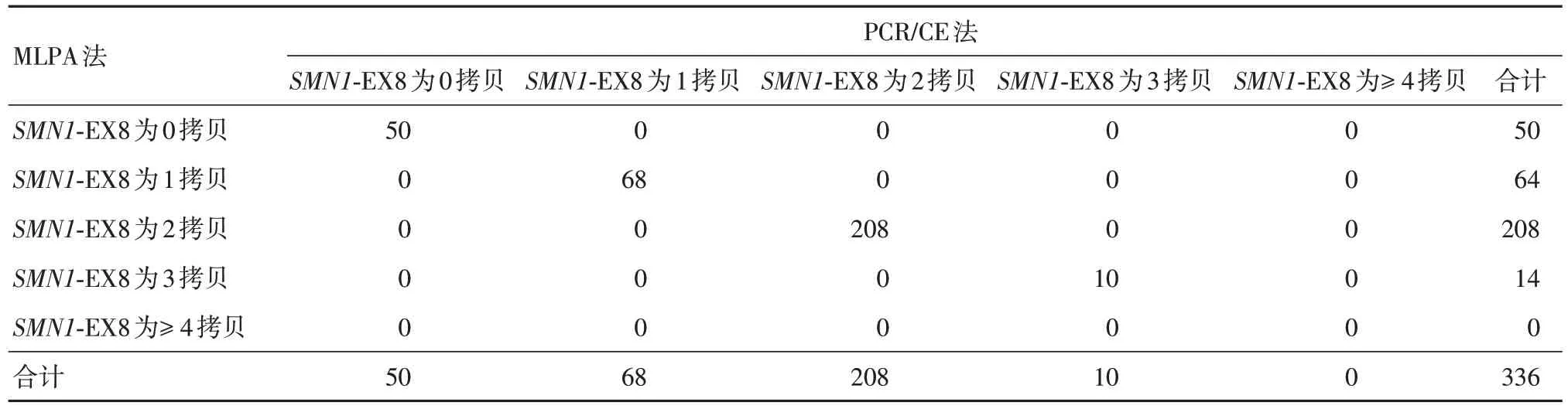
表3 SMN1 基因外顯子8 檢測結果統計分析Tab.3 Statistical analysis of SMN1 gene exon 8 detection results
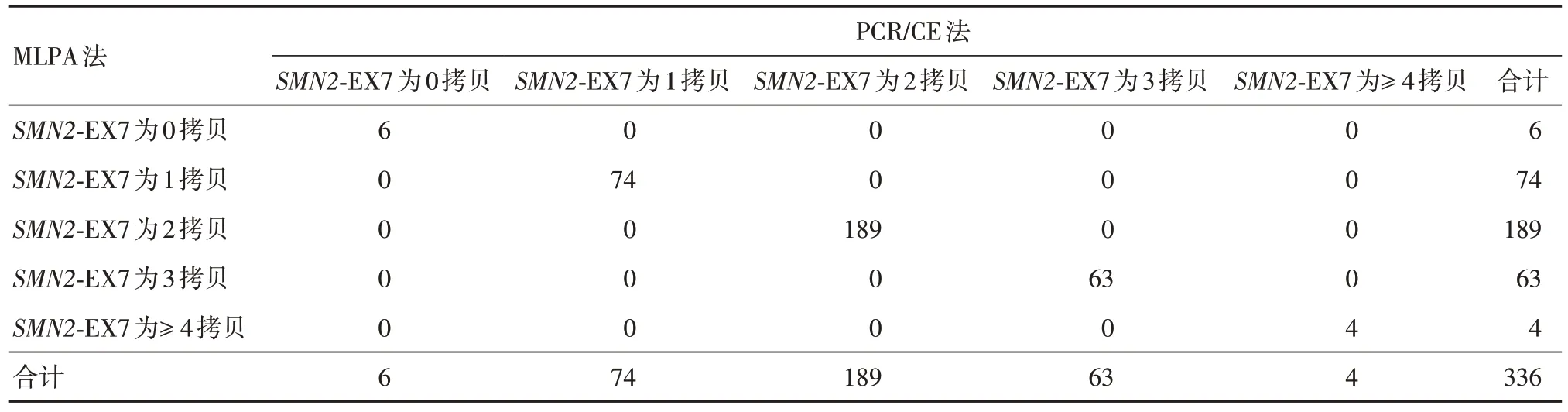
表4 SMN2 基因外顯子7 檢測結果統計分析Tab.4 Statistical analysis of SMN2 gene exon 7 detection results
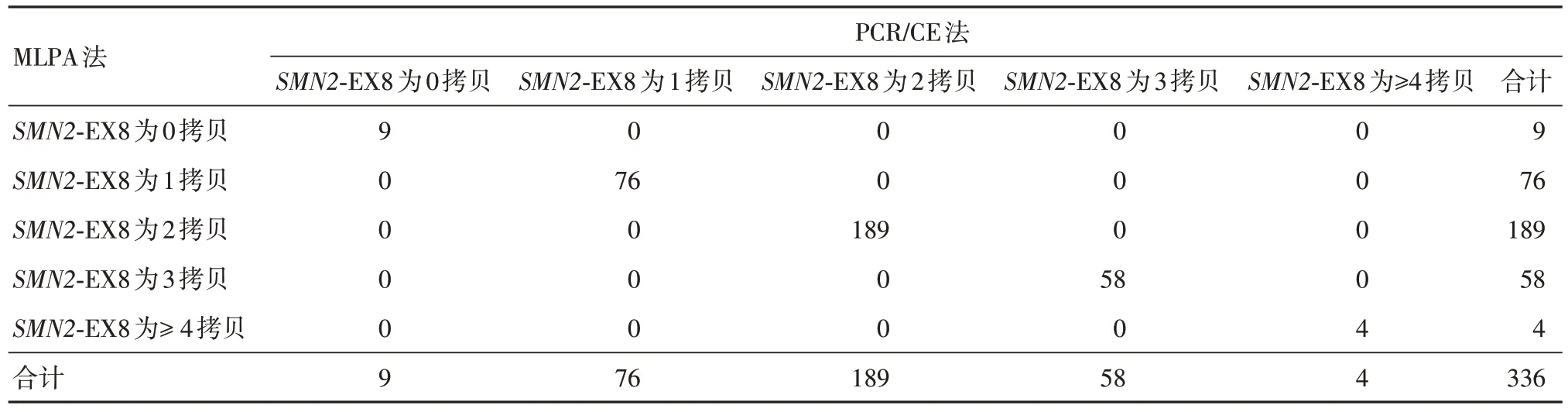
表5 SMN2 基因外顯子8 檢測結果統計分析Tab.5 Statistical analysis of SMN2 gene exon 8 detection results
3 討論
SMA 基因診斷的結果應用于區分患者、攜帶者及正常人,對患者進行臨床分型及病情評估,解釋疾病的發生發展,開展藥物治療、多學科管理和定期隨訪,以延長患者生存周期、提高運動功能、延緩和減輕并發癥的發生發展[10]。同時,為患者及家庭提供遺傳咨詢,包括遺傳病因、傳遞模式、再發風險評估、產前診斷或植入前遺傳學檢測等再生育選擇以及家庭成員攜帶者篩查建議等相關信息和指導。
SMA 基因診斷原則建議同時報告SMN1和SMN2的拷貝數,且拷貝數分析包括SMN1和SMN2的外顯子7 和8[10]。由于基因結構的復雜性,且約95%為缺失型變異基因致病特點,SMN基因拷貝數檢測為已成為SMA 檢測的首選方法。
PCR-RFLP 方法有酶切不徹底的隱患,在臨床上只能診斷SMN1純合缺失的患者,不能檢測SMN拷貝數。qPCR技術現已成為分子診斷領域的重要技術,其操作簡單、快速經濟、靈敏度高、高通量等優勢,在SMN基因拷貝數檢測中愈加受到重視[14]。其根據采用不同的熒光技術分為兩類:TaqMan 系統和SYBR Green 系統。但因設備型號差異而無統一的操作技術標準,所以qPCR 在臨床應用的穩定性還有待提高[14-15]。NGS 技術,相對于一代測序技術,有著更高數量級的測序通量,所以也稱之為高通量測序,多應用于SMA 與其他表型易混淆的肌肉疾病初篩,另外在SMN2拷貝數分析方面,NGS還有待更多的證據證明其準確性和可靠性。已有大量的研究數據表明NGS 可以直接計算SMN1拷貝數,但篩查或診斷SMN1微小變異仍存在很大困難,目前在我國,NGS 尚未成為SMA 的常規檢測方法。MLPA 技術是一種高效、特異的基因檢測技術,其包含SMN區域和其他染色體上的許多對照探針,可以用于SMN 基因的總拷貝數參考或系統質量控制,因此,用MLPA 分析SMN 基因拷貝數比其他方法更準確、更有效,該技術除明確區分患者、攜帶者及正常人,同時檢測患者的SMN2拷貝數,是目前臨床上SMA 基因檢測金標準[21-22]。但MLPA 因試劑非國產化,其耗材貴、操作步驟較復雜和檢測時間長等缺點限制其在臨床中的應用。
PCR/CE法適用于人樣本中SMN1基因和SMN2基因第7 號外顯子和第8 號外顯子拷貝數(0、1、2、3、≥ 4)的檢測,用于SMA 的輔助診斷。與目前臨床上SMA 診斷金標準MLPA 技術比較。本次試驗336 例樣本中,SMN1基因外顯子7 拷貝數分布0、1、2、3 的樣本分別為50 例、65 例、211 例、10 例;本中心50 例純合缺失型均為患者,65 例雜合缺失型受試者均為攜帶者,無復合雜合突變型患者,無缺失型221 例,SMN1基因陽性樣本占全部研究樣本的34.2%;SMN2基因外顯子7拷貝數檢測的準確性在全部人群中進行考察,0、1、2、3、≥ 4 的樣本分別為6 例、78 例、197 例、56 例、9 例;在熒光PCR/CE法試劑檢測范圍內,其檢測結果與MLPA 方法檢測結果完全一致。TAN 等[17]評價了qPCR、滴式數字PCR、高分辨率熔融分析、PCR/CE 法和MLPA 五種方法在SMA 篩查中的檢測性能,其得出的結論是以上方法中PCR/CE 法是最可靠的方法,在定量SMN1和SMN2的拷貝數方面與MLPA 具有良好的一致性,與我們本次研究的結果相符。方玉琴等[18]報道了CE 法在單基因病攜帶者篩查應用中是一種經濟有效的方法。
綜上所述,本研究PCR/CE 法試劑產品設計與目前臨床上SMA 基因拷貝數檢測的金標準方法MLPA 完全一致,可同時檢測SMN1和SMN2基因外顯子7 和8,且可相對定量至4 拷貝,結果可靠并可獲得完整的基因信息,本次研究納入的336 例合格樣本檢測結果表明,PCR/CE 法試劑檢測SMN1和SMN2各基因不同拷貝數檢測結果總符合率均為100%,且具有簡便、快速等優點。適用于SMA 缺失型患者的輔助診斷和1+0 型攜帶者檢測,其檢出率約95%。但該方法存在一定局限性,其不能檢出SMN1基因內點突變以及2+0 型攜帶者。未來需要研究開發可以檢測單核苷酸變化的PCR/CE 法,以更適用于適用于SMA 輔助診斷和攜帶者檢測。
【Author contributions】LI Shaoying performed the experiments and wrote the article.HE Jianchun,ZHAO Gengye,XIAN Jiajia,HUANG Lingling,ZHANG Huimin and ZHANG Mincong performed the ex?periments.HE Wenzhi and MA Xiaoyan revised the article.LI Qing designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.

