基于Box-Behnken響應面法優化玄參多糖提取工藝及體外抗氧化活性研究
馬舒偉,劉興艷
(1.浙江藥科職業大學 中藥學院,浙江 寧波 315500;2.寧波職業技術學院 化工學院,浙江 寧波 315800)
玄參為玄參科玄參屬植物,性微寒,味甘、苦、咸,具有清熱涼血,滋陰降火,解毒散結。用于熱入營血,溫毒發斑,熱病傷陰,舌絳煩渴,津傷便秘,骨蒸勞嗽,目赤,咽痛,白喉,瘰疬,癰腫瘡毒[1]。目前,國內報道玄參多糖提取方法主要為酶法[2],然而,其并未考慮因素之間相互影響,酶提取方法工藝有待驗證和優化。微波萃取技術被用作提取植物多糖,節省時間和勞動力,有更多的空間去升高多糖的提取率,操作簡單,節約能源[3]。本實驗采用添加復合酶的水作為溶媒,微波提取玄參多糖的方法,利用Box-Behnken效應面法提高玄參多糖的提取率,用Design-Expert軟件進行數據處理,獲得玄參多糖提取工藝中最佳參數。
1 實驗材料
1.1 儀器
紫外可見分光光度計(日本島津);202-0S 電熱鼓風干燥箱(湖南湘儀);3-18K 高速冷凍離心機(德國 SIGMA);DK-420 數顯恒溫水浴槽(上海坤誠);BS124S 型電子天平(北京賽多利斯);WD700TL17-3微波爐(廣州格蘭仕);PHS3Cs 型pH計(上海雷磁)。
1.2 藥材與試劑
玄參由浙江磐安藥材種植基地提供,經寧波市中醫院賈占東副主任醫師鑒定為玄參科植物玄參Scrophularia ningpoensis Hemsl.的干燥根。玄參干燥藥材粉碎后過80目篩網,常溫陰涼放置待用;D-無水葡萄糖標準品(中國食品藥品檢定研究院);纖維素酶:400 U/mg(北京奧博星生物技術有限責任公司);木瓜蛋白酶:50萬U/g(上海源葉生物科技有限公司);果膠酶:500 U/mg(上海躍騰生物技術有限公司);乙醇、苯酚、濃硫酸等其他化學試劑均為分析純;實驗中提取用水為去離子水。
2 實驗方法
2.1 玄參多糖的制備
取玄參藥材粉末置于圓底燒瓶中,加入含有酶的蒸餾水,浸泡30 min 后微波提取3 次,每次30 min,放置室溫,抽濾,收集合并濾液,減壓回收蒸餾水,濃縮,離心(5 000 r/min,20 min)至無沉淀為止,繼續濃縮,獲得濃縮液,加入乙醇至醇濃度為80%,沉淀過夜,抽濾,收集沉淀物,獲得濾餅,并依次用無水乙醇和丙酮洗滌數次,烘干,稱重。
2.2 玄參多糖含量的測定[4-5]
采用苯酚-硫酸法測定玄參多糖的含量,對照品選用葡萄糖標準品。
2.3 玄參多糖提取率的計算
取玄參多糖提取物用蒸餾水充分溶解后,采用苯酚-硫酸法測定玄參多糖溶解液的多糖含量,測定波長為490 nm。繪制葡萄糖標準品的濃度和吸光度的標準曲線,作為參照標準測定多糖溶液中葡萄糖濃度。
依據式(1)計算玄參多糖的提取率(EE)。
式中,EE 玄參多糖的提取率(%);Ci為樣品葡萄糖測定濃度;V為玄參多糖溶液的體積(mL);N為測定前多糖溶液稀釋倍數;M為玄參粉的質量(g)。
2.4 Box-Behnken效應面法優多糖提取工藝[6]
2.4.1 Box-Behnken 實驗設計
選取復合酶添加量(酶比例∶果膠酶∶木瓜蛋白酶∶纖維素酶=1 ∶1 ∶1)、提取溫度和提取時間3因素為自變量,每個因素設置3水平,玄參多糖的提取率為因變量。采用Box-Behnken 中心組合設計響應面實驗。微波爐功率設置為3 000 W,多糖溶液pH 為7.0。試驗因素及水平見表1。Box-Behnken 實驗方案與結果見表2。
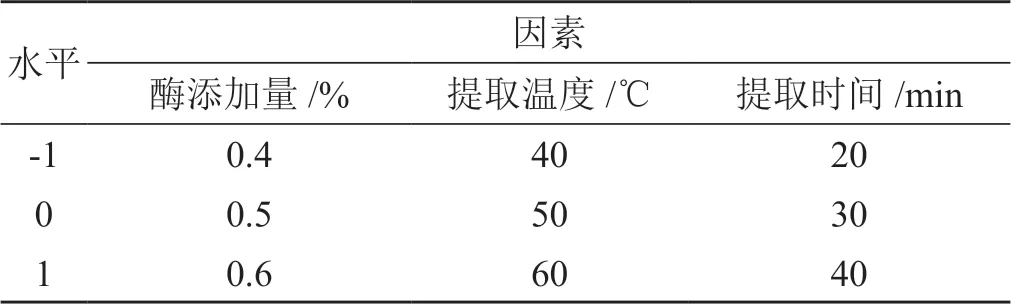
表1 工藝因素水平
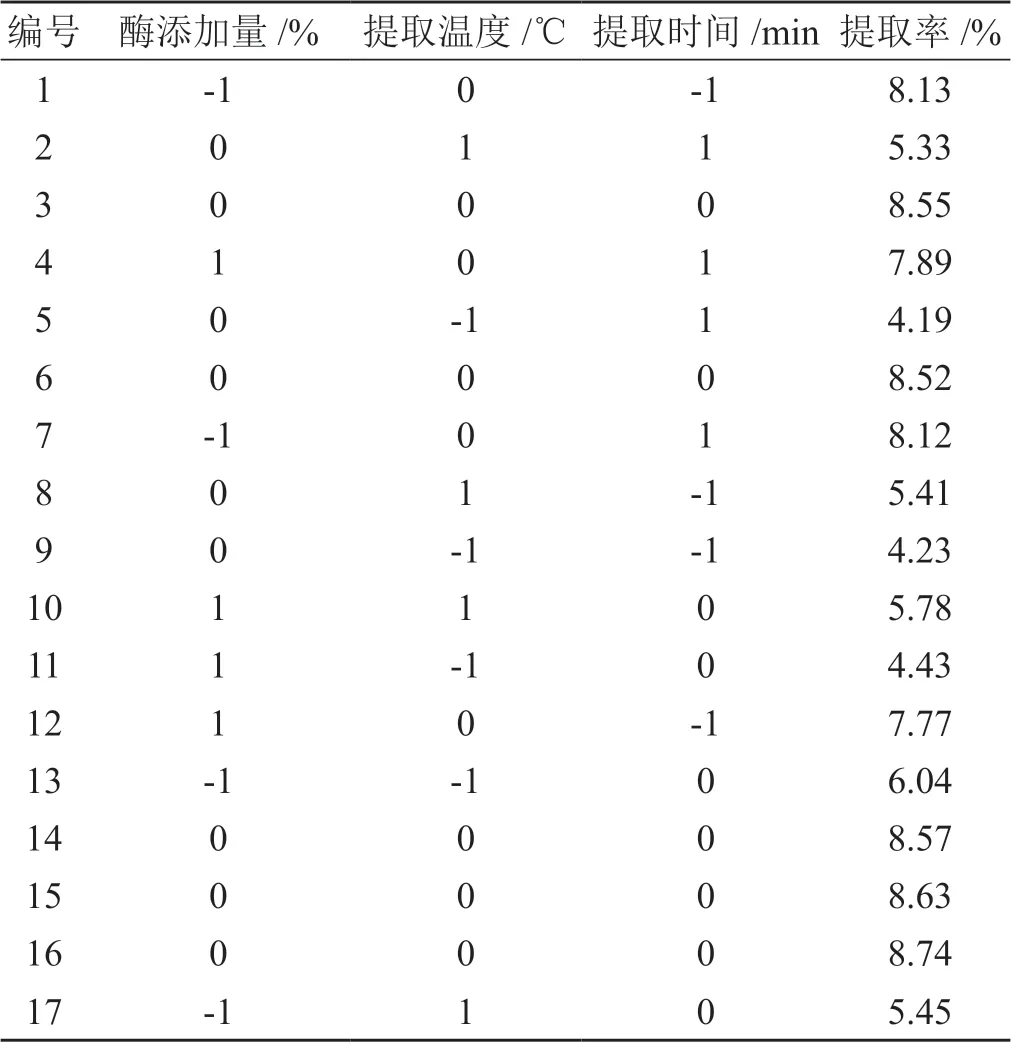
表2 工藝Box-Behnken 實驗方案與結果
2.4.2 模型的擬合
利用 Design-Expert 軟件對表2中的數據進行回歸分析,獲得酶添加量(A)、提取溫度(B)、提取時間(C)與玄參多糖得率Y之間的回歸方程,擬合的方程為:Y=8.6-0.23A+0.38B-0.00125C-0.49AB+0.033AC-0.01BC+0.00525A2-3.18B2-0.63C2(R=0.9918,P<0.01)。方差分析表明,擬合得到的回歸方程,P<0.01,說明本實驗研究范圍內該模型具有統計學意義。B、B2、C2三個因素對多糖得率具有顯著性的影響,呈現為極顯著影響(P<0.01)。模型擬合極顯著(P<0.01),失擬項P>0.05,說明實測值與預測值之間無失擬存在,該數學模型具有較好的預測性。
2.4.3 效應曲面分析
討論酶添加量、提取溫度和提取時間3個因素對于響應值的響應,采用Design-Expert 軟件繪制三維曲面圖(圖1)。比較3組曲面響應圖發現,酶用量與提取時間、酶用量與提取溫度的響應曲面圖表現較為陡峭的曲面,因此酶用量和提取溫度對玄參多糖提取率的影響最為顯著。Design-Expert 軟件計算分析表面,提取玄參多糖的最佳工藝:酶添加量為0.4%,提取溫度為49.85℃,提取時間為29.74 min,理論計算最優多糖得率達8.85%。便于實際可操作性,酶添加量為0.4%,提取溫度為50℃,提取時間為30 min。
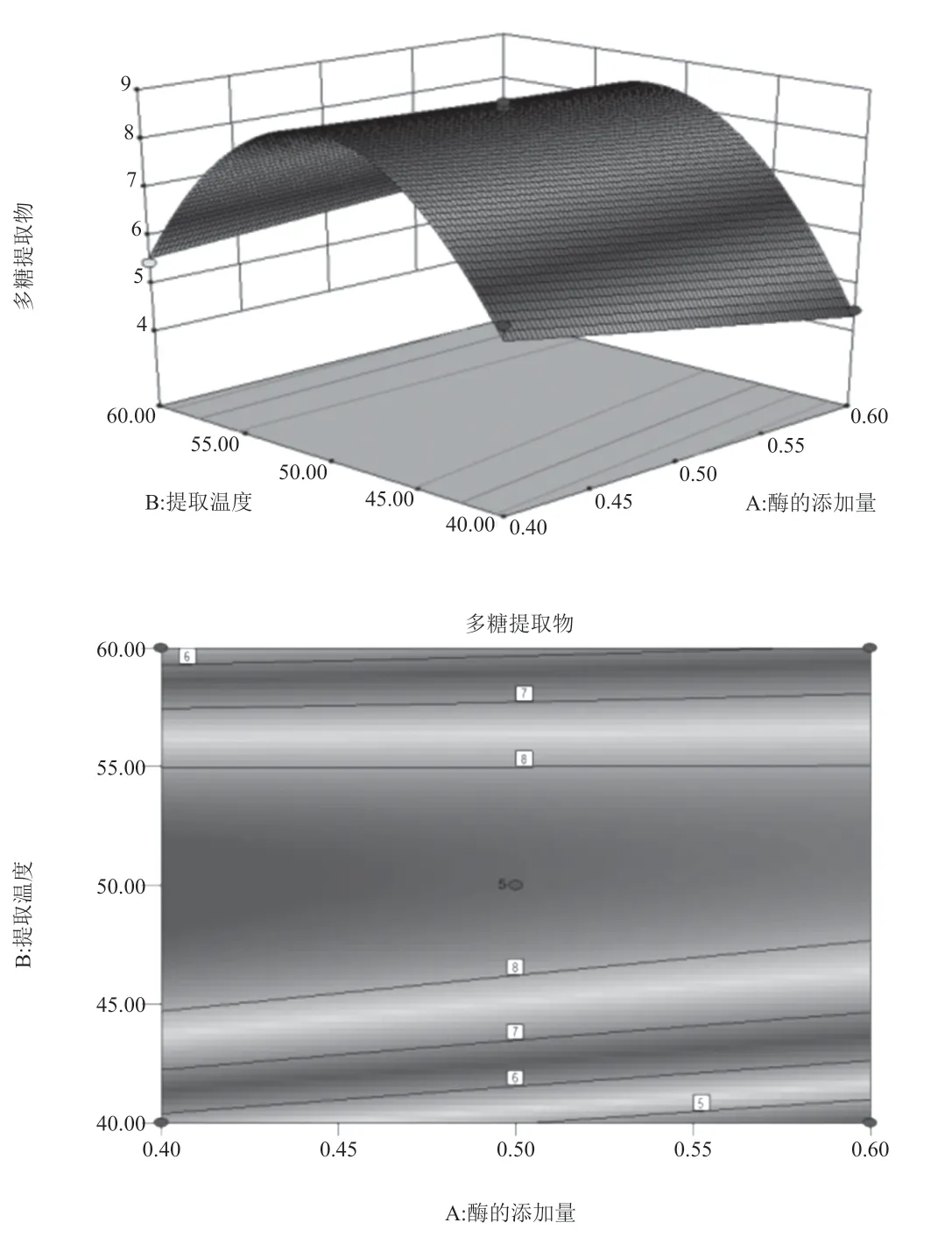
圖1 酶用量的三維曲面圖
2.4.4 驗證實驗
準確稱取玄參藥材粉末3份,每份20.0 g,按優化后工藝提取多糖,提取三份玄參藥材粉末,多糖提取率分別為8.64%、8.82%和8.83%,平均值8.76%。其結果與預測值8.85%基本一致,真實實驗結果與回歸方程預測值非常接近,說明多糖提取工藝科學合理。同時,回歸方程模型的準確性已驗證,本實驗獲得多糖提取的最佳工藝的結果非常有意義。
2.5 抗氧化活性
DPPH 自由基清除能力[7]:將粗玄參多糖配制不同濃度溶液(50~300 μg/mL),配制濃度為0.1 mol/L的DPPH 甲醇溶液200 μL,將不同濃度的20 μL 多糖溶液分別加入 DPPH 甲醇溶液。混勻后置于無光環境中反應60 min,于517 nm 波長下測定吸光度。以純水作為空白,計算玄參多糖對DPPH 自由基的清除率,使用維生素E(VE)作為陽性對照。以式(3)計算DPPH 自由基清除率。
用半清除率IC50表示玄參多糖抗氧化能力。
式中,Ai為混勻后0 min 吸光度;Aj為混勻后靜置60 min 吸光度;Ac為空白溶液的吸光度。
結果如圖2所示,不同濃度多糖清除DPPH 自由基的能力具有差異性,其中酶輔助法獲得的多糖清除DPPH自由基能力最強,且在濃度80~240 μg計量之間,存在劑量依賴性。240 μg 和280 μg 濃度之間對DPPH自由基清除率無顯著性差異,推測可能多糖對DPPH自由基清除能力具有飽和性。
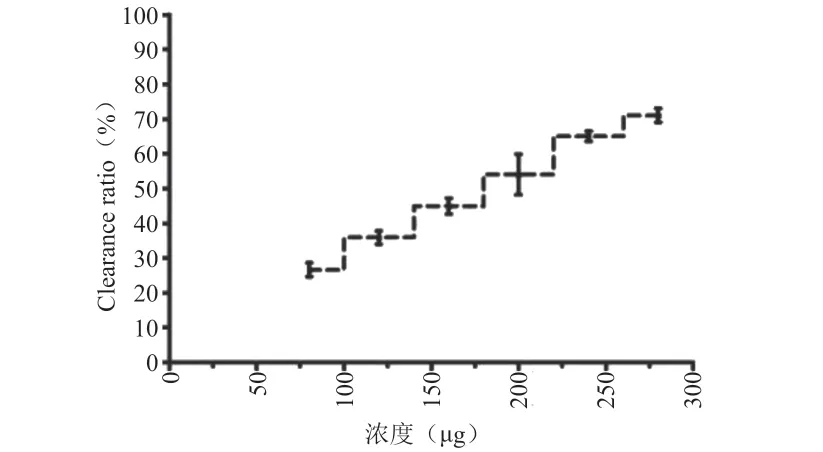
圖2 玄參多糖體外抗氧化活性
3 結束語
以BoxBehnken 實驗設計和響應面分析法預測的玄參多糖最佳提取工藝,結果發現,真實實驗結果和模型預測結果具有高度的擬合度,說明回歸方程可靠。
多數天然來源的多糖具有抑制體內的氧化應激,可通過直接清除氧化自由基、抑制氧化產物和絡合金屬離子間接抑制產生活性氧等途徑實現抗氧化作用。本實驗考察了酶輔助微波提取法獲得的玄參多糖進行的抗氧化作用的驗證,發現玄參多糖對DPPH 自由基具有顯著的清除能力,且呈明顯的劑量依賴性,說明酶法輔助提取溫和,減少對多糖的天然結構的破壞,最大程度保留玄參多糖結構的天然性,未能改變多糖的構象結構,這可能是多糖提高DPPH 自由基清除能力的結構基礎。由于微波為高效、瞬時提取,同時選擇不同比例的酶作為輔助提取,極大提高了多糖提取效率,同時,保持低溫環境下提取,盡量保持多糖活性不被破壞。提取多糖體外抗氧化活性證明,采用酶輔助微波提取法能夠最大程度地保持多糖抗氧化活性。

