高中化學建模解題方法及其應用
黃 征
(廣西南寧市第二十四中學,廣西 南寧 530001)
對于教師而言,引導學生靈活運用建模思想來解決化學問題,不僅可以使較為復雜的化學問題得到簡單化處理,同時也可以使學生的化學理論知識運用能力得到培養.教師在進行化學解題建模時,應該保證所構建模型的直觀性,使學生能夠充分理解模型意圖,這樣學生才能在化學課程學習過程中獲得更為豐富的主觀感受,同時也保證了化學課程的教學成效.
1 歸納構建模型方法一:晶體模型在解題中的應用
晶體知識點所占比例較大,與晶體知識有關的題目也是高考中的常見類型.對于晶體知識點而言,要求學生有較強的空間想象力及思維能力,從而掌握模型構建要點,這樣,才能實現對晶體問題的有效解答.
例1根據圖1所示幾種晶體或晶胞示意圖回答下列問題:
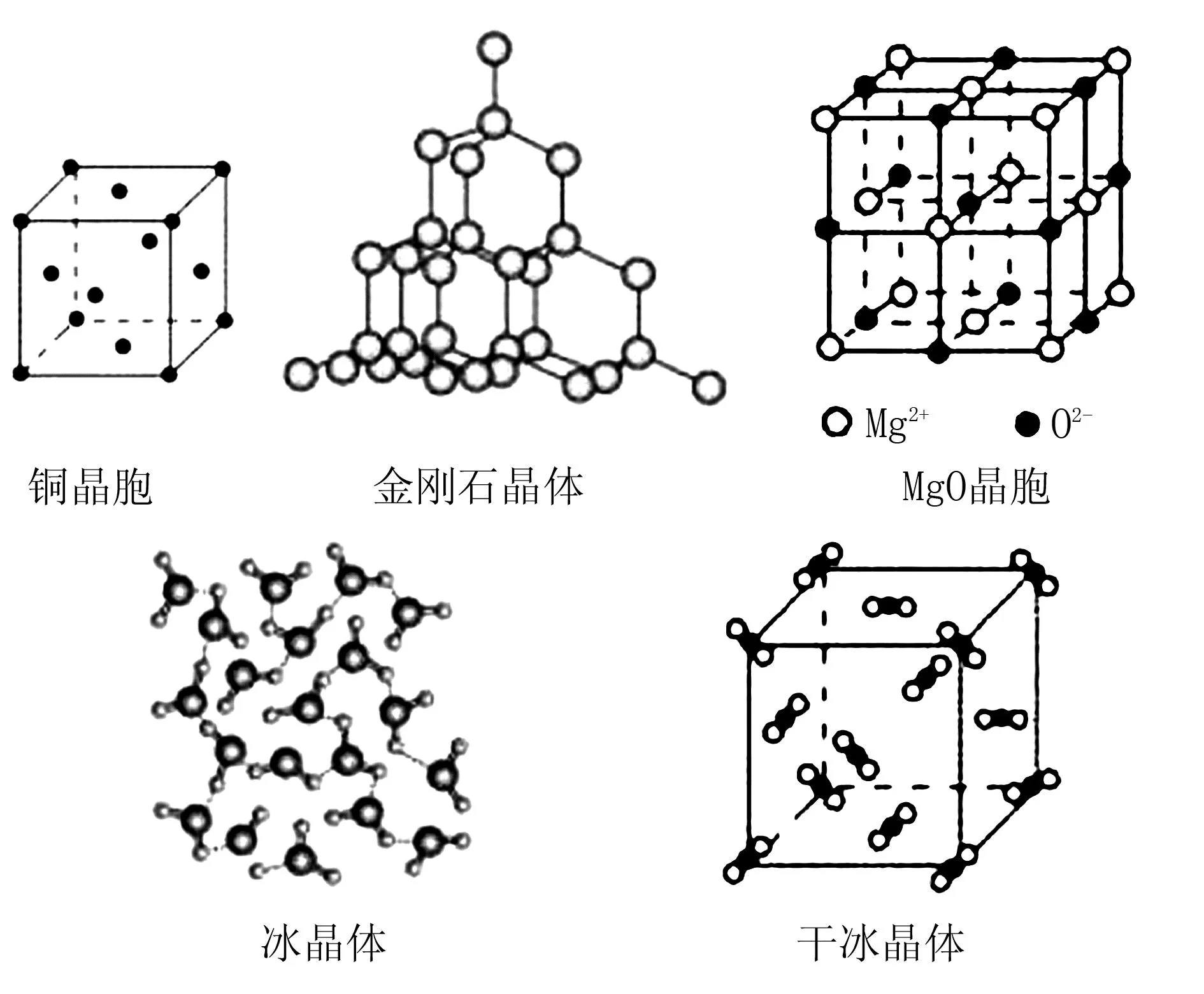
圖1 晶體晶胞示意圖
(1)在上述晶體類型中,粒子之間以共價鍵結合形成的晶體是( ).
(2)在上述種晶體類型中,熔點由高到低的順序依次是( ).
(3)冰的熔點明顯高于干冰,不僅因為H2O是極性分子,而CO2是非極性分子,還與( )有關.
想要完成上述化學題,需要先明確解題思維,學生對晶體結構相關知識要有深入的了解.就本題目而言,(1)屬于基本的概念性習題,只要熟悉晶體結構相關概念,就可以解出正確答案,而(2)(3)則需要學生較為靈活地運用晶體知識.具體來說,離子晶體的熔點與離子半徑、離子所帶電荷數有密切關系,離子半徑越小,且離子所帶電荷數越多,則表明離子晶體的熔點越高[1].對于金剛石晶體而言,其屬于原子晶體,熔點最高,而對于干冰、冰而言,其都是分子晶體,熔點要明顯低于金剛石.而將冰與干冰相比,由于冰中存在氫鍵,因此冰的熔點要高于干冰,因此,在對上述5種晶體或晶胞的熔點進行對比時,其熔點由高到低為:金剛石晶體>Cu晶胞>MgO>冰>干冰.
答案:(1)金剛石晶體
(2)金剛石晶體>Cu晶胞>MgO>冰>干冰
(3)H2O分子之間能夠形成氫鍵
2 歸納構建模型方法二:核外電子排布模型在解題中的應用
核外電子分布知識點是當前高中化學中的重要組成部分,教師在開展教學活動時,應該根據當前學生的認知能力及學習習慣確定相應教學方案,從而實現對學生的有效引導,這也更加有利于加深學生對于微觀世界的印象.教師在進行核外電子分布問題教學時,應該引導學生可以靈活運用模型思想來解決化學問題,這也可以使學生在化學學習過程中感受到趣味性.通過具象的模型構建讓學生對化學知識點深入探究,進而確定最為適宜的解題方法[2].同時,教師利用化學模型將微觀事物展示出來,也可以讓學生在解答化學問題時,思路更為清晰,更容易把握知識要點.
例2研究表明,核外電子的能量與電子數所在的層數、能級有直接關系,因此,核外電子的數目、電荷數也會對能量產生明顯影響,氬原子與硫原子的核外電子排布式分別為1s22s22p63s23p6和1s22s22p63s23p4,下列相關表述正確的是( ).
A.在3p能級,兩個粒子的電子到電子核之間的距離相等
B.在1s能級,兩個粒子電子能量相同
C.兩個粒子的化學性質相同
D.當兩個粒子發生電子跳躍時,粒子會產生不同的光譜
在解答此類化學習題時,學生要掌握相應規律,明確問題要點,這樣才能準確快速解出題目.根據題目內容畫出氬原子及硫原子的核外電子排布模型,結合模型情況來對兩個粒子進行對比.可以看出,雖然上述兩個粒子的核外電子排布相同,但電荷數量有所不同,因此二者的電子能量也自然不同[3].鑒于上述分析結果,可以確定B錯誤;而由于氬原子的核外電荷對電子的吸引力更大,其距離原子核更近,因此,可以判斷A錯誤;硫原子得到電子之后,其會形成穩定結構,因此得電子能力強,由此可以判定兩種粒子的還原性不同,因此C錯誤;當兩個粒子的電子能量不同,在發生電子躍遷時,所產生的光譜也有所區別,因此D正確.
答案:D.
3 歸納構建模型方法三:氧化還原模型在解題中的應用
氧化還原反應模型,是高中化學模型教學中所涉及的重要模型之一,需要教師對其模型理念進行深入分析,進而幫助學生掌握相應的解題技巧.在進行氧化還原反應模型構建時,應該將重點放在如何準確判斷氧化劑、還原劑、氧化產物及還原產物方面,同時還要注意對電子守恒定律進行應用,從而使相關化學習題迎刃而解[4].教師在進行氧化還原反應相關知識點教學時,也應該注意以學生現實情況為背景,找到教學切入點.教師要引導學生構建起氧化還原反應的基本模型,從而達到幫助學生理解氧化還原反應的效果[5].具體氧化還原反應模型如圖2所示.
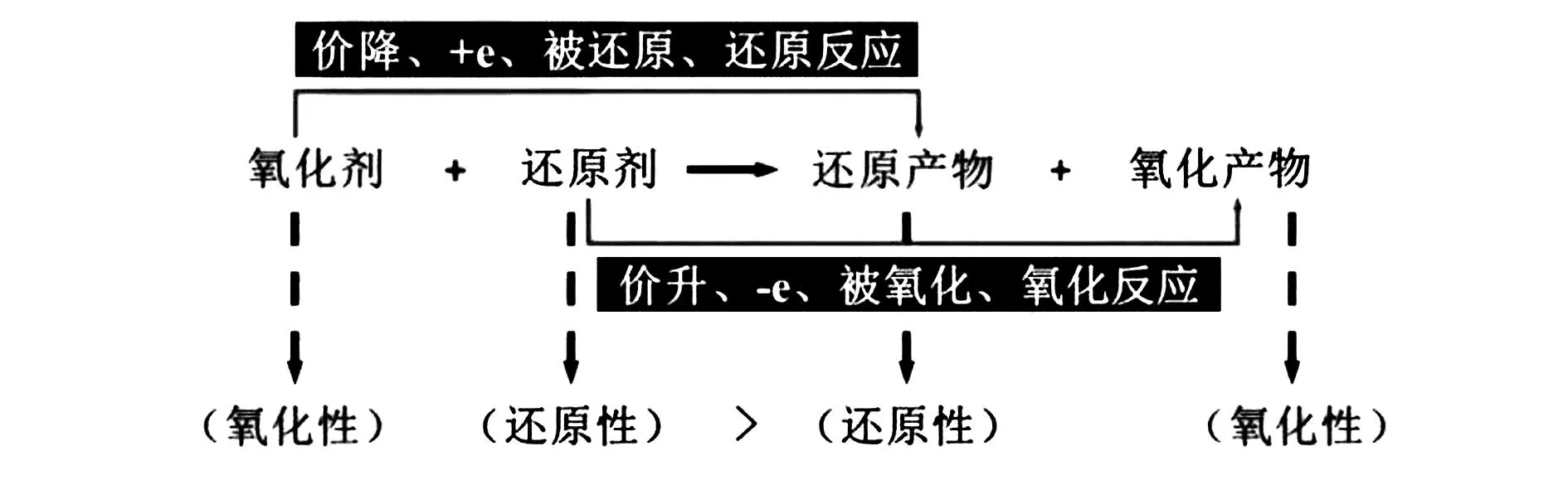
圖2 氧化還原反應基本模型
例3將一定量的氯氣通入100 mL 6 mol/L的氫氧化鈉溶液中,恰好實現完全反應,產物為NaClO3、NaCl、NaClO,下列關于上述反應的說法正確的是( ).
A.氫氧化鈉吸收的氯氣物質的量為0.3 mol
B.在反應過程中,轉移電子的物質的量為0.8 mol
C.反應過程中,三種產物的物質的量遵守電子守恒定律,但鈉元素不遵守守恒定律
D.反應完成后,溶液中的c(NaCl)≤0.5 mol/L
在本題中,想要實現對四個選項的說法是否正確進行準確判斷,應該通過構建氧化還原反應模型的方式來實現對產物物質的量的有效確定,從而為解題提供先決條件.通過分析氧化還原反應模型可知,在反應過程中,各物質遵循電子守恒,設定NaCl、NaClO、NaClO3物質的量分別為a、b、c,單位為mol,根據鈉元素守恒,則有a+b+c=0.6 mol[6].因此,可判定C項說法不正確;發生反應后,根據生成物情況可以得到,鈉原子與氯原子的個數比為1∶1,因此,可以通過計算得到氫氧化鈉吸收的氯氣物質的量為0.6/2=0.3 mol,即A選項正確;NaCl屬于還原產物,如果其轉移電子的物質的量為0.8 mol,將其帶入之后,發現所得到的產物物質的量關系式不能滿足氧化還原反應模型,即沒有體現出b+5c=a,由此可以判斷B錯誤;當反應完成后,溶液中NaCl的濃度為5 mol/L,因此D選項的說法錯誤.
答案:A.
4 結束語
總而言之,建模解題思路已經在當前高中化學教學中有較為廣泛的應用,實現了對學生解題能力的有效培養,同時也與當前學生學習習慣較為符合.今后,教師應該結合高中化學知識點對化學建模解題方式進行合理運用.目前,晶體模型、氧化還原模型、核外電子排布模型等都在化學解題中有一定影響,實現了對相應題型的有效解答,同時也使學生在學習過程中視野更為開闊,掌握了更多解題方式.教師還應該意識到,培養高中生解題模型構建與應用能力是一個長期過程,需要教師結合高中化學學科及學生實際情況確定入手點,使學生可以靈活借助解題模型來實現對化學問題的深入探究,這也可以使學生化學知識體系更為完善.教師在進行解題模型構建及引導學生學習時,應該著手將復雜的化學問題簡單化,從而更加便于學生理解,這也可以激發學生化學學習自主性.

