丙酸氯倍他索脂肪酸囊泡的經皮滲透性及抗銀屑病藥效的初步研究
趙雅欣,李彥杰,付琳,鄒博航,張向宇
(佳木斯大學藥學院/佳木斯大學實驗動物中心,黑龍江 佳木斯 154007)
銀屑病是一種常見的慢性炎性皮膚病,以紅斑、鱗屑、浸潤為主要特征,病因復雜且預后不良,嚴重影響患者的生活質量[1?5]。銀屑病的治療主要包括局部治療、光療和口服治療。局部治療是約80%的輕中度銀屑病患者的主要治療方法[6?10]。大多數皮膚病的誘因都是在皮膚下發現的,局部提供的藥物治療比全身的方法更受青睞,具有給藥方便、使用安全以及可避免首過效應等優點[11?12]。
丙酸氯倍他索(clobetasol propionate,CP)作為一種高效的糖皮質激素[13],具有抗炎、抗血管收縮、抗有絲分裂和免疫調節能力[14]。然而,CP 短期療效較好,長期局部應用可誘發皮膚不良反應,如局部萎縮和色素沉著等[15]。丙酸氯倍他索常見劑型以軟膏、凝膠等普通劑型為主,普通劑型一般都存在滲透性差、吸收效果差、療效不理想等缺點。
脂肪酸囊泡(fatty acid vesicles,FAV)是由脂肪酸的鹽溶液自組裝形成的2層封閉脂質膠體分散體系[16?18],具有兩親性結構,用于經皮給藥具有良好的相容性和滲透性,并且脂肪酸具有高可溶性,很容易迅速地分解成人工膜和天然膜[19]。油酸是一種單不飽和ω-9 脂肪酸,參與炎癥和免疫反應的調節[20],并且皮膚中含有的各種脂肪酸油酸占比最高,因此制備含油酸的脂肪酸囊泡更有利于膜的融合[21],有助于增強皮膚的屏障強度,可作為一種有效的皮膚滲透增強劑[22?24],使經皮給藥達到更好的治療效果。
基于此,本研究制備丙酸氯倍他索脂肪酸囊泡(CP-FAV),通過體外透皮實驗考察CP-FAV 的皮膚透過量和皮內滯留量,并考察其透皮機制及抗銀屑病的療效,為增加藥物滲透、延長藥物作用時間等研究奠定理論和實驗基礎,進而為銀屑病經皮給藥的臨床推廣提供參考。
1 儀器與材料
1.1 主要儀器
RE-5205A 旋轉蒸發儀(上海亞榮生化儀器廠);YB-P6 智能透皮試驗儀(天津藥典標準儀器廠);JY92-2D 超聲細胞粉碎機(寧波新芝生物科技有限公司);STA409PC 差示量熱掃描儀(北京恒久實驗設備有限公司);Spectrum100 傅里葉紅外光譜(PerkinElmer公司)。
1.2 材料
油酸(批號:20201130,國藥集團化學試劑有限公司);丙酸氯倍他索(批號:D1402028,上海阿拉丁生化科技股份有限公司);甲醇(天津科密歐化學試劑廠);PBS(批號:P1003,pH 7.4 北京索萊寶技術有限公司);雙蒸水(實驗室自制);5%咪喹莫特乳膏(批號:40220702,四川明欣藥業有限責任公司);白凡士林(批號:220702,青島錦麟生物科技有限公司)。
1.3 動物
SPF 級健康雄性KM 小鼠,體質量為18~22 g,購于長春市億斯實驗動物技術有限責任公司,生產許可證號為SYXK(吉)2020-0002,動物倫理批準文號:JMSU-2023101901。
2 方法與結果
2.1 CP-FAV的制備
薄膜分散-超聲法制備CP-FAV:精密稱取15 mg 油酸和10 mgCP 溶解于5 mL 甲醇溶劑中,置于干燥的圓底燒瓶中,減壓蒸發至有機溶劑完全揮干,在瓶壁底部形成均勻薄膜,然后加入PBS(pH7.4)溶液20 mL,室溫條件下水化2 h,探頭超聲14 min(285 W,開啟3 s,關閉2 s),即得CP-FAV。
2.2 體外透皮研究
2.2.1 離體小鼠皮膚的處理 用刮毛刀和脫毛膏去除小鼠背部毛,將小鼠脫頸處死,用組織剪剝離小鼠背部皮膚,再刮除皮下脂肪,冷凍儲存[25]。
2.2.2 體外透皮試驗 透皮試驗采用Franz擴散池[21]進行。冷凍的鼠皮用PBS(pH 7.4)解凍,用濾紙吸干水分。角質層朝向供給池,用固定夾固定,使真皮層與接收液體密切接觸。在測試過程中,在接收池中加入15 mL的接收液,并在供給池中加入待透皮的試劑。有效擴散面積為1.766 cm2,(37.0±0.2)℃恒溫水浴,并以200 r/min 磁力恒速攪拌。以不同的時間間隔精密吸取2 mL接受液樣品,隨即補回相應量,樣品經0.22 μm 微孔濾膜過濾后,計算各時間點單位面積皮膚的累積透過量(Qn):
式中:Qn為第n個取樣時間點的單位面積累積滲透量;V0為釋放介質總體積;Cn為第n個點的藥物濃度;Ci為第i(i=n?1)個點的藥物濃度;Vi為第i次取樣液體積;A為Franz擴散池有效擴散面積。
根據不同劑型在各時間點的取樣分析結果,繪制囊泡的累積滲透量(Qn)-時間(t)曲線,見圖1。可見,CP 原料藥溶液和CP-FAV 滲透趨勢基本一致,CP-FAV的累積滲透量高于原料藥溶液,24 h累積透皮量為原料藥溶液的2.88 倍。因此,脂肪酸囊泡不同程度提高了原料藥的皮膚透過率,其釋放相關方程擬合結果見表1,其體外滲透過程符合一級模型。

表1 CP-FAV滲透模型擬合結果Table 1 Fitting results of CP-FAV penetration model
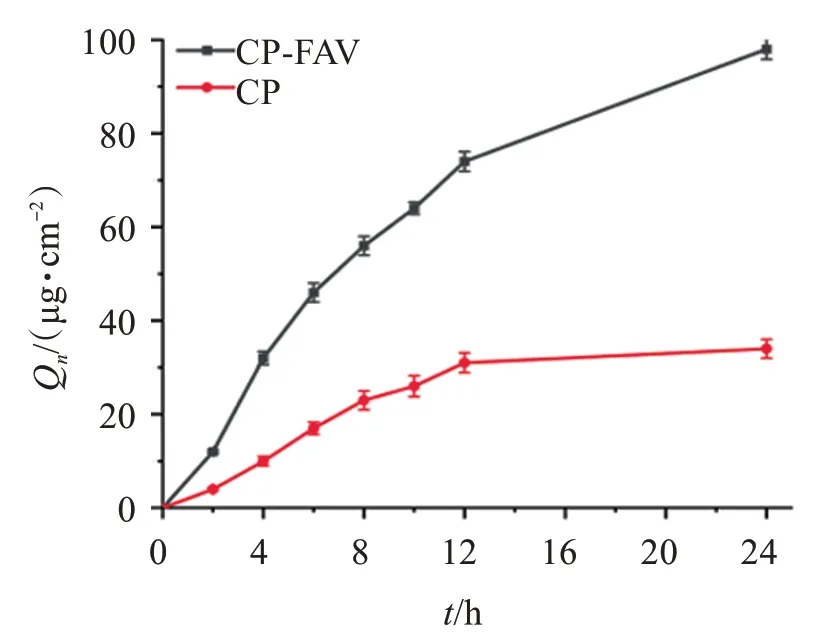
圖1 CP原料藥及CP-FAV體外滲透曲線Figure 1 Penetration curves of Free-CP and CP-FAV(,n=3)
2.2.3 體外皮膚滯留實驗 24 h后從Franz擴散池上取下皮膚,剪掉未接觸藥物的皮膚,生理鹽水去除皮膚表面殘留藥物。充分剪碎皮膚后分別用3 mL無水乙醇提取3 次,合并取上清液,10 000 r/min 高速離心10 min。每組皮膚滯留實驗各進行3 次。按以下公式計算單位面積皮內滯留量(Qm):
式中:Cm為提取液濃度,V為提取液體積,A為經皮滲透面積。
結果測得CP-FAV 皮膚滯留量遠大于CP,24 h皮膚滯留量為(88.79±2.2)mg/cm2,是CP 原料藥溶液的3.37 倍,可能是因為皮膚中含有大量脂肪酸,脂肪酸具有高可溶性,從而提高了藥物的遞送能力以及滯留能力。
2.3 載體對皮膚結構的影響
2.3.1 傅里葉變換紅外光譜(FTIR) 傅里葉變換紅外光譜圖可以通過皮膚角質層脂質和角蛋白次級結構的紅外吸收峰信息反映其結構變化[26]。按照“2.2.1”項方法處理小鼠離體皮膚,PBS(pH 7.4)及空白FAV 溶液2 mL 分別處理小鼠皮膚2 h,將干燥的皮膚樣品和KBr 進行充分的研磨直至粉碎均勻,取適量混合物進行壓片,進行FTIR 光譜分析(分辨率:2?1,掃描次數:100,掃描范圍:500~4 000 cm?1),光譜圖見圖2。
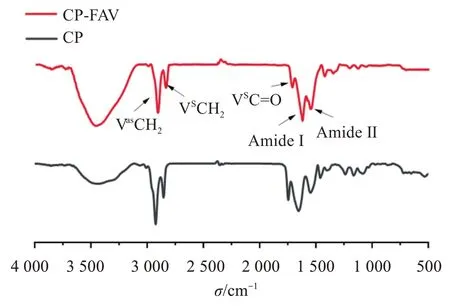
圖2 不同處理組小鼠皮膚的紅外光譜圖Figure 2 Spectrums of mouse skin in different treatment groups
體外透皮試驗對小鼠皮膚結構的影響主要是角質層細胞間的類脂組織,紅外光譜圖中顯示了類脂組織的—CH2酰基鏈的反對稱伸縮振動和對稱伸縮振動譜帶,不同載體處理后角質層脂質和角蛋白振動峰位移變化見表2。

表2 不同載體處理后角質層脂質和角蛋白振動峰位移變化Table 2 Vibrational peak displacement changes in cuticle lipids and keratins after treatment with different vectorsσ/cm?1
與對照相比,FAV 處理組對稱和不對稱—CH2的伸縮振動值變高,表明脂質由有序向無序轉變,這種轉變顯示了角質層中脂質的流動性增加,從而提高皮膚滲透能力。另外,FAV 處理組中角蛋白吸收峰的峰位產生明顯的藍移,表明處理皮膚后能夠影響角質層中角蛋白的螺旋結構,改變角質層致密結構而增加其對藥物的通透性[27]。
2.3.2 差示掃描熱分析方法(DSC) 按“2.2.1”項方法處理小鼠腹部離體皮膚,將處理12 h 的皮膚置于?80 ℃冰箱中預凍1 h,于冷凍干燥機中48 h 進行干燥脫水處理,取4 mg左右干燥后的皮膚樣品置于鋁坩堝中進行測定,考察FAV 對皮膚角質層相行為的影響。掃描速率為10 ℃/min,加熱范圍為0~300 ℃。
不同處理組小鼠腹部皮膚DSC結果見圖3。可見,PSB 處理的皮膚的相轉換溫度為78.44 ℃,FAV處理的皮膚的相轉換溫度為77.70 ℃。相轉變溫度向較低溫度的轉變可以作為脂質結構混亂的參數[28],經FAV處理的皮膚的相轉變溫度降低,說明增加了類脂質組織的流動性,從而使藥物和載體更加容易透過角質層。

圖3 不同處理組小鼠腹部皮膚DSC熱譜圖Figure 3 DSC thermogram of abdominal skin of mice in dif‐ferent treatment groups
2.4 體內藥效學研究
2.4.1 分組及建立模型 小鼠用苦味酸進行編號后,用刮毛刀刮出約2 cm×3 cm 大小皮膚。隨機分為模型組、空白組、CP-FAV 組及CP 溶液組,每組8只。除空白組小鼠用等量的白凡士林涂抹外,其余各組小鼠背部每日涂抹62.5 mg 的5%咪喹莫特乳膏,1次/d,連續7 d。造模期間小鼠皮膚起初為境界清楚、形狀大小不一的紅斑,稍有浸潤增厚,后續發展為表面覆蓋多層銀白色鱗屑,見圖4。從造模小鼠皮膚形態看,模型和參考文獻基本一致[29?30]。
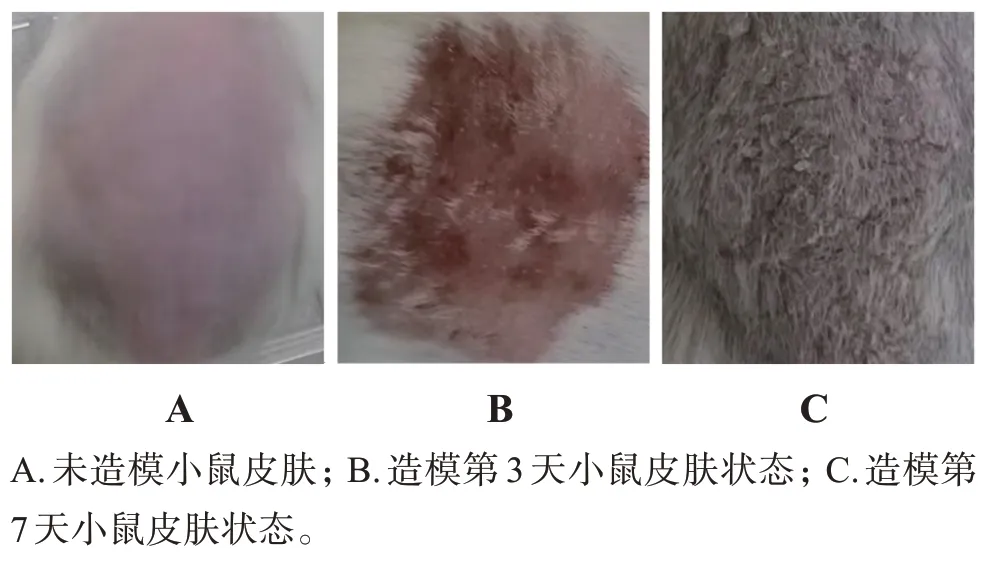
圖4 小鼠造模皮膚皮損狀況Figure 4 Conditions of molded skin in mice
2.4.2 銀屑病皮損面積及嚴重程度指數(PASI) 每日觀察并拍照記錄各組小鼠的皮損變化,參照PASI評分標準。對各組小鼠皮損處紅斑、鱗屑及浸潤增厚程度進行評分,并根據各自的嚴重程度分為1~5級,對應0~4分[31],各組小鼠PASI評分見圖5。
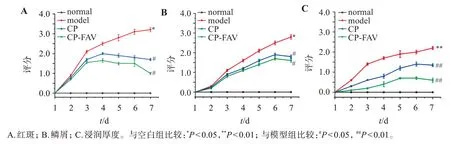
圖5 各組小鼠PASI評分Figure 5 The PASI scores of the mice in each group(,n=3)
可見,與正常組相比,模型組小鼠的背部紅斑面積擴大(t=?4.580,P<0.05),鱗屑明顯增多(t=?3.663,P<0.05),皮膚增厚浸潤程度嚴重(t=?4.571,P<0.01)。經各處方組治療后的小鼠紅斑、鱗屑、皮膚增厚浸潤程度均有所下降,其中CP-FAV效果最顯著,與模型組相比差異均具有統計學意義(P<0.05 或P<0.01),在實驗期間觀察到紅斑、鱗屑和皮膚增厚強度進展一致,不同治療組中3 個參數的嚴重程度降低程度不同。
2.4.3 組織病理學觀察 將小鼠脫頸處死后,剪取相對應皮損處組織,固定于10%甲醛中,經脫水、石蠟包埋、切片、HE 染色,光學顯微鏡下觀察皮損組織病理形態并拍照[32],結果見圖6。可見,空白組小鼠皮膚組織的表皮層薄,細胞浸潤少;模型組小鼠表皮細胞層明顯增厚,真皮層可見大量炎性細胞浸潤,皮損組織呈銀屑病樣改變;CP 組和模型組類似,但是表皮增厚、細胞浸潤程度等都比模型組輕;CPFAV 組小鼠皮損表皮厚度較模型組降低明顯,真皮層炎性細胞浸潤明顯減少,效果較CP組更明顯。

圖6 各組小鼠皮膚組織HE染色結果Figure 6 Results of HE staining of skin tissue in each group of mice(×100)
3 討論
銀屑病可見于任何年齡段人群,常反復發作,亞洲成年人發病率約為0.14%[33]。經皮局部治療最常用激素類藥物,但銀屑病需長期治療,為了改善激素類停藥后易復發、遠期療效較差等缺點,本課題提出了暫時還沒有應用于臨床治療報道的CP-FAV,并進行了體外經皮滲透性和皮膚滯留量實驗。從本文研究結果看出,與CP 原料藥比較,CP-FAV 可顯著增加藥物的滲透量,提高皮膚表面的藥物滯留量,有利于藥物在皮膚內形成藥物儲庫并緩慢釋放,并且皮膚中含有大量的脂肪酸還可以作為生物活性物質通過與脂質基質相互作用來降低皮膚擴散阻力的滲透促進劑[34?35],提高了其局部治療銀屑病的功效,較普通溶液可以減少使用次數,降低不良反應。同時,本研究還考察了FAV 對皮膚結構的影響作用,結果顯示FAV 并沒有對皮膚結構造成破壞,而是提高了角質層的類脂質流動性,促進了藥物在皮膚角質層的滲透轉移。
咪喹莫特誘導的銀屑病樣小鼠模型可以全面、穩定地擬生銀屑病樣臨床表征,是一種操作簡便且較為理想的評估銀屑病藥物治療的實驗動物模型。基于銀屑病PASI 評分和皮膚組織病理學樣本,CPFAV 減少了小鼠皮膚炎癥,并對銀屑病小鼠有顯著的治療作用。
綜上所述,CP-FAV 為銀屑病經皮給藥提供了新的劑型選擇,為以后經皮給藥的實際應用提供一定的參考價值和依據。
(本文所有作者聲明不存在利益沖突關系。)

