鋰離子電池材料鈦酸鋰的研究進展
馬 勇,陳品德,秦龍威,文春鵬,夏 鑫
(新疆大學紡織與服裝學院,新疆烏魯木齊 830017)
近年來,隨著智能產品、移動電車以及儲能設備的發展,開發具有使用時間長、工作溫度范圍寬、循環壽命長、能量密度高等特點的新型電極材料受到人們的廣泛關注[1]。尖晶石結構的Li4Ti5O12由于具有平坦的充/放電電勢平臺(約1.55 Vvs.Li+/Li),而有機電解質在1.0 V 以下才能進行還原,因此可以有效地避免SEI 膜和鋰枝晶的形成;同時在鋰離子脫嵌的過程中,其晶體結構和晶胞參數幾乎沒有任何改變,被譽為“零應變”材料。但Li4Ti5O12材料的鋰離子擴散系數(2×l0-8cm2/s)和本征電 導率(<1×10-9S/cm)很低[2],因此在高電流密度的情況下,鈦酸鋰電極的工作極化非常嚴重,導致電極容量急劇下降等問題[3]。人們對改善鈦酸鋰的導電性做了大量的研究,主要圍繞合成、摻雜以及包覆來進行改性。
1 鈦酸鋰的結構
鈦酸鋰常溫下是白色粉末,分子式為Li4Ti5O12,是Li2O-TiO2系列的一個穩定(2Li2O-5TiO2),是面心立方晶系,屬于AB2O4尖晶石型結構,空間群為Fd3m,晶胞參數為0.836 nm。氧原子在32e 位形成立方密堆積排列,3/4 的Li 位于四面體的8a 位,Ti 和其余的Li 隨機分布在八面體的16d 位,因此鈦酸鋰也可以寫成[Li]8a[Li1/3Ti5/3]16d[O4]32e[4-6],如圖1 所示[7]。
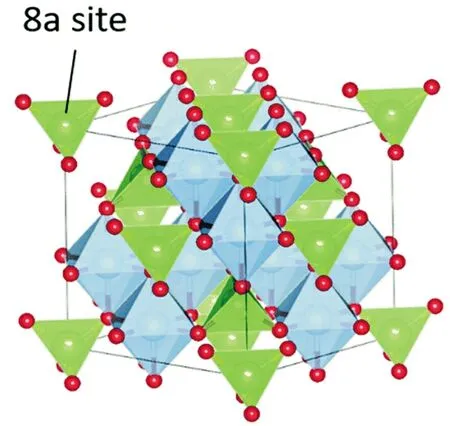
圖1 Li4Ti5O12原子結構示意圖
在充放電階段,材料由于鋰離子的脫嵌,進行Li4Ti5O12結構與巖鹽結構Li7Ti5O12([Li6]16c[Ti5Li]16d-[O12]32e)的轉變。與此同時,16d 位點60%的Ti4+被還原為Ti3+,具體轉化過程可用方程式表示:
經過此階段發現鋰離子及其嵌體對材料結構幾乎沒有影響,其晶胞參數a僅從0.836 nm 增加到0.837 nm,體積變化小于0.2%,經過多次循環,僅有很小的容量損失,所以被稱作“零應變”電極材料[8]。因此鈦酸鋰作為鋰離子電池的負極材料得到了廣泛的關注。
2 鈦酸鋰的合成方法
鈦酸鋰的形貌和電化學性能與其制備方法密切相關,其中高溫固相反應法、溶膠-凝膠法和靜電紡絲法是最常用的方法。通過改變不同的制備方法,所獲得材料的微觀結構(形貌、顆粒大小等)以及電化學性能都存在差異[9]。因此,找到合適的制備方法與制備條件是重中之重。
2.1 高溫固相法
高溫固相法是將前驅體材料(LiOH·H2O、Li·H2O、Li2CO3、TiO2)通過研磨或機械球磨的方式均勻混合,再經過長時間的高溫煅燒后得到最終產物的一種常用方法。高溫固相反應是由反應從兩相接觸界面開始,以及反應物和反應物在相界面上的遷移兩部分組成,這種合成方法不僅操作簡單、易于工業生產,而且最終產品結晶度高、循環性能好,但受工藝影響很大,如原料的選擇、原料的比例、反應溫度、反應時間等,而且合成的材料存在產品顆粒大、形貌不規則和倍率性能差等缺點[10]。
Bai 等[11]以銳鈦礦TiO2、Li2CO3及NH4F 為原料進行固相反應,將摩爾比4∶5 的材料在球磨機中混合4 h,去離子水分散,烘干,800 ℃的空氣中煅燒12 h,室溫下退火,得到Li4Ti5012-xFx(x=0,0.1,0.2,0.3)材料。其中Li4Ti5011.9F0.1電極材料不僅能很好地保持顆粒均勻性(直徑尺寸約1 μm),相比其他樣品還具有更高的倍率性能和更穩定的循環性能,當充電倍率在30個周期后恢復到0.2C時,電極比容量還可達到163.0 mAh/g,經過150 次循環后容量保持率為82.7%。除此之外,Li4Ti5011.9F0.1電極還比其他電極具有更高的傳遞動力學、較低的電極極化和更高的鋰離子擴散系數。
Qian 等[12]通過將噴霧干燥法與高溫固相法相結合,成功地制備出高放電容量的Li4Ti5O12材料。該材料的初始放電比容量可達240.6 mAh/g,并且在低溫條件下擁有優異的性能,在5 ℃循環200 次后,放電比容量還能達到144.7 mAh/g,并保持接近100%的庫侖效率,具有良好的循環性能。這是由于鉻的摻雜來占據鋰的8a 位置,使8a 位置的鋰在插層過程中不能自由遷移,從而避免放電時電壓降低,使電壓穩定在1.55 V 的平臺上,保證穩定的功率輸出和高安全性。
2.2 溶膠-凝膠法
溶膠-凝膠法是將含鈦物質和含鋰物質制備成一定濃度的溶液,攪拌均勻形成溶膠-凝膠,再將溶膠-凝膠經過干燥、研磨、高溫煅燒等工序后得到Li4Ti5O12粉末[13]。通過溶膠-凝膠法制備的Li4Ti5O12不僅具有產物粒度小、分布窄、均一性好、過程可控的優勢,而且由于顆粒尺寸的減少,縮短了鋰離子的擴散路徑,進而提高了電池的倍率性能。但溶膠-凝膠法也有一定的缺點,如效率較低、制備過程復雜、耗時較長[14]并且在高溫處理反應過程中體積變化大,釋放出大量的CO2,因此這種方法不適合實際應用。
Liu 等[15]采用兩相界面反應(環己烷/水)溶膠-凝膠法研究并制備了粒徑為100 nm 的Li4Ti5O12負極材料,通過實驗驗證,該材料不僅獲得了優異的容量和穩定性,并且在在10C和20C的高倍率下循環50 次后,其放電比容量還可以達到150 和126.6 mAh/g,超高倍率能力和優異的循環性能可能歸因于納米顆粒、高比表面積和介孔結構的優點。因此,從該方法衍生出來的納米Li4Ti5O12將是大功率鋰離子電池有吸引力的負極材料。
Feng 等[16]通過傳統的溶膠-凝膠方法首次成功制備了Ce-LTO/C@MWCNTs 負極材料,這樣一種獨特的結合方式會增加固有和表觀電子電導率,使其呈現出良好的大倍率性能和長循環穩定性。在0.2C、0.5C、1C、2C、5C和10C下合成材料的放電比容量分別可達到171.5、169.3、166.5、162.2、155.9 和145.3 mAh/g。此外,合成的材料即使在20C的高倍率下經過600 次循環后,容量保持率仍然可以達到98.6%。
2.3 靜電紡絲法
靜電紡絲是一種特殊的纖維加工技術[17]。在靜電紡絲過程中,通過電場的作用,針頭處的液滴會由球形變為圓錐形(即“泰勒錐”),并從圓錐尖端延展得到纖維細絲,可以通過改變電源線的分布來控制納米纖維的取向,最后附著在收集板上進行收集。針對Li4Ti5O12,常見合成工藝是先將鋰源和鈦源在溶劑中進行分散,配置成粘性紡絲溶液,然后通過靜電紡絲的方法進行材料前驅體的制備,而細絲狀Li4Ti5O12材料可通過在不同氣氛中進行熱處理獲得[18]。
王瑜東等[19]將無水醋酸鋰、鈦酸鋰異丙酯在溶劑中進行混合,通過添加聚乙烯吡咯烷酮(PVP)配制紡絲液,通過靜電紡絲制備出纖維前驅體,再通過750 ℃下保溫5 h 的熱處理可得空心纖維絲狀鈦酸鋰。經測試可知在低放電倍率條件下,所得Li4Ti5O12放電比容量均可達170 mAh/g;20C下循環200 次后,容量保持率仍保持在98.46%。因此可知空心結構使得Li4Ti5O12材料的極化程度減少,電化學反應阻抗降低,更有利于電化學反應的進行。
Xiangting Dong 課題組[20]采用靜電紡絲技術合成了直徑為60 nm 的Li4Ti5O12/Li2TiO3復合纖維材料。當鈦鋰摩爾比為4.8∶5 時,初始放電比容量可達216.07 mAh/g。在20C的高電流密度下,1 000 次循環后的容量保持率仍可達81.41%。這些性能可歸因于超細納米纖維的納米結構,用于表面鋰的儲存和適當Li 的摻入來穩定主體材料的結構,并提高電子和離子的電導率。
除了上述介紹的方法,還有模板法、燃燒法、微波法、熔鹽法、水熱合成法、微乳液法等也可以進行鈦酸鋰的合成。
3 鈦酸鋰材料的改性
鈦酸鋰晶體結構穩定,安全性高,對環境友好,是一種優秀的鋰離子電池負極材料。但是其本身只有很低的鋰離子擴散系數(2×l0-8cm2/s)和本征電導率(<1×10-9S/cm),這導致鈦酸鋰在大電流下的循環性能以及倍率性能較差,因此為了提高鈦酸鋰的電化學性能,通常用離子摻雜以及表面包覆兩種方法對鈦酸鋰進行改性。
3.1 離子摻雜
離子摻雜這一改性方法,可以有效地改變LTO固有的電子導電性和鋰離子擴散系數,從而提髙容量和倍率性能。通過在LTO 晶格內摻入氧化態離子(例如Zn2+、Mg2+、Al3+、Cr3+、Sc3+、Sm3+、Sb5+、W6+、N3-、Br-)取代晶格內的鈦離子、鋰離子和氧離子,從而誘導Ti4+到導電Ti3+離子的還原,使Li4Ti5O12內在電導率得以提高。除此之外,摻入的大多數離子具有更大的離子半徑,在未改變LTO 晶體結構的基礎上,使晶格參數變大,從而增大離子和電子的傳輸路徑。基于此,離子摻雜在根本上加強了充電/放電過程中Li+導電性,進而增強材料的倍率性能[21]。陰離子摻雜主要通過其他陰離子(包括F-、Br-、N3-)取代O2-,以產生更多的Ti3+來平衡晶體的價態。
對鈦酸鋰進行大量離子摻雜改性,結果如表1 所示。通過各個離子的摻雜不僅提高了材料本身的電導性,更提高了其循環穩定性。由表1 可知,摻雜Na、K 使材料的晶格參數和體積增大,有利于電子電導率和鋰遷移,從而提高倍率能力;摻雜價態較低的稀土元素(Y、Gd、Tb、Dy),提高材料晶格電導率和Li離子擴散系數,改善電化學循環穩定性、可逆容量和高倍率放電能力;摻雜Cr可以減少極化現象,提高材料的電化學穩定性;Li、Cl、Zr、W 的摻雜可以改善鋰離子擴散系數,降低電荷轉移電阻。
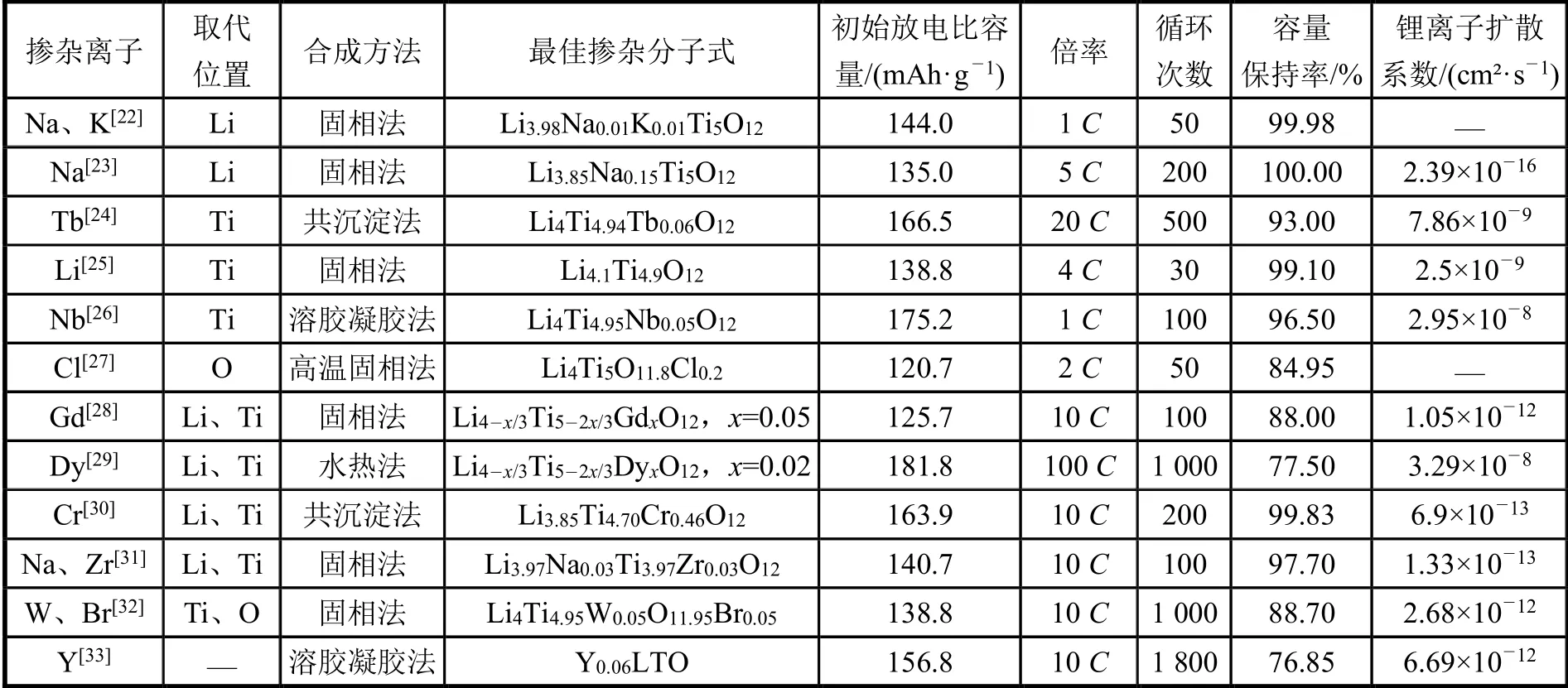
表1 不同摻雜離子電池性能改性
3.2 包覆
由于鈦酸鋰的電子導電性差,在充放電過程中會引起較大的極化,這種情況在大電流下更加嚴重。通過包覆導電性良好的Ag、Sn、金屬氧化物、碳材料等對表面進行改性,可以加強電子導電性和粒子間的電子互聯性,進一步提高電化學特性。
對鈦酸鋰進行包覆,結果如表2 所示。由表2 可知,包覆銀可以在整個材料表面構建導電網絡,有利于鋰離子和電子的傳輸;LMSO 涂層可以抑制晶粒進一步聚集和生長,阻礙材料與電解質之間的副反應,削弱極化,提高材料的電子導電性;高導電碳層的包覆使材料具有優異的高放電容量和良好的倍率循環性能;均勻的PEDOT 涂層提高了材料表面/界面導電性,在充放電過程中能提高復合材料的比容量。
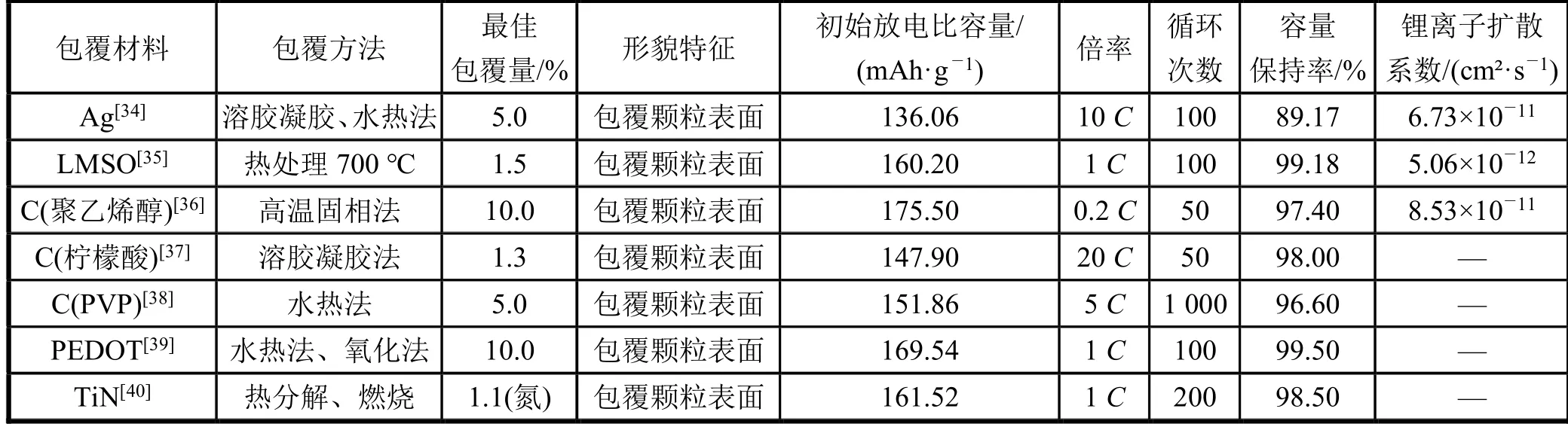
表2 不同包覆材料電池性能改性
尖晶石Li4Ti5O12材料,由于具有充放電循環過程中體積變化小于1%、[Li1/3Ti5/3]O4框架為快速鋰離子擴散提供了一個三維通道網絡,表現出良好的循環性能。但是電導率的不足,對其倍率性能產生了負面影響,限制其進一步發展。通過合成納米尺寸Li4Ti5O12、包覆表面修飾、離子摻雜等一系列方法對其進行改性,可使高倍率性能得到改善,其中納米尺寸的Li4Ti5O12具有縮短鋰離子擴散距離、表面積變大的特點;包覆表面修飾可以形成導電層和導電網絡,提高導電性;離子摻雜可以形成Ti 的混合價態,有利于電子遷移。
新疆大學的多功能材料實驗室常年致力于儲能器件的研究,通過將N 摻雜的碳粒子固定在LTO 粒子表面的包覆方法來提高LTO 的電化學性能。具體如下:首先將LTO 顆粒與作為碳源的2-甲基咪唑充分混合,然后在氮氣氣氛中熔化和熱解,使碳粒子固定,從而促進Li+存儲的活性位點和脫嵌過程中的電極反應動力學。通過涂覆的方法,使LTO、炭黑、PVDF 的質量比為8∶1∶1 進行極片的制備并進行電池的組裝,由圖2 可知:材料的倍率性能得到很大程度的提高,即使在10C的條件下,還有125 mAh/g 的比容量,且當倍率逆回至0.1C時,比容量與初始值大致相同,具有良好的可逆性。因此結果表明,改性可以大大提高LTO 材料的倍率能力。另外,在1C的條件下測試電池的充放電性能可知,循環200 次電池的容量衰減幾乎為0,容量保持率可達到99%以上。

圖2 改性LTO的性能
4 總結
鈦酸鋰因其特殊的結構特點,被譽為“零應變”材料,具有普通負極材料沒有的優異循環性能,更適合迅速發展的電動汽車等行業。針對鈦酸鋰電池改善鋰離子擴散系數和電子電導率方面,科研工作取得了很大的進展[3];但仍有相當一部分問題難以解決。目前提高鈦酸鋰導電性的策略主要有三種:一是納米化,通過不同的制備方法,制備納米尺寸的鈦酸鋰材料,從而縮短鋰離子在鈦酸鋰中的傳輸路徑;二是通過包覆導電性良好的材料對表面進行改性,從而加強電子導電性和粒子間的電子互聯性,提高材料導電性;三是通過離子摻雜,在根本上加強了充放電過程中Li+導電性進而增強材料的電化學性能[41]。

