基于HIF-1α/VEGF通路探討續苓健骨方對去卵巢大鼠骨代謝和局部血管生成的影響
謝冰穎,李生強,林若慧,黃小彬,黃景文,謝麗華,葛繼榮*
(1.福建中醫藥大學中醫學院,福建 福州 350122;2.福建省中醫藥科學院,福建 福州 350003;3.福建省中西醫結合防治骨質疏松重點實驗室,福建 福州 350003)
隨著我國人口老齡化日趨嚴重,骨質疏松癥已成為我國面臨的重要公共健康問題,其中絕經后骨質疏松癥(post menopausal osteoporosis,PMOP)占大部分。PMOP 是一種高轉換型骨質疏松癥,其骨吸收大于骨形成,屬于原發性骨質疏松的范疇。大多數女性在絕經后5~10 年骨量進入快速丟失期[1],往往伴隨著疼痛、脊柱變形等嚴重并發癥,危害中老年人的社會健康、心理健康和生活質量,并給社會、家庭經濟帶來沉重負擔,因此,PMOP 的臨床防治是亟待解決的問題[2]。
《Nature》報道了成骨與成血管之間的耦聯作用[3-4],提示了血管生成對于新骨形成及防治骨質疏松癥的重要意義。目前研究認為血管形成的減少促進了骨質疏松的發生,而局部血管形成的增加則能延緩骨質疏松的進程[5]。低氧誘導因子-1α(hypoxia inducible factor-1α,HIF-1α)介導的血管內皮生長因子(vascular endothelial growth factor,VEGF)是耦聯成血管成骨的重要通路之一。續苓健骨方是福建省中醫藥科學院葛繼榮研究員長期從事骨質疏松癥臨床研究并結合臨床實踐總結出來的經驗方,具有補腎壯骨、健脾益氣、活血化瘀的功效,對PMOP 患者疼痛等臨床癥狀和中醫證候改善療效頗佳[6]。本研究通過建立去卵巢大鼠模型,觀察續苓健骨方對卵巢摘除(OVX)大鼠骨密度及骨微結構、股骨遠端血管生成和HIF-1α/VEGF信號通路的影響,以探討本方防治PMOP的作用機制。
1 實驗材料
1.1 實驗動物 24只3 月齡SPF 級的Sprague-Dawley 雌性大鼠購自上海斯萊克實驗動物有限公司,體質量為(210±20)g,實驗動物生產許可證號為SCXK(滬)2007-0005,動物質量合格證號為2007000530078。大鼠飼養在福建省中醫藥科學院比較醫學中心,實驗動物使用許可證號為SYXK(閩)2016-0005,實驗方案經福建省中醫藥科學院動物實驗倫理委員會批準(審批號:FJATCM-IAEC 2018034)。
1.2 實驗藥品 續苓健骨方(專利號:ZL20151078 4227.4)主要是由川續斷、骨碎補、茯苓、白術、紅花等組成,方中中藥飲片購自廈門燕來福制藥有限公司,共122 g。煎煮方法:首煎加冷水沒過中藥,浸泡30 min,武火煮沸后文火繼續煮20 min;次煎再加冷水沒過中藥,武火煮沸后再文火煮20 min。分別將兩次藥液過濾后混合,采用旋轉蒸發儀濃縮至含生藥濃度1.5 g/mL 藥液,密封置于4 ℃冰箱保存備用。補佳樂戊酸雌二醇片(拜耳醫藥保健有限公司,批號:640A)加適量生理鹽水,配制成0.0125 mg/mL 雌二醇藥液。
1.3 實驗試劑 HIF-1α 一抗(成都正能生物技術有限責任公司,貨號:340462);VEGFA 一抗[艾博抗(上海)貿易有限公司,貨號:ab231260];分化決定簇抗原31(CD31)一抗[艾博抗(上海)貿易有限公司,貨號ab124432];CD31 二抗(美國Jackson ImmunoResearch Laboratories 公司,貨號:115-035-003);大鼠酶聯免疫分析試劑盒Ⅰ型前膠原氨基端原肽(P1NP,貨號:ml038224)、Ⅰ型膠原交聯C 末端肽(S-CTX,貨號:ml915040)、雌二醇(E2,貨號:ml915040)均購自上海酶聯生物科技有限公司。
2 方 法
2.1 分組與造模 24 只大鼠按隨機數字表法分成假手術組、模型組、續苓組和雌二醇組,每組6 只。使用4%戊巴比妥鈉溶液對4 組大鼠進行注射麻醉,假手術組切除雙側卵巢附近與卵巢體積大小相近的脂肪組織,按文獻[7]所述方法對其余3 組大鼠進行雙側卵巢切除術。每只大鼠術后注射青霉素鈉溶液8 萬U,連續3 d。
2.2 給藥方法 術后1 周后開始藥物灌胃干預以進行預防性治療。根據人與大鼠臨床等效劑量系數折算法換算,續苓組按體質量1 mL/(100 g·d)灌胃含生藥濃度1.5 g/mL 續苓健骨方藥液,雌二醇組按體質量1 mL/(100 g·d)灌胃0.0125 mg/mL 雌二醇藥液,其余2 組給予等體積生理鹽水灌胃。4 組大鼠灌胃次數均為每天1 次,連續灌胃12 周。
2.3 取材及樣本采集 末次給藥后第2 天,4%戊巴比妥鈉溶液麻醉大鼠取材。在大鼠腹主動脈取全血后,離心分離血清置于-80 ℃冰箱保存,用于ELISA 檢測;取左脛骨于-20 ℃保存,用于骨密度檢測;取左股骨于4%多聚甲醛固定液中固定,用于制備骨組織切片。
2.4 4 組骨密度檢測、Masson 染色及骨形態學分析 使用雙能X 線骨密度儀(美國Hologic 公司,型號:W 型)掃描測定左脛骨近端骨密度;大鼠左股骨固定48 h 后,采用10%EDTA 脫鈣液進行常規脫鈣4 周。脫鈣結束后,切取股骨遠端骨組織,常規脫水包埋切片。將65 ℃烤片后的骨組織切片先進行二甲苯、梯度乙醇脫蠟至水,然后放入麗春紅染液浸染,取出沖洗后放入1%磷鉬酸溶液脫色,接著取出沖洗后放入5%固綠染液浸染,沖洗干燥后封片。使用倒置顯微鏡圖像系統采集圖像后選擇股骨干骺線下中央部位測量感興趣區域(AOI),并使用Image Pro Plus (IPP) 6.0 軟件自動分析Masson 染色切片的骨小梁面積百分比(Tb.Ar%)、骨小梁寬度(Tb.Wi)、骨小梁間距(Tb.Sp)。
2.5 4 組血清E2、P1NP、S-CTX 水平檢測 按照ELISA 試劑盒說明書上的實驗步驟分別進行標準品孔和樣品加樣、酶標試劑、洗滌、顯色。反應結束后用吸收光酶標儀檢測,記錄450 nm 處波長,計算血清E2、P1NP、S-CTX 水平。
2.6 4 組CD31、HIF-1α、VEGF 蛋白表達水平 采用免疫組織化學Envision TM Systems 法染色目的蛋白,通過IPP 軟件選取棕黃色或棕褐色作為蛋白陽性標識,自動分析統計免疫組化染色切片的累計光密度值、陽性表達面積,并計算出4 個視野下的平均光密度值(累計光密度值/陽性表達面積)。平均光密度值越大,免疫組化(IHC)的陽性表達越強,表明蛋白表達水平就越高。
2.7 統計學方法 應用SPSS 22.0 軟件對數據進行統計學處理。計量資料符合正態分布以(±s)表示,多組間比較采用單因素方差分析(One-way ANOVA),組間兩兩比較方差齊采用LSD-t 檢驗。P<0.05 表示差異有統計學意義。
3 結 果
3.1 4 組左脛骨近端骨密度比較 見表1。
表1 4 組左脛骨近端骨密度比較(±s) g/cm2
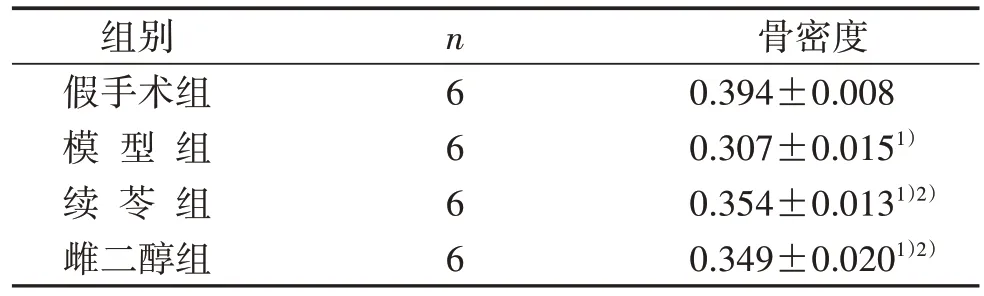
表1 4 組左脛骨近端骨密度比較(±s) g/cm2
注:與假手術組比較,1) P<0.05;與模型組比較,2) P<0.05。
骨密度0.394±0.008 0.307±0.0151)0.354±0.0131)2)0.349±0.0201)2)組別假手術組模 型 組續 苓 組雌二醇組n6 6 6 6
3.2 4組骨形態及Tb.Ar%、Tb.Wi、Tb.Sp比較 Masson 染色后比較4 組骨形態:與對照組比較,模型組骨小梁較為稀疏,間距較大;與模型組比較,續苓組、雌二醇組骨小梁較緊密,間距較小。見圖1。骨形態學參數比較見表2。
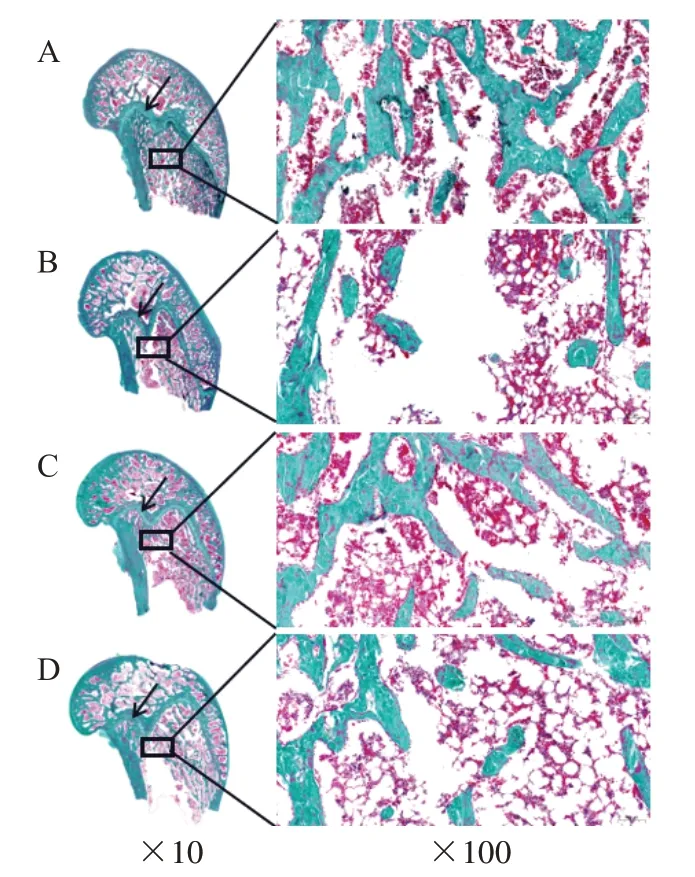
圖1 4 組股骨遠端矢狀面Masson 染色圖
表2 4 組Tb.Ar%、Tb.Wi、Tb.Sp 比較(±s)

表2 4 組Tb.Ar%、Tb.Wi、Tb.Sp 比較(±s)
注:與假手術組比較,1) P<0.05;與模型組比較,2) P<0.05。
Tb.Sp/μm 83.134±21.726 171.276±84.1521)69.497±33.0192)62.771±26.7752)組別假手術組模 型 組續 苓 組雌二醇組n6 6 6 6 Tb.Ar %37.460±6.816 16.525±5.1671)33.227±7.7432)28.763±5.1131)2)Tb.Wi/μm 50.612±24.282 30.692±8.913 31.001±11.121 29.114±12.592
3.3 4 組大鼠血清E2、P1NP、S-CTX 水平比較 見表3。
表3 4 組血清E2、P1NP、S-CTX 水平比較(±s)

表3 4 組血清E2、P1NP、S-CTX 水平比較(±s)
注:與假手術組比較,1) P<0.05;與模型組比較,2) P<0.05。
S-CTX/(nmol/L)8.246±0.385 9.302±0.3071)8.536±0.2512)8.767±0.971組別假手術組模 型 組續 苓 組雌二醇組n6 6 6 6 E2 /(ng/L)148.344±2.478 139.183±4.8151)146.965±4.9842)154.139±6.7632)P1NP/(pg/mL)73.437±6.189 65.295±5.8251)81.279±4.5061)2)87.590±2.0941)2)
3.4 4 組骨微結構及CD31、HIF-1α、VEGF 蛋白表達水平比較 與對照組比較,模型組的股骨遠端切片視野中棕黃色染色物分散、稀疏,伴有大量脂肪細胞;與模型組比較,續苓組、雌二醇組棕黃色染色物增粗,面積增大,連續性較好,伴隨脂肪細胞及空泡的減少,見圖2。4 組大鼠左股骨遠端CD31、HIF-1α、VEGF 蛋白表達水平,見表4。
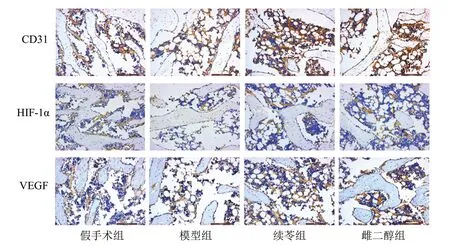
圖2 4 組CD31、HIF-1α、VEGF 免疫組化染色圖(×200)
表4 4 組左股骨遠端CD31、HIF-1α、VEGF 蛋白表達水平比較(±s)

表4 4 組左股骨遠端CD31、HIF-1α、VEGF 蛋白表達水平比較(±s)
注:與假手術組比較,1) P<0.05;與模型組比較,2) P<0.05。
VEGF 0.307±0.043 0.256±0.0351)0.353±0.0421)2)0.324±0.0142)組別假手術組模 型 組續 苓 組雌二醇組n6 6 6 6 CD31 0.383±0.032 0.365±0.049 0.520±0.0751)2)0.529±0.0281)2)HIF-1α 0.290±0.034 0.204±0.0271)0.256±0.0422)0.264±0.0342)
4 討 論
中醫學認為PMOP 屬于“骨痿”“骨枯”范疇,其發病病機是以腎虛為主,并與脾、肝相關[8]。絕經后婦女腎精不足,無以滋養骨骼,最終引發骨痿。卵巢切除后大鼠雌激素水平降低,骨量顯著丟失,較好地模擬了絕經后骨質疏松癥的病理狀況。本研究結果顯示:與模型組比較,續苓組骨小梁面積百分比(Tb.Ar%)、骨小梁寬度(Tb.Wi)增加,骨小梁間距(Tb.Sp)縮小,表明續苓健骨方改善了OVX大鼠骨小梁形態和骨微結構。
成骨細胞介導的骨形成與破骨細胞介導的骨吸收之間的平衡是維持體內骨量的重要因素。雌激素缺乏是絕經后骨質疏松癥重要的發病機制之一[9]。雌激素水平降低會減弱對破骨細胞的抑制作用,破骨細胞的數量增加、凋亡減少、壽命延長,導致骨吸收功能增強,從而使骨形成與骨吸收的耦聯失衡,導致骨質疏松癥。P1NP 是體內成骨細胞的活性和新骨形成的特異性敏感指標,S-CTX 是骨吸收活性特異指標[10]。本研究結果顯示:續苓組大鼠的血清中E2、P1NP 升高,S-CTX 顯著降低,可見續苓健骨方緩解了模型組大鼠雌激素下降的狀態,抑制骨吸收能力,同時增加骨形成能力,從而提高骨密度。
現代研究表明:血瘀的生物學基礎涉及血管內皮細胞損傷、微循環障礙等血管因素的失調[11]。CD31 是血管內皮細胞特征性標志物之一,常用于檢測血管新生。伴隨雌激素水平的下降,絕經后骨質疏松癥骨內血管數量也相應減少[12]。HIF-1α/VEGF 是偶聯骨血管形成及骨形成的重要通路之一[13]。HIF-1α 是具有轉錄活性的重要因子,是受損傷組織中最為重要的成血管誘導因子[14-15]。VEGF是HIF-1α 下游主要的血管相關性靶基因,可通過誘導新血管生成并使其侵入參與骨重建的過程[16-17]。本研究結果顯示:模型組股骨遠端CD31、HIF-1α、VEGF 蛋白表達降低,而續苓健骨方干預后上述指標顯著升高,說明續苓健骨方促進血管生成,改善微循環障礙,這可能與其對HIF-1α/VEGF 信號通路調控有關。
綜上所述,續苓健骨方能上調HIF-1α/VEGF信號通路的表達,促進OVX 大鼠股骨遠端血管生成,增加骨形成;同時升高血清E2,抑制骨吸收,從而改善骨微結構,緩解骨代謝失衡狀態,達到骨保護的目的。

