miR-21對人口腔癌細胞株HSQ-89增殖、侵襲與遷移的影響實驗研究
韋 敏,顧春梅,管燕華,王育新
(南京大學醫學院附屬口腔醫院口腔頜面外科,江蘇 南京 210008)
口腔癌是頭頸部常見的惡性腫瘤之一,是發生于口腔內惡性腫瘤的總稱,包括舌癌、牙齦癌、頰黏膜癌、唇癌及頜骨癌等。我國口腔癌年齡標準化發病率為2.44%,年齡標準化病死率為1.09%,且呈逐年迅速遞增趨勢,5年生存率低下,嚴重危害人類健康[1]。當前常用的抗口腔癌藥物治療效果均不甚理想[2]。因此探索口腔癌增殖和轉移的分子標記對于口腔癌的治療十分必要。轉化生長因子β(Transforming growth factor β,TGF-β)/Smad信號通路在上皮間質轉化(Epithelial-mesenchymal transition,EMT)中發揮重要作用。已有報道指出通過調節TGF-β/Smad信號通路可調控口腔癌細胞的EMT過程,最終調節口腔癌細胞的侵襲和轉移[3],并且有研究發現TGF-β/Smad信號通路在口腔癌細胞的增殖過程中也發揮重要作用[4]。近年來研究發現微小核糖核酸(micro ribonucleic acid,miRNA)與口腔癌的發生發展密切相關。有研究指出miR-21在口腔癌中高表達,可作為口腔癌診斷的潛在分子標記,miR-21表達上調與不良預后密切相關[5],能夠促進口腔癌細胞的侵襲和遷移[6]。也有研究表明miR-21可靶向TGF-β/Smad信號通路中的負反饋調節因子Smad7,調節肺腺癌細胞的增殖[7]。然而miR-21能否通過介導Smad7調控TGF-β/Smad信號通路抑制口腔癌細胞的惡性生物學行為尚不清楚。本研究選取人口腔癌細胞株HSQ-89開展體外細胞實驗,探究miR-21介導Smad7調節TGF-β/Smad信號通路調控人口腔癌細胞株HSQ-89增殖、侵襲、遷移的作用與可能機制。
1 材料與方法
1.1 實驗材料 人口腔癌細胞株HSQ-89(河南省工業微生物菌種工程技術研究中心,BNCC100601);脂質體(Lipofectamine 2000)轉染試劑盒(賽默飛,11668);陰性對照(NC inhibitor,合成序列:5’-CAGUACUUUUGUGUUGUAGUAC-3’)質粒(pGFP-NC inhibitor)、miR-21抑制劑(miR-21 inhibitor,合成序列:5’-UCAACAUCAGUCUGAUAAGCUA-3’)質粒(pGFP-miR-21 inhibitor)、miR-21模擬物(miR-21 mimics,合成序列:正義鏈5’-UAGCUUAUCAGACUGAUGUUGA-3’,反義鏈5’-ACUGAAUCAUGGCAUCUGAUGC-3’)質粒(pGFP-miR-21 mimics)、NC mimics(合成序列:正義鏈5’-UGUAUACGAUCAUUACAUUUAG-3’,反義鏈5’-UCACAGUACUUAUGCUCAGCUU-3’)、野生型和突變型Smad7-3非翻譯區(UTR)報告基因質粒(野生型pMIRGLO-Smad7、突變型pMIRGLO-Smad7)(由百奧邁科生物技術有限公司構建與合成);細胞計數(CCK-8)試劑盒[吉滿生物科技(上海)有限公司,GM-040101];侵襲小室(Transwell)、基質膠(美國康寧,3422、354234);結晶紫染色液(北京索萊寶科技有限公司,G1062);RNA提取試劑盒(賽默飛,CS14010);miR-21、U6、TGF-β1、Smad3、Smad7、細胞周期蛋白(CCND1)、MYC、E-鈣黏蛋白(E-cadherin)、波形蛋白(Vimentin)、基質金屬蛋白酶-2(MMP-2),β-肌動蛋白(β-actin)聚合酶鏈反應(PCR)引物(由上海生工有限公司合成);總蛋白提取試劑盒(艾美捷科技有限公司,AMJ-KT0007);核蛋白提取試劑盒(北京索萊寶科技有限公司,R0050);一抗和酶標記的二抗(北京達科為生物技術有限公司,A2124、ab84177、ab193297、A16396、P24385、ab152146、A20798、ab137321、ab97779、ab119716;ab7090、ab97080、ab97200、AS014、AS063、ab205718、ab97051、ab97023、ab97195、ab7171);雙熒光素酶報告基因檢測試劑盒[威格拉斯生物技術(北京)有限公司,T002];倒置顯微鏡(日本奧林巴斯,CKX41);酶標儀(賽默飛,MK3);PCR儀器(美國ABI,7500);高速冷凍離心機(貝克曼,Avanti JXN-30);電泳儀(南京威美特科學儀器有限公司,AD99-DYY-11)。
1.2 實驗方法
1.2.1 細胞處理:常規培養人口腔癌細胞株HSQ-89,待細胞融合度達80%時進行傳代培養。取對數生長期細胞,嚴格按照Lipofectamine 2000操作說明將pGFP-NC inhibitor、pGFP-miR-21 inhibitor、pGFP-miR-21 mimics轉染至人口腔癌細胞株HSQ-89,設為陰性對照組、下調組與上調組;正常組添加等量無菌蒸餾水,各5個復孔。培養48 h。
1.2.2 細胞增殖能力檢測:培養48 h后,對細胞消化,將細胞懸液(2×104個/ml)接種培養,待細胞基本完全貼壁,每孔加10 μl CCK-8溶液,常規培養6 h后450 nm處測定光密度值。
1.2.3 細胞侵襲能力檢測:培養48 h后,制備細胞懸液(1×106個/ml),向預鋪基質膠的Transwell小室上室加200 μl細胞懸液,下室加400 μl培養基。常規培養24 h,固定,結晶紫染色,15 min后觀察。
1.2.4 細胞遷移能力檢測:培養48 h后,將細胞接種培養,待貼壁后采用無菌槍頭對孔內細胞做劃痕,磷酸鹽緩沖液沖洗細胞。劃痕愈合率為0 h與48 h劃痕寬度差值與0 h劃痕寬度比值,計算百分比。
1.2.5 各組細胞基因表達檢測:培養48 h后,提取各組總RNA,反轉錄,設計引物序列,見表1。擴增流程:94 ℃、60 s,92 ℃、45 s,56 ℃、30 s,72 ℃、30 s,連續進行35個循環。miR-21內參為U6,其余均為β-actin,計算2-ΔΔCt。

表1 引物序列
1.2.6 TGF-β1、Smad3、Smad7、CCND1、MYC、E-cadherin、Vimentin、MMP-2蛋白及p-Smad3水平檢測:培養48 h后,裂解細胞,并抽提總蛋白。4 ℃、12000 r/min(有效離心半徑10 cm)離心5 min,收集上清、定量。電泳分離,轉膜后封閉。按說明書加入一抗、二抗,反應后曝光觀察。其中p-Smad3選取H3為內參基因,其余選取β-actin為內參基因。
1.2.7 雙熒光素酶報告基因檢測驗證miR-21是否靶向Smad7:采用Target Scan 8.0[8]預測兩者結合位點。將野生型和突變型pMIRGLO-Smad7報告基因質粒分別與miR-21 mimics和NC mimics共轉染至人口腔癌細胞株HSQ-89。轉染24 h后,檢測各組細胞相對熒光強度。

2 結 果
2.1 各組細胞增殖能力比較 上調組細胞增殖活性較正常組和陰性對照組上升,下調組細胞增殖活性下降(均P<0.01);與上調組比,下調組細胞增殖活性下降(P<0.01)。見表2。

表2 各組細胞增殖活性比較
2.2 各組細胞侵襲能力比較 上調組細胞侵襲細胞數較正常組和陰性對照組增加(均P<0.01),下調組細胞侵襲細胞數減少(P<0.01);下調組細胞侵襲細胞數則較上調組減少(P<0.01)。見表3。

表3 各組細胞侵襲能力比較(個)
2.3 各組細胞遷移能力比較 上調組細胞劃痕愈合率較正常組和陰性對照組上升(P<0.01),下調組細胞劃痕愈合率下降(P<0.01);與上調組比,下調組細胞劃痕愈合率下降(P<0.01)。見表4。

表4 各組細胞劃痕愈合率(%)
2.4 各組細胞miR-21、TGF-β1、Smad3、Smad7、CCND1、MYC、E-cadherin、Vimentin、MMP-2 mRNA相對表達量比較 上調組細胞miR-21、TGF-β1、Smad3、CCND1、MYC、Vimentin、MMP-2 mRNA表達較正常組和陰性對照組上升、Smad7和E-cadherin表達下降(均P<0.05或P<0.01),下調組細胞miR-21表達、TGF-β1、Smad3、CCND1、MYC、Vimentin、MMP-2 mRNA表達下降(均P<0.01)、Smad7和E-cadherin表達上升(均P<0.05或P<0.01);與上調組比較,下調組細胞miR-21表達、TGF-β1、Smad3、CCND1、MYC、Vimentin、MMP-2 mRNA表達下降(均P<0.01)、Smad7和E-cadherin表達上升(均P<0.01)。見表5。

表5 各組細胞miR-21、TGF-β1、Smad3、Smad7、CCND1、MYC、E-cadherin、Vimentin、MMP-2 mRNA相對表達量比較
2.5 各組TGF-β1、Smad3、Smad7、CCND1、MYC、E-cadherin、Vimentin、MMP-2蛋白及p-Smad3表達水平比較 上調組細胞TGF-β1、Smad3、CCND1、MYC、Vimentin、MMP-2蛋白表達和p-Smad3水平均較正常組和陰性對照組上升、Smad7和E-cadherin表達下降(均P<0.05或P<0.01),下調組細胞TGF-β1、Smad3、CCND1、MYC、Vimentin、MMP-2蛋白表達下降、Smad7和E-cadherin蛋白表達上升(均P<0.05或P<0.01);與上調組比,下調組細胞TGF-β1、Smad3、CCND1、MYC、Vimentin、MMP-2蛋白表達和p-Smad3水平均下降(均P<0.01)、Smad7和E-cadherin蛋白表達上升(P<0.01)。見表6。

表6 各組蛋白表達及磷酸化水平比較
2.6 miR-21靶向Smad7驗證結果 Targetscan 8.0數據庫預測Smad7為miR-21潛在靶基因。miR-21與Smad7的3’UTR區堿基互補配對,見圖1。野生型共轉染miR-21 mimics組相對熒光強度低于共轉染NC mimins組(P<0.01),而突變型兩組比較差異無統計學意義(P>0.05),見圖2。
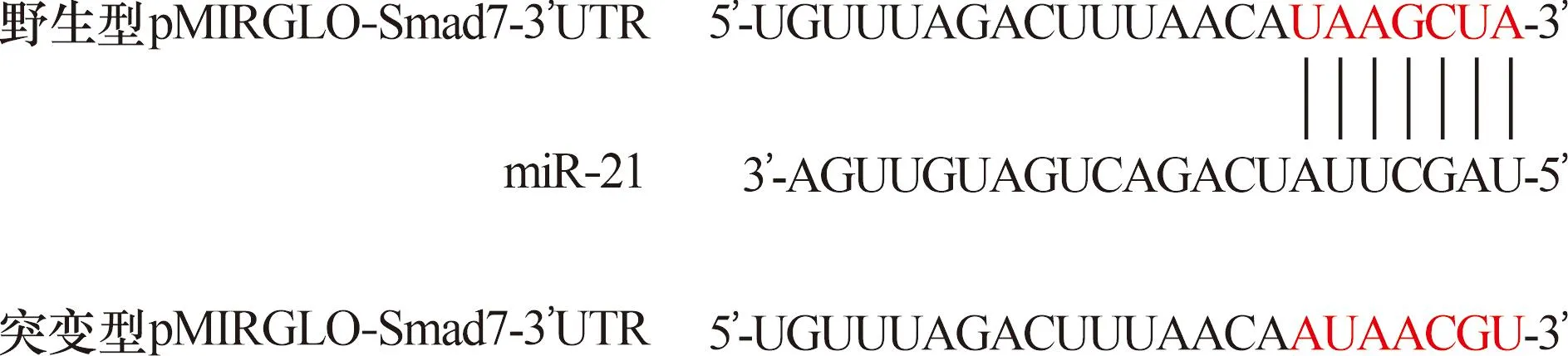
圖1 Smad7為miR-21潛在靶基因
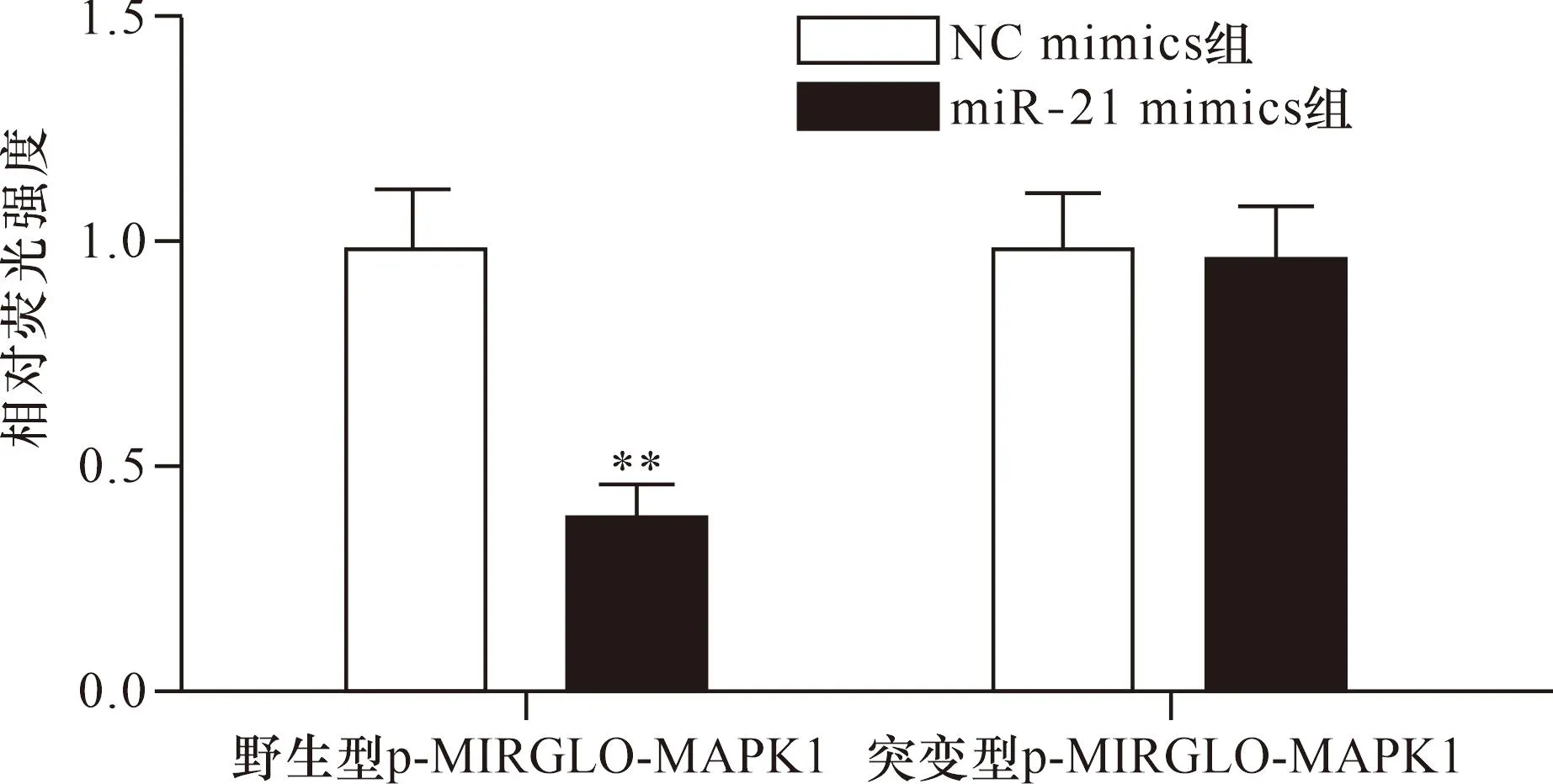
注:與NC mimics組比較,**P<0.01
3 討 論
口腔癌是發生于口腔黏膜組織的惡性腫瘤,發病原因主要包含不良生活方式、環境因素、生物以及遺傳因素等[9-10]。目前臨床上主要選取手術治療及放化療輔助方案,但存在耐藥性及嚴重的不良反應等問題,嚴重限制抗腫瘤藥物在臨床上的使用[11-12]。而口腔癌因癌細胞的轉移進一步危害人類身體健康,故需探討抗口腔癌的新靶點。
本研究結果表明miR-21在口腔癌細胞增殖、侵襲和遷移過程發揮促進作用。EMT在口腔癌細胞的侵襲和轉移過程至關重要,有研究表明miR-21可調控卵巢癌細胞的EMT過程促進卵巢癌進展[13],推測miR-21可能是一種重要的致癌分子。miRNA參與調控細胞的增殖、分化及凋亡過程,作為抑癌基因或致癌基因在腫瘤發生發展過程發揮關鍵作用。miR-21在多數常見惡性腫瘤中過表達,發揮致癌功能,LIN等[14]指出miR-21在膀胱癌細胞中高表達,轉染miR-21后促進膀胱癌細胞的增殖、侵襲和遷移;TSE等[15]通過構建體內腫瘤實驗指出miR-21拮抗劑可改善荷瘤小鼠的腫瘤負擔,抑制miR-21表達可抑制胃癌細胞的EMT過程,發揮促癌作用;CHEN等[16]指出miR-21在口腔癌細胞中高表達,在口腔癌細胞的增殖和侵襲過程中發揮促進作用。本研究與上述結果一致,提示miR-21可能是一種致癌分子,表明可將其作為口腔癌的腫瘤標志物及抗癌靶點。
本研究中上調miR-21表達可抑制Smad7表達,促進TGF-β1、Smad3、CCND1、MYC、Vimentin、MMP-2表達,抑制E-cadherin表達,有致癌成效,miR-21可調控Smad7。在惡性腫瘤晚期,TGF-β/Smad信號通路發揮促進腫瘤EMT從而促進腫瘤轉移[17]。ZHANG等[18]指出抑制TGF-β/Smad信號通路,抑制TGF-β1和Smad3的表達,可抑制與EMT過程相關的Vimentin表達,促進E-cadherin表達,抑制MMP-2表達,從而抑制前列腺癌細胞的增殖、侵襲、遷移;劉紅艷等[19]指出抑制TGF-β/Smad信號通路及CCND1和MYC的表達,可調節結腸癌細胞的增殖。本研究與上述結果一致,這說明可通過調控TGF-β/Smad信號通路影響其下游分子表達,從而發揮抗口腔癌的作用。另外Smad7作為TGF-β/Smad信號通路的負反饋調節因子也可發揮促癌作用,與EMT有關[20]。THAKUR 等[21]指出沉默Smad7后可增強TGF-β/Smad信號通路所誘導的前列腺癌細胞的侵襲和遷移能力;顧海波等[22]指出促進Smad7表達可抑制TGF-β/Smad信號通路,抑制EMT發揮抗癌效應。TANG等[23]指出miR-21靶向Smad7促進肺癌細胞增殖、侵襲和遷移;HE等[24]指出通過調控miR-21對Smad7的靶向作用可調節膠質瘤細胞的增殖、侵襲和遷移。也有研究[25]證實,下調Vimentin表達、上調E-cadherin表達具有抗癌作用,提示這是控制癌細胞遷移、侵襲能力的重要途徑。本研究結果與上述研究結果均一致,推測miR-21可能通過調節Smad7,調控TGF-β/Smad信號通路,參與口腔癌發生及其細胞的惡性生物學行為。
綜上所述,miR-21可促進口腔癌細胞增殖、侵襲和遷移,可能通過調節Smad7,激活TGF-β/Smad信號通路,參與口腔癌發生,而抑制miR-21表達則能控制口腔癌細胞增殖、侵襲和遷移活性。然而本研究仍存在不足:miR-21是否受其他分子調控進而參與口腔癌的發生和發展尚不明確;miR-21是否可通過其他分子途徑參與口腔癌并不清楚;下調miR-21表達抗口腔癌在臨床中應用的可行性還屬未知;miR-21與口腔癌病理特征及預后的關系還需進一步探討。后續應重點研究上述問題,方能實施新的靶向治療方法以減輕口腔癌患者的痛苦、改善其預后。

