小檗堿調節HIF-1α/VEGF信號通路對皮膚潰瘍大鼠血管生成和創面愈合的影響
齊淑靜,付改霞,齊瑞霞
(河北工程大學附屬醫院,河北 邯鄲056001)
皮膚潰瘍是一種常見的外科多發病,具有病程遷延、易感染、易復發等特點,還存在致癌風險,炎癥、血管生成等在皮膚潰瘍創面愈合中發揮關鍵作用[1-2]。包括皮膚在內的各種組織潰瘍創面愈合是一個多因素參與的復雜過程,炎癥、血管生成與膠原合成等在其中發揮關鍵作用,抗炎處理及促血管生成是促進皮膚潰瘍大鼠創面愈合的有效策略[3-4]。缺氧誘導因子-1α (HIF-1α)/血管內皮生長因子(VEGF)信號可通過調控炎癥、血管生成、成纖維細胞增殖、再上皮化等介導皮膚創面愈合過程[5]。增強HIF-1α表達可增強皮膚創面血管化,促進糖尿病足潰瘍傷口愈合[6],還可升高VEGF表達,抑制炎癥、促使血管生成,進而加快慢性皮膚潰瘍創面愈合[7]。因此,上調HIF-1α/VEGF通路是促使皮膚潰瘍創面愈合的有效手段。小檗堿(Berberine,BR)是許多中藥含有的活性物質,具有消除氧自由基及炎癥抑制作用,可通過減輕炎癥、誘導血管形成等來加速糖尿病患者傷口愈合[8];能通過抗菌功效減輕皮膚傷口感染,并促使其創面愈合[9];且BR可通過激活HIF-1α信號保護腎小管上皮細胞免受缺氧和高糖誘導的凋亡[10]。因此,推測BR可能通過激活HIF-1α/VEGF信號通路來促進皮膚潰瘍血管生成和創面愈合。本文制備皮膚潰瘍模型大鼠,探究BR調節HIF-1α/VEGF信號通路對其血管生成和創面愈合的影響。
1 材料與方法
1.1 實驗動物 SD雄性大鼠,SPF級,6~7周齡,體重230~260 g,購自廣東萊迪生物醫藥研究院有限公司[生產許可證號SCXK(粵)2022-0064],將所有大鼠飼養在維持屏障環境的動物房內,飼養條件分別設定為:相對濕度55%~65%、溫度23~25 ℃,并以明暗各12 h交替循環維持照明。
1.2 主要材料及試劑 100%冰醋酸購自西格瑪奧德里奇(上海)貿易有限公司;HIF-1α siRNA質粒及其對應空載質粒購自江蘇譜新生物醫藥有限公司;水包油型乳膏基質購自廣州市歐妍化妝品有限公司;HE染色試劑盒、BR(批號110713-201212)購自中國食品藥品檢定研究院;大鼠IL-8及IL-6酶聯免疫吸附測定(ELISA)試劑盒、兔SP免疫組化檢測試劑盒購自北京索萊寶科技有限公司;偶聯HRP的小鼠抗兔二抗、兔源抗大鼠anti-Collagen Ⅰ、anti-HIF-1α及anti-fibronectin抗體、兔源抗大鼠anti-GAPDH、anti-VEGF及anti-CD31抗體購買于英國Abcam公司等。
1.3 主要實驗儀器 SP-Max2300A2自動酶標分析儀,購買自上海酶聯生物科技有限公司;ARM-2216石蠟切片機,購買自湖北安立信醫療實業有限公司;NIB400倒置生物光學顯微鏡,購買自深圳市眾尋光學儀器有限公司;SE400垂直蛋白電泳儀、TE62蛋白轉印儀,購買自美國Amersham公司等。
1.4 研究方法
1.4.1 皮膚潰瘍大鼠模型構建、分組及處理:參照文獻[11]構建皮膚潰瘍大鼠模型,取SD大鼠肌肉注射青霉素鉀溶液,每只4000 U,1次/d,連續4 d后開始造模,以10%戊巴比妥鈉溶液腹腔注射(3 ml/kg)麻醉,以8%硫化鈉脫去大鼠背部毛發后于其背部制備一個1.5 cm×2 cm的缺損性皮膚創面,接著涂抹50%冰醋酸溶液,1次/d,連續7 d后即可形成皮膚潰瘍模型,隨機分為模型組(M組)、小檗堿低劑量組(BR-L組)、小檗堿高劑量組(BR-H組)、小檗堿高劑量+空載組(BR-H+pc-DNA組)、小檗堿高劑量+HIF-1α敲低組(BR-H+pc-HIF-1α KD組),每組10只,另選10只大鼠只進行脫毛操作作為對照組(C組)。制備BR乳膏:將乳膏基質加熱至70 ℃左右時,取適量BR(批號110713-201212)藥物粉末少量多次加入,緩慢攪拌混勻,靜置至室溫得到每100 g乳膏中含有60、120 mg BR的乳膏藥物,BR-L組、BR-H組大鼠在其創面及附近皮膚組織處分別涂抹22、44 mg/cm2的BR乳膏(涂抹面積為5 cm2,1次/d)[12],同時分別在其創面創緣周圍三點注射0.9%氯化鈉溶液(劑量與BR-H+pc-HIF-1α KD組相同,2次/周);BR-H+pc-DNA組、BR-H+pc-HIF-1α KD組大鼠以同樣方法涂抹44 mg/cm2的BR乳膏,同時分別在其創面創緣周圍三點注射空載質粒、HIF-1α siRNA質粒(劑量按其說明書設定為50 μg/cm2,2次/周);C組(脫毛處對應的皮膚)和M組大鼠以同樣方法分別涂抹與BR-H組相同量的乳膏基質,同時分別于其創面創緣周圍三點注射0.9%氯化鈉溶液(劑量與BR-H+pc-HIF-1α KD組相同,2次/周),每組大鼠均處理3周。
1.4.2 各組大鼠皮膚潰瘍創面愈合率測定及標本采集:各組大鼠于3周處理結束后24 h麻醉,采集尾靜脈血離心收集血清在-80 ℃保存;攝取各組大鼠創面圖像后以Image J軟件定量其創面面積,計算各組皮膚潰瘍創面愈合率(皮膚潰瘍創面愈合率=藥物處理后皮膚潰瘍創面面積/造模成功時皮膚潰瘍創面面積×100%);頸椎脫臼處死各組大鼠,剝離皮膚潰瘍處的創面組織,取約0.6 g保存在液氮中;剩余創面組織浸沒在10%甲醛中固定,然后進行常規梯度脫水、透明處理,浸沒在熱石蠟中包埋,采用石蠟切片機做病理切片備用(C組大鼠取背部脫毛處皮膚組織)。
1.4.3 HE染色檢測各組大鼠皮膚潰瘍創面組織病理形態:取1.4.2中的各組大鼠皮膚潰瘍創面組織切片,每只大鼠取3張經脫蠟、分級水化后以HE染色液孵育,參照HE染色試劑盒說明書中步驟行HE染色,洗片、脫水后封片觀察,于光學顯微鏡中攝取各組皮膚潰瘍創面組織病理形態圖像。
1.4.4 免疫組織化學染色檢測各組大鼠皮膚潰瘍創面組織微血管密度(MVD):CD31陽性表達的血管內皮細胞可以標記微血管,取1.4.2中的各組大鼠皮膚潰瘍創面組織切片經脫蠟、分級水化,以3%雙氧水、孵育稀釋200倍的CD31一抗(英國Abcam公司)溶液、洗片后參照兔SP免疫組化檢測試劑盒說明書中步驟做免疫組織化學染色,漂洗后再次脫水、透明,進行封片后于光學顯微鏡中觀察并拍攝各組創面組織圖像,用Image J軟件分析定量視野中切片面積及微血管數目,將單個CD31陽性血管內皮細胞或聚集呈細胞簇的CD31陽性血管內皮細胞設定為一個血管,采用以下公式算出MVD[MVD(個/mm2)=微血管數目/視野中切片面積]。
1.4.5 ELISA檢測各組大鼠血清及皮膚潰瘍創面組織炎性因子白細胞介素(IL)-6、IL-8表達水平:取出1.4.2保存在液氮中的皮膚潰瘍創面組織,提取總蛋白后測其濃度,取1.4.2中血清4 ℃下解凍,每組取0.2 ml組織樣品液及0.2 ml血清,采用ELISA試劑盒并按其說明書中方法分別測定其中IL-6、IL-8表達水平。
1.4.6 免疫印跡法檢測各組大鼠皮膚潰瘍創面組織HIF-1α/VEGF通路蛋白表達:取1.4.5中剩余的各組大鼠皮膚潰瘍創面組織樣品液,沸水浴加熱變性其中蛋白后每組各取15 μg,120 V恒壓下電泳分離后電轉,所得膜浸入5%脫脂奶粉溶液封閉后剪下蛋白HIF-1α、VEGF、GAPDH的各組條帶,采用相對應均稀釋1000倍的一抗、稀釋2000倍的二抗(英國Abcam公司)對上述各組蛋白做抗原抗體反應,然后通過化學發光法顯色后攝取各組蛋白圖像,最后用Image J軟件定量其灰度值后量化其相對表達。
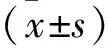
2 結 果
2.1 BR對各組大鼠創面愈合率的影響 與M組相比,BR-L組、BR-H組、BR-H+pc-DNA組大鼠創面愈合率均升高(均P<0.05),BR-H組、BR-H+pc-DNA組大鼠創面愈合率相比BR-L組進一步升高(均P<0.05);與BR-H組相比,BR-H+pc-HIF-1α KD組大鼠創面愈合率降低(P<0.05),BR-H+pc-DNA組大鼠創面愈合率無明顯變化(P>0.05)。見表1。

表1 各組大鼠創面愈合率比較(%)
2.2 BR對各組大鼠創面組織病理形態的影響 C組大鼠皮膚組織形態正常,肌纖維結構完好且排列整齊,血管形態正常;M組大鼠創面組織肌纖維斷裂、排列雜亂,有明顯炎性細胞浸潤,并可見少量膠原纖維與毛細血管形成;與M組相比,BR-L組、BR-H組、BR-H+pc-DNA組大鼠創面組織肌纖維恢復較好,炎性細胞浸潤減輕,同時膠原纖維與毛細血管形成增多;與BR-H組相比,BR-H+pc-HIF-1α KD組大鼠創面組織肌纖維損傷及炎性細胞浸潤加重,同時膠原纖維與毛細血管形成減少;BR-H+pc-DNA組大鼠創面組織病理形態與BR-H組基本相似。見圖1。
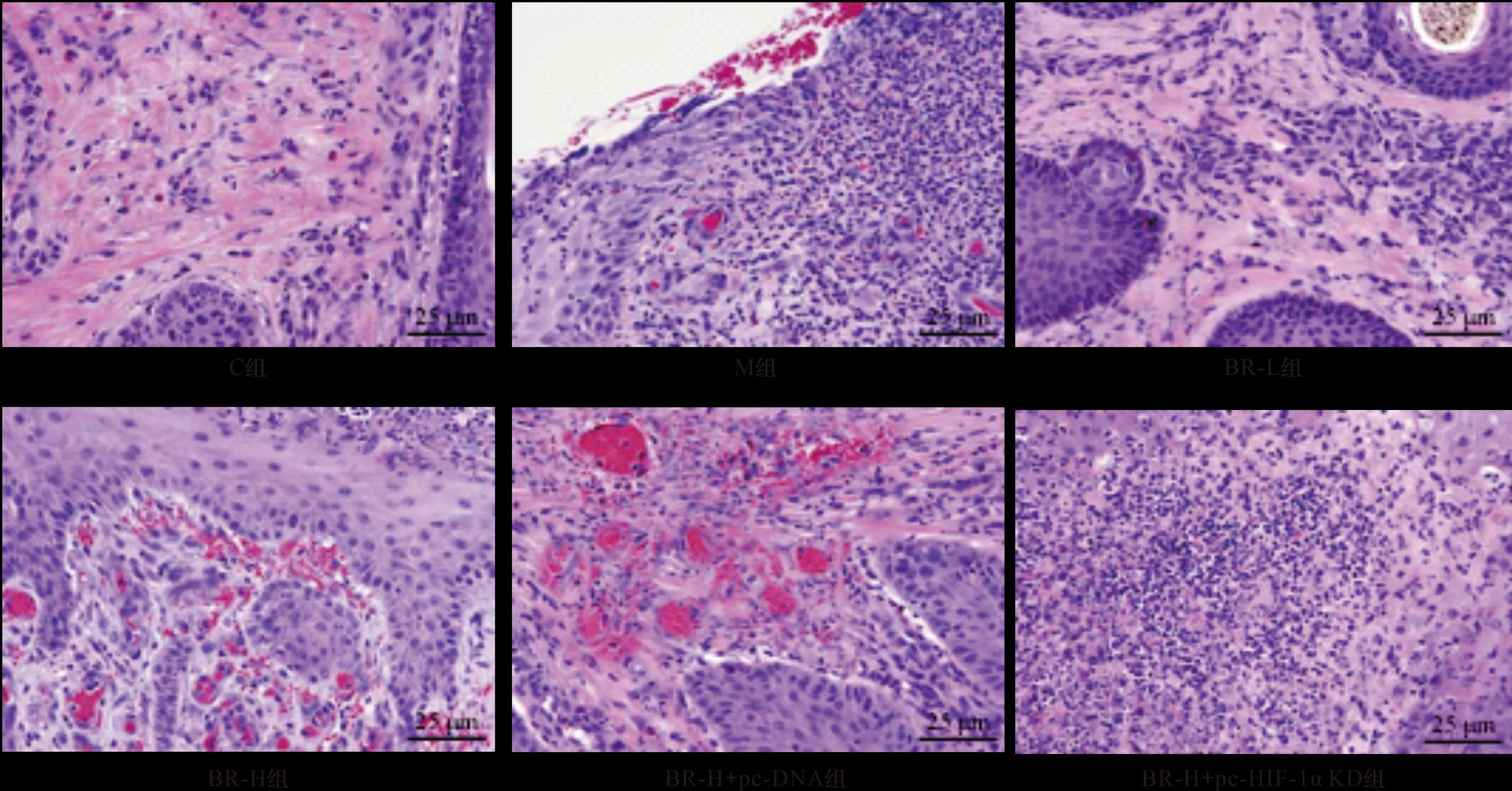
圖1 HE染色檢測各組大鼠創面組織病理形態(×200)
2.3 BR對各組大鼠創面組織MVD的影響 與C組相比,M組大鼠創面組織MVD升高(P<0.05);與M組相比,BR-L組、BR-H組、BR-H+pc-DNA組大鼠創面組織MVD均升高(均P<0.05),BR-H組、BR-H+pc-DNA組大鼠創面組織MVD相比BR-L組進一步升高(均P<0.05);與BR-H組相比,BR-H+pc-HIF-1α KD組大鼠創面組織MVD降低(P<0.05),BR-H+pc-DNA組大鼠創面組織MVD無明顯變化(P>0.05)。見圖2(表2)。
圖2 免疫組織化學染色檢測各組大鼠創面組織MVD(×200)

表2 各組大鼠創面組織MVD比較(個/mm2)
2.4 BR對各組大鼠血清及創面組織炎性因子水平的影響 與C組相比,M組大鼠血清及創面組織IL-6、IL-8水平升高(均P<0.05);與M組相比,BR-L組、BR-H組、BR-H+pc-DNA組大鼠血清及創面組織IL-6、IL-8水平均降低(均P<0.05),BR-H組、BR-H+pc-DNA組大鼠血清及創面組織IL-6、IL-8水平相比BR-L組進一步降低(均P<0.05);與BR-H組相比,BR-H+pc-HIF-1α KD組大鼠血清及創面組織IL-6、IL-8水平升高(均P<0.05),BR-H+pc-DNA組大鼠血清及創面組織IL-6、IL-8水平無明顯變化(均P>0.05)。見表3。

表3 各組大鼠血清及創面組織炎性因子IL-6、IL-8表達水平比較
2.5 BR對各組大鼠創面組織HIF-1α/VEGF通路蛋白表達的影響 與C組相比,M組大鼠創面組織HIF-1α和VEGF蛋白表達稍有升高但差異無統計學意義(均P>0.05);與M組相比,BR-L組、BR-H組、BR-H+pc-DNA組大鼠創面組織HIF-1α和VEGF蛋白表達均升高(均P<0.05),BR-H組、BR-H+pc-DNA組大鼠創面組織HIF-1α和VEGF蛋白表達相比BR-L組進一步升高(均P<0.05);與BR-H組相比,BR-H+pc-HIF-1α KD組大鼠創面組織HIF-1α和VEGF蛋白表達降低(均P<0.05),BR-H+pc-DNA組大鼠創面組織HIF-1α和VEGF蛋白表達無明顯變化(均P>0.05)。見表4。

表4 各組大鼠創面組織HIF-1α、VEGF蛋白表達水平比較
3 討 論
皮膚潰瘍長期不能愈合不僅給患者帶來極大痛苦和負擔,還會隨病情反復而增加致癌風險,其臨床治療比較棘手,多以藥物外用為主,但目前尚未有療效特別突出的藥物,目前亟須探尋開發更多、更有效安全的治療藥物[13-15]。本文采用制備創面后涂抹冰醋酸的方法建立皮膚潰瘍模型,結果顯示,模型大鼠皮膚潰瘍創面組織肌纖維斷裂、排列雜亂,有明顯炎性細胞浸潤,并可見少量膠原纖維與毛細血管形成,血清及皮膚潰瘍創面組織炎性因子IL-6、IL-8水平升高,表明造模大鼠創面組織處于炎癥狀態,造模3周后還未愈合,提示模型構建成功。
BR是具有抗炎、抗感染等作用的一種季銨生物堿,廣泛存在于中藥材中,可用于治療各種因素引發的潰瘍,加速其創面愈合,BR可通過減輕氧化應激而抑制高糖誘導的人類永生化表皮細胞損傷凋亡,還可抑制炎癥及促進血管形成、膠原沉積,從而加速糖尿病潰瘍創面愈合[8-9,16],因此推測BR可以用于治療皮膚潰瘍。本文結果顯示,相比M組,低劑量及高劑量BR組大鼠皮膚潰瘍創面組織肌纖維恢復較好,炎性細胞浸潤減輕,同時膠原纖維與毛細血管形成增多,皮膚潰瘍創面愈合率、創面組織MVD升高,血清及皮膚潰瘍創面組織IL-6、IL-8水平均降低,且高劑量BR作用更強,與文獻[6-7,11]的研究結果相似。本文結果表明BR可降低炎性因子生成水平,進而阻止炎性因子誘發的炎性反應發生及進展,促進血管形成及膠原合成,加快皮膚潰瘍創面愈合,劑量越高,功效越強,進一步證實了BR對各自原因引發的皮膚潰瘍的治療功效。
皮膚潰瘍創面難以愈合與延長的炎癥期、血管形成受阻有關,限制持續的炎癥、減輕細菌感染、刺激肉芽組織血管生成和膠原沉積可有效促進創面愈合[17-18]。HIF-1α和VEGF是重要的血管形成因子,其表達受限可導致缺氧后新生血管受損,是造成糖尿病患者傷口愈合延遲的一個主要原因,增強其表達可起到抗氧化、抗炎和促進血管生成作用,并加快糖尿病損傷動物傷口創面愈合[19-20]。激活HIF-1α/VEGF信號還可通過增強血管及膠原生成、抑制炎癥而促進慢性皮膚潰瘍創面愈合[21-22]。本文結果顯示,與M組大鼠相比C組大鼠皮膚潰瘍創面組織HIF-1α、VEGF蛋白表達稍有升高,而以BR處理大鼠,可進一步升高皮膚潰瘍創面組織HIF-1α、VEGF蛋白表達,表明HIF-1α/VEGF信號參與介導了皮膚潰瘍大鼠血管生成和創面愈合過程,與文獻[23-25]的研究結果相似;另外相比以前的研究,本文證實了HIF-1α/VEGF信號參與介導BR對皮膚潰瘍大鼠血管生成和創面愈合的促進作用。本文結果顯示以BR和HIF-1α siRNA聯合處理皮膚潰瘍模型大鼠,可減弱BR單獨處理對炎性因子表達的降低作用,進而削弱BR的抗炎功效,拮抗其對血管形成及膠原合成的增強作用,最終逆轉其對皮膚潰瘍大鼠創面愈合的促進作用,提示BR促進皮膚潰瘍大鼠血管生成和創面愈合是通過上調HIF-1α實現的。
綜上所述,BR可上調HIF-1α及VEGF表達,從而降低炎性因子表達水平,增強皮膚潰瘍大鼠血管生成與膠原合成,最終加快創面愈合,促使HIF-1α/VEGF信號途徑傳導可能是其藥理機制之一。本文為BR治療皮膚潰瘍提供了新的理論依據,有利于其在皮膚潰瘍臨床治療中的進一步開發應用。另外本文證實了BR可用于加快皮膚潰瘍大鼠傷口愈合并對其藥理機制進行了初步探討,但關于BR調控HIF-1α/VEGF信號中VEGF分子及其下游信號分子的機制還未有涉及,存在一定不足,還需后續深入研究。

