酮咯酸氨丁三醇口崩片處方優化及體外溶出度研究
曾 媛,張 瑩,2,徐亞君,劉 輝△,張國偉
(1.中國人民解放軍中部戰區總醫院,湖北 武漢 430070;2.湖北省麻城市人民醫院,湖北 黃岡 438300)
酮咯酸氨丁三醇為非選擇性環氧合酶抑制劑,通過抑制環氧合酶和前列腺素合成活性,以發揮中度抗炎、強效鎮痛作用[1],普遍用于緩解急性腎絞痛、創傷痛、癌癥中晚期疼痛、牙痛、三叉神經痛等較劇烈的疼痛癥狀,也可單用或復合嗎啡、羅哌卡因等其他鎮痛藥物應用于臨床的術后鎮痛[2-8]。口崩片崩解速度快,達峰時間早,有助于藥物溶出、吸收,快速緩解病癥帶來的不適感[9-10]。將酮咯酸氨丁三醇制備成口崩片,不需含水在口腔中,直接將其含在嘴里,藥物便能崩解完全,可提高疼痛患者的用藥依從性[11-12]。本研究中使用模糊綜合評價法聯合L9(34)正交試驗優化酮咯酸氨丁三醇口崩片處方[13-14],并進行溶出度考察。現報道如下。
1 儀器與試藥
1.1 儀器
PP-120 型單沖壓片機(湖南省衡陽市藥械設備廠);BT25S型超微量電子分析天平(北京賽多利斯儀器有限公司,精度為千分之一);RCZ-8 型藥物溶出度儀(上海黃海藥檢儀器有限公司);ZB-1E 型智能崩解儀(天津市天大天發科技有限公司);YDP-200C 型片劑硬度測定儀(上海黃海藥檢儀器有限公司);LC-20AT型高效液相色譜儀(日本Shimadzu 公司),配有SPD-M20A型檢測器。
1.2 試藥
酮咯酸氨丁三醇對照品(中國食品藥品檢定研究院,批號為101532-202001,含量為99.8%);酮咯酸氨丁三醇(海南卓科制藥有限公司,批號為Y-20200902);酮咯酸氨丁三醇口崩片(自制制劑,批號分別為20211208,20211209,20211210,20211213,20211214,20211215);阿司帕坦(湖南九典制藥有限公司,批號為TF23190601);藍莓粉末香精(金富高生物技術有限公司,批號為20191226);甘露醇(ROQUETTE Inc.,批號為E699G);微晶纖維素UF-711(MCC,批號為7981),交聯羧甲基纖維素鈉ND-2HS(CCMC-Na,批號為X81373),均購自AsahiKASEI Inc.;硬脂酸鎂(安徽山河藥用輔料有限公司,批號為180346);甲醇(批號為20191031),冰醋酸(批號為20190121),均購自國藥集團化學試劑有限公司;水為雙蒸餾水。
2 方法與結果
2.1 L9(34)正交試驗優選提取工藝
2.1.1 因素與水平
根據單因素試驗結果,選取MCC 用量(因素A)、甘露醇用量(因素B)、CCMC-Na 用量(因素C)、硬脂酸鎂用量(因素D)4 個因素,每個因素選擇3 個水平進行L9(34)正交設計試驗[15-16],以主觀指標(口感、外觀)和客觀指標(硬度、崩解)作為考察因素,進行模糊綜合評分[17]。因素與水平見表1。

表1 L9(34)正交試驗因素與水平(mg)Tab.1 Factors and levels of the L9(34)orthogonal test(mg)
2.1.2 權重確定
選6名專業人員,同時對口崩片的主觀指標(口感、外觀)和客觀指標(硬度、崩解)進行評價。采用強制決定法確定口崩片各評價因素的權重,結果外觀、口感、硬度、崩解的權重分別為0.167,0.278,0.222,0.333。
2.1.3 評價結果
分別對9 組處方樣品的考察指標進行評價,以優(5 分)、較優(4 分)、適中(3 分)、較差(2 分)、差(1 分)為評價等級進行評分。各考察因素評分標準見表2。

表2 酮咯酸氨丁三醇口崩片評分標準Tab.2 Scoring criteria for Ketorolac Tromethamine Orally Disintegrating Tablets
2.1.4 評價數據處理
根據模糊綜合評分法建立原則:因素集U={外觀(u1),口感(u2),硬度(u3),崩解時間(u4)};評價集V={優(5 分),較優(4 分),適中(3 分),較差(2 分),差(1 分)};S 為U 到V 的模糊映射;權重向量A={外觀(u1),口感(u2),硬度(u3),崩解時間(u4)};R 為綜合評價結果集,計算公式為R=A×S。首先,根據外觀(u1)、口感(u2)評價結果建立模糊關系矩陣,得出R 值,分別與評價集中各對應分值相乘,然后分別將硬度(u3),崩解時間(u4)評價結果得出的R 與評價集中對應分值相乘。現以樣品1 建立的模糊關系矩陣S1為例進行數據處理。
將上述計算結果分別與評價集中各對應分值相乘,然后將硬度(u3)、崩解時間(u4)評價結果得出的R與評價集中對應分值相乘,計算總評分(YF)。樣品1 的總評分YF1=0×5+0.056×4+0.389×3+0×2+0×1+0.222×5+0.333×2=3.167。9組樣品的模糊綜合評分見表3。

表3 L9(34)正交試驗設計與結果Tab.3 Design and results of the L9(34)orthogonal test
2.1.5 方差分析結果
由表3和表4可知,因素影響順序為MCC>CCMC-Na>甘露醇>硬脂酸鎂,且MCC、CCMC-Na、甘露醇用量均對口崩片質量有顯著影響。最優水平為A2B2C2D1,即MCC 150 mg,甘露醇90 mg,CCMC-Na 10 mg,硬脂酸鎂1.5 mg。

表4 方差分析結果Tab.4 Results of the analysis of variance
2.1.6 驗證試驗
按最優處方,采用直接壓片法制備3 批樣品,以口感、外觀、硬度、崩解為考察指標進行工藝驗證。結果見表5,表明優化的酮咯酸氨丁三醇口崩片制備工藝重復性良好。

表5 最優處方工藝驗證試驗結果(n=6)Tab.5 Results of the validation test of optimal prescription process(n=6)
2.2 溶出度測定
2.2.1 色譜條件
色譜柱:Diamonsil C18柱(250 mm×4.6 mm,5μm);流動相:甲醇-水-冰醋酸(65∶34∶1,V/V/V);流速:0.9 mL/ min;檢測波長:322 nm;柱溫:40 ℃;進樣量:20μL。
2.2.2 溶液制備
取酮咯酸氨丁三醇對照品25 mg,精密稱定,置50 mL容量瓶中,加水溶解并定容,即得對照品貯備液;精密量取2 mL,置50 mL 容量瓶中,加水稀釋并定容,搖勻,即得質量濃度為20μg/mL的對照品溶液。
取自制酮咯酸氨丁三醇口崩片,參照《美國藥典(43版)》(USP43)中酮咯酸氨丁三醇片溶出度的測定方法[18],溶出介質為600 mL 水,轉速為50 r/min,依法操作,待溶出規定的時間后,取溶出溶液4 mL,0.45μm濾膜濾過,取續濾液,即得供試品溶液。
按制劑處方比例制備不含酮咯酸氨丁三醇的空白片,照供試品溶液制備方法進行溶出度試驗,待溶出規定的時間后,取溶出溶液4 mL,0.45μm濾膜濾過,取續濾液,作為陰性對照品溶液。
2.2.3 方法學考察
系統適用性試驗:取對照品溶液、供試品溶液、陰性對照品溶液各20μL,按2.2.1 項下色譜條件進樣測定,記錄色譜圖。結果溶劑峰不干擾酮咯酸氨丁三醇主成分峰,酮咯酸氨丁三醇口崩片的空白輔料對其樣品峰無影響,供試品溶液、對照品溶液的色譜峰一致,表明方法專屬性良好。色譜圖見圖1。

1.酮咯酸氨丁三醇A.對照品溶液 B.供試品溶液 C.陰性對照品溶液圖1 高效液相色譜圖1.Ketorolac tromethamineA.Reference solution B.Test solution C.Negative reference solutionFig.1 HPLC chromatograms
線性關系考察:取2.2.2項下酮咯酸氨丁三醇對照品貯備液,稀釋成質量濃度分別為1,25,50,75,100μg/mL的梯度溶液,按2.2.1 項下色譜條件進樣測定峰面積,以對照品質量濃度(C,μg/mL)為橫坐標、峰面積(A)為縱坐標進行線性回歸,得回歸方程A=60 276C-222.25(r=0.999 9,n=5),表明酮咯酸氨丁三醇質量濃度在1~100μg/mL范圍內與峰面積線性關系良好。
精密度試驗:取2.2.2項下酮咯酸氨丁三醇對照品溶液適量,按2.2.1 項下色譜條件連續進樣測定6 次,記錄峰面積。結果酮咯酸氨丁三醇峰面積的RSD為0.11%(n=6),表明儀器精密度良好。
穩定性試驗:取2.2.2項下對照品溶液和供試品溶液各適量,分別于室溫下放置0,4,8,12,24 h 時按2.2.1 項下色譜條件進樣測定,記錄峰面積。結果對照品溶液和供試品溶液峰面積的RSD分別為0.37%和0.09%(n=5),表明對照品溶液和供試品溶液在24 h內穩定性良好。
重復性試驗:取樣品(批號為20211208)適量,按2.2.2 項下方法制備供試品溶液6 份,按2.2.1 項下色譜條件進樣測定,記錄峰面積,并計算含量。結果含量的RSD為0.89%(n=6),表明方法重復性良好。
回收試驗:取酮咯酸氨丁三醇對照品3份,置100 mL容量瓶中,分別加入處方量輔料,用水溶解并定容,振蕩,充分溶解,精密量取溶解完全后的各濃度藥物2 mL,置10 mL 容量瓶中,加水定容,搖勻,取20 μL 進樣測定;另取2.2.2項下對照品溶液,同法測定。按外標法分別計算含量。結果平均回收率為98.76%,RSD為0.75%(n=9),表明方法準確性良好。
2.2.4 溶出度測定
分別吸取2.2.2 項下供試品溶液和對照品溶液各適量,按2.2.1項下色譜條件進樣測定,記錄峰面積,以外標法計算每片的溶出量。結果溶出量應符合規定,限度為標示量的75%。
2.2.5 溶出度影響因素考察
溶出度測定方法:參考USP43 版和2020 年版《中國藥典》中酮咯酸氨丁三醇片溶出度的測定方法,以水為溶出介質,介質體積600 mL,轉速50 r/min,分別采用槳法和籃法進行溶出度試驗,分別于5,10,20,30,45,60,90 min 時取樣,按2.2.1 項下色譜條件進樣測定。由圖2 A 可知,溶出方法對藥物溶出度影響不大。故選擇槳法作為溶出度測定方法。

A.溶出度測定方法 B.溶出介質 C.轉速圖2 不同溶出條件下的溶出度A.Dissolution determination method B.Dissolution medium C.Rotation speedFig.2 Dissolution rates under different dissolution conditions
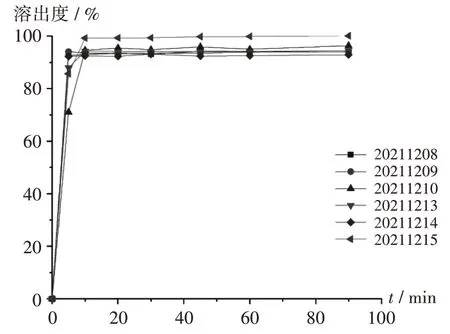
圖3 6批自制口崩片的溶出曲線Fig.3 Dissolution curves of six batches of self-made orally disintegrating tablets
溶出介質:保持其他體外溶出條件不變,以pH 1.2、pH 3.0、pH 6.8、純化水分別為溶出介質進行溶出度測定試驗,分別于5,10,20,30,45,60,90 min 時取樣,按2.2.1項下色譜條件進樣測定。由圖2 B 可知,酮咯酸氨丁三醇口崩片在pH 1.2 溶出介質中溶出度低于75%,pH 3.0、pH 6.8 溶出介質中溶出度低于純化水中的溶出度。參考USP43 酮咯酸氨丁三醇片溶出介質的選擇。故選擇純化水作為溶出介質。
轉速:保持其他體外溶出條件不變,轉速分別采用50,75,100 r/min,分別于5,10,20,30,45,60,90 min時取樣,按2.2.1 項下色譜條件進樣測定。由圖2 C 可知,各轉速間溶出度無顯著差異。藥物在人體消化道的溶出速度與胃腸道蠕動強度有關。故選擇與中老年人體胃腸蠕動強度等同的50 r/min作為轉速。
2.2.6 溶出曲線建立
取樣品(批號分別為20211208,20211209,20211210,20211213,20211214,20211215)以水為溶出介質,轉速50 r/min,采用槳法,介質體積600 mL,分別于5,10,20,30,45,60,90 min 時取樣,按2.2.2 項下方法制備供試品溶液,按2.2.1 項下色譜條件進樣測定,溶出度測定結果見表6。
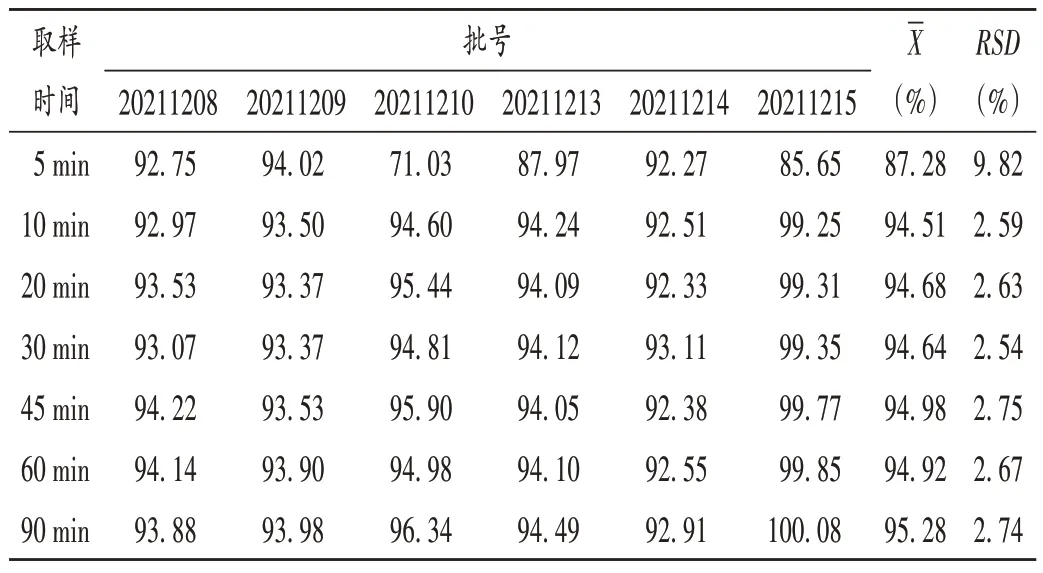
表6 溶出度測定結果(%)Tab.6 Results of the dissolution determination(%)
3 討論
由表3 和表4 可知,酮咯酸氨丁三醇口崩片最佳處方為MCC 150 mg、甘露醇90 mg、CCMC-Na 10 mg、硬脂酸鎂1.5 mg。由圖2 可知,溶出度測定條件確定為槳法,以純化水600 mL為溶出介質,轉速為50 r/min。
口崩片質量要求嚴格,包括外觀整潔、口感良好、片面光潔、崩解完全等。崩解時間和口感是制備口崩片的關鍵問題,口崩片遇水后,水分通過顆粒間及顆粒內部空隙進入片芯內部,吸水后崩解完全。本研究中以MCC UF-711 和甘露醇為填充劑,制成的口崩片不僅保持了MCC UF-711 高流動性,又具有高成形性的特點,而且還具有甘露醇口感甘甜的特點,克服了單用MCC 時的砂礫帶澀味的口感缺點。MCC 同時兼具填充劑和崩解劑的作用,本研究中選擇MCC 用量為150 mg,避免MCC 用量過大,導致砂礫感澀味較強、口感較差等問題[19]。隨著片劑硬度的增加,顆粒間及顆粒內部空隙被壓縮,整體孔隙率降低,吸水速率減慢,崩解時間延長,口崩片崩解速度受自身硬度的影響,又由于制劑包裝、運輸過程中片芯的完整性也受硬度的影響。因此,在生產時對口崩片硬度和崩解時間進行評價。USP43收錄的酮咯酸氨丁三醇片的溶出度取樣時限為45 min,溶出度為標示量的75%。本研究中為充分考察酮咯酸氨丁三醇口崩片的體外溶出行為,取樣點設置為90 min,結果10 min內樣品可溶出完全,溶出度超過90%。

