Box-Behnken 響應(yīng)面法優(yōu)選紫斑牡丹中丹皮酚和芍藥苷提取工藝*
周 坤,付永莉,羅 婷,羅 星,吳春芳
(湖北省武漢市精神衛(wèi)生中心·湖北省武漢市心理醫(yī)院,湖北 武漢 430012)
紫斑牡丹Paeonia rockii(S,G.Haw et L.A.Lauener)T.Hong et J.J.Li 為毛茛科芍藥屬多年生木本植物的干燥根皮[1],又名甘肅牡丹[2],是僅次于中原牡丹種群的第二大品種[3],因其花瓣基部有一明顯紫斑而得名[4],其根皮作為藥用丹皮已被《甘肅省中藥材標(biāo)準(zhǔn)》收載[5]。紫斑牡丹具有清熱涼血、活血化瘀功效,臨床多用于熱入營血、溫毒發(fā)斑、無汗骨蒸、經(jīng)閉痛經(jīng)等癥[1-2]。紫斑牡丹根皮中丹皮酚和芍藥苷的含量較高,高效提取和分離丹皮酚和芍藥苷對(duì)擴(kuò)大牡丹皮藥用資源和綜合利用有現(xiàn)實(shí)意義[6]。由于活性成分丹皮酚能隨水蒸氣蒸餾,采用蒸餾法獲得丹皮酚蒸餾母液,結(jié)合重結(jié)晶法獲取丹皮酚提取物[7],與傳統(tǒng)醇提法相比,具有純化后處理簡單、無水溶性雜質(zhì)干擾、提取純度更高等優(yōu)勢(shì)[8]。本研究中結(jié)合紫斑牡丹中活性成分的理化特性,先采用蒸餾法提取丹皮酚[9-10],后結(jié)合醇沉法提取芍藥苷[11-12],以二者提取率綜合評(píng)分為響應(yīng)值,通過對(duì)提取關(guān)鍵因素及相關(guān)水平的考察,優(yōu)化紫斑牡丹中丹皮酚及芍藥苷的最佳提取工藝。現(xiàn)報(bào)道如下。
1 儀器與試藥
1.1 儀器
Waters 2695型高效液相色譜儀(美國Waters公司);Starsorius BSI 型電子分析天平(天津泰斯特精密儀器有限公司,精度為萬分之一);KQ-250E 型超聲波清洗儀(昆山市超聲儀器有限公司,功率為300 W,頻率為50 kHz);RE-52AA 型亞榮旋轉(zhuǎn)蒸發(fā)儀(上海亞榮生化儀器廠);HH-4 型數(shù)顯恒溫水浴裝置(江蘇榮華儀器制造有限公司);CS101-AB 型電熱鼓風(fēng)干燥裝置(重慶試驗(yàn)設(shè)備廠)。
1.2 試藥
紫斑牡丹飲片(甘肅和順元中藥飲片有限公司,批號(hào)為2021112302);丹皮酚對(duì)照品(批號(hào)為110708-202103,純度大于98.5%),芍藥苷對(duì)照品(批號(hào)為110736-202141,純度大于98.5%),均購于中國食品藥品檢定研究院;甲醇、乙腈(色譜純,美國Tedia 公司);其他試劑均為分析純,水為三重蒸餾水。
2 方法與結(jié)果
2.1 含量測(cè)定
2.1.1 色譜條件
丹皮酚[13]179:色譜柱為Agilent Eclipse plus C18柱(250 mm×4.6 mm,5μm);流動(dòng)相為甲醇-水(45∶55,V/V);柱溫為25 ℃;流速為1.0 mL/ min;檢測(cè)波長為274 nm;進(jìn)樣量為10μL。
芍藥苷[13]108:色譜柱為CAPCELL PAK-C18柱(250 mm×4.6 mm,5μm);流動(dòng)相為0.1%磷酸-乙腈溶液(14∶86,V/V);流速為1.0 mL/min;柱溫為30 ℃;檢測(cè)波長為230 nm;進(jìn)樣量為10μL。
2.1.2 溶液制備
對(duì)照品溶液:取丹皮酚、芍藥苷對(duì)照品各適量,精密稱定,置10 mL 容量瓶中,加甲醇分別制成每1 mL 含0.600 0 mg 丹皮酚、1.500 0 mg 芍藥苷的對(duì)照品貯備液;取對(duì)照品貯備液各適量,加甲醇稀釋成質(zhì)量濃度分別為0.048,0.096,0.192,0.240,0.288μg/mL的丹皮酚對(duì)照品溶液[13]179及0.12,0.24,0.48,0.60,0.72μg/mL的芍藥苷對(duì)照品溶液[13]108。
供試品溶液:取紫斑牡丹根皮飲片50 g,精密稱定,置圓底燒瓶中,加液料比倍量的水,連接冷卻回流裝置,回流提取,參照2020年版《中國藥典(一部)》附錄中水蒸氣蒸餾法,收集9 倍量餾出液,4 ℃冰箱靜置12 h,傾去大部分上清液,濾過,得結(jié)晶物;合并濾液及上清液,加入其體積量5%的氯化鈉(即每100 mL 溶液加氯化鈉5 g)混勻,溶解,再進(jìn)行重蒸餾,收集3 倍量的重蒸餾液,4 ℃冰箱靜置12 h,濾過,得結(jié)晶物。合并2次結(jié)晶物,40 ℃熱風(fēng)干燥,得丹皮酚提取物。取丹皮酚提取物0.2 g,精密稱定,置具塞磨口錐形瓶中,精密加入甲醇50 mL,密塞,稱定質(zhì)量,超聲處理(功率為300 W,頻率為50 kHz)15 min,放冷,再稱定質(zhì)量,以甲醇補(bǔ)充減失的質(zhì)量,搖勻,濾過,精密取續(xù)濾液1 mL,置25 mL 容量瓶中,加甲醇定容,搖勻[13]179,即得丹皮酚供試品溶液。取上述回流提取液,趁熱濾過,合并濾液,濃縮至相對(duì)密度為1.10~1.20(60 ℃熱測(cè)),加入95%工業(yè)乙醇攪拌,靜置24 h,取上清液,濾渣再加95%工業(yè)乙醇醇沉12 h,合并2 次上清液,置旋轉(zhuǎn)蒸發(fā)儀中回收乙醇,得芍藥苷流浸膏,將流浸膏轉(zhuǎn)入蒸發(fā)皿中,以少量乙醇潤洗燒瓶,洗液轉(zhuǎn)入蒸發(fā)皿中,水浴蒸干,105 ℃烘3 h,干燥器中放冷,即得干膏。取干膏粉0.1 g,精密稱定,置50 mL磨口錐形瓶中,加稀乙醇35 mL,超聲處理(功率為240 W,頻率為45 kHz)15 min,放冷,加稀乙醇定容,搖勻,濾過,取續(xù)濾液[13]108,即得芍藥苷供試品溶液。
2.1.3 方法學(xué)考察
系統(tǒng)適用性試驗(yàn):分別吸取丹皮酚對(duì)照品溶液(0.192μg/mL)、芍藥苷對(duì)照品溶液(0.48μg/mL)、供試品溶液和空白溶劑各10μL,按2.1.1 項(xiàng)下色譜條件進(jìn)樣測(cè)定。供試品溶液中,待測(cè)組分與其相鄰峰分離度均大于1.5,理論板數(shù)按丹皮酚峰和芍藥苷峰計(jì)分別大于5 000和2 000。色譜圖見圖1。
線性關(guān)系考察:精密吸取2.1.2項(xiàng)下丹皮酚和芍藥苷對(duì)照品溶液各10μL,按2.1.1 項(xiàng)下色譜條件進(jìn)樣測(cè)定5 次,以對(duì)照品溶液質(zhì)量濃度(X,μg/mL)為橫坐標(biāo)、峰面積(Y)為縱坐標(biāo)進(jìn)行線性回歸,得回歸方程Y丹=75.315 2X丹-0.004 7(r=0.999 9,n=5)和Y芍=95.924 7X芍-0.003 8(r=0.999 8,n=5)。結(jié)果表明,丹皮酚和芍藥苷的質(zhì)量濃度分別在0.048~0.288μg/mL和0.12~0.72μg/mL范圍內(nèi)與峰面積線性關(guān)系良好。
檢測(cè)限與定量限確定:將丹皮酚和芍藥苷對(duì)照品溶液(質(zhì)量濃度分別為0.192,0.48μg/mL)逐級(jí)稀釋,分別以信噪比(S/N)為3 倍和10 倍時(shí)的質(zhì)量濃度為定量限和檢測(cè)限。結(jié)果丹皮酚和芍藥苷的定量限分別為0.018 7,0.023 4 μg/mL,檢測(cè)限分別為0.005 6,0.007 0μg/mL。
精密度試驗(yàn):精密量取丹皮酚和芍藥苷對(duì)照品溶液(質(zhì)量濃度分別為0.192,0.48 μg/mL)各10 μL,按2.1.1項(xiàng)下色譜條件進(jìn)樣測(cè)定6次,記錄峰面積。結(jié)果丹皮酚和芍藥苷峰面積的RSD分別為1.87%和1.55%(n=6),表明儀器精密度良好。
穩(wěn)定性試驗(yàn):精密量取2.1.2 項(xiàng)下供試品溶液適量,分別于0,3,6,9,12,24 h 時(shí)按2.1.1 項(xiàng)下色譜條件進(jìn)樣測(cè)定,記錄峰面積。結(jié)果丹皮酚和芍藥苷峰面積的RSD分別為1.94%和1.78%(n=6),表明供試品溶液在24 h內(nèi)穩(wěn)定性良好。
重復(fù)性試驗(yàn):取紫斑牡丹樣品(批號(hào)為2021112302),按2.1.2 項(xiàng)下方法制備丹皮酚和芍藥苷供試品溶液各5 份,按2.1.1 項(xiàng)下色譜條件進(jìn)樣測(cè)定,記錄峰面積,并計(jì)算含量。結(jié)果丹皮酚和芍藥苷含量的RSD分別為1.97%和1.89%(n=5),表明方法重復(fù)性良好。
加樣回收試驗(yàn):取6份已知含量的紫斑牡丹根皮飲片適量,每份0.5 g,精密稱定,向各批次飲片中分別準(zhǔn)確加入近100%的丹皮酚和芍藥苷對(duì)照品,混勻,按2.1.2 項(xiàng)下方法制備供試品溶液,按2.1.1 項(xiàng)下色譜條件進(jìn)樣測(cè)定。結(jié)果丹皮酚和芍藥苷的平均加樣回收率均為99.74%,RSD分別為1.33%和1.71%(n=6),表明方法準(zhǔn)確度良好。
2.1.4 丹皮酚含量和提取率的測(cè)定
分別精密吸取丹皮酚和芍藥苷供試品溶液各10μL,按2.1.1項(xiàng)下色譜條件進(jìn)樣測(cè)定,將測(cè)得峰面積(Y)代入回歸方程,計(jì)算供試品溶液的質(zhì)量濃度C1(μg)[14-16]。提取物中含量(X,mg/g)、提取率(Y,%)分別按公式(1)和(2)計(jì)算。
式中,X為提取物中丹皮酚或芍藥苷含量;Y為紫斑牡丹中丹皮酚或芍藥苷提取率;C為丹皮酚或芍藥苷供試品溶液峰面積對(duì)應(yīng)的質(zhì)量濃度;ms0為紫斑牡丹藥材的取樣量;ms1為丹皮酚或芍藥苷提取物取樣量;ms2為丹皮酚或芍藥苷的提取物總量。
2.2 提取工藝單因素考察
液料比:取紫斑牡丹根皮飲片5 份,各50 g,置圓底燒瓶中,分別按液料比為15,20,25,30,35倍加水,固定提取時(shí)間為2 h,乙醇體積分?jǐn)?shù)為55%,按2.1.2 項(xiàng)下方法制備供試品溶液,按2.1.1 項(xiàng)下色譜條件進(jìn)樣測(cè)定,考察不同液料比對(duì)紫斑牡丹中丹皮酚、芍藥苷提取率綜合評(píng)分的影響,結(jié)果見圖2 A。可見,液料比在15~25倍范圍內(nèi)時(shí),丹皮酚、芍藥苷的提取率綜合評(píng)分值隨液料比的增加而升高;之后,丹皮酚、芍藥苷提取率綜合評(píng)分呈下降趨勢(shì)。隨著液料比的進(jìn)一步增加,蒸餾液中丹皮酚被大量稀釋,在后續(xù)重結(jié)晶時(shí)提取率反而下降,導(dǎo)致丹皮酚、芍藥苷提取率綜合評(píng)分下降。因此,選擇液料比為25 倍作為Box-Behnken 響應(yīng)面試驗(yàn)液料比的中心點(diǎn)。

A.液料比 B.提取時(shí)間 C.乙醇體積分?jǐn)?shù)圖2 單因素考察結(jié)果A.Liquid-solid ratio B.Extraction time C.Ethanol volume fractionFig.2 Results of the single-factor experiment
提取時(shí)間:取紫斑牡丹根皮飲片4 份,各50 g,置圓底燒瓶中,液料比為25 倍,乙醇體積分?jǐn)?shù)為55%,提取時(shí)間考察范圍分別為1,2,3,4 h,分別按2.1.2 項(xiàng)下方法制備供試品溶液,按2.1.1 項(xiàng)下色譜條件進(jìn)樣測(cè)定,考察提取時(shí)間對(duì)紫斑牡丹中丹皮酚、芍藥苷提取率綜合評(píng)分的影響,結(jié)果見圖2 B。可見,提取時(shí)間在1~2 h范圍內(nèi)時(shí),丹皮酚、芍藥苷提取率綜合評(píng)分呈遞增趨勢(shì);當(dāng)提取時(shí)間超過3 h 時(shí),丹皮酚、芍藥苷提取率綜合評(píng)分下降趨勢(shì)明顯。可能是由于提取時(shí)間增加,受熱時(shí)間過長,餾出液中丹皮酚被大量稀釋,影響了重結(jié)晶收率;藥材加熱時(shí)間過長,藥渣糊化,對(duì)芍藥苷形成吸附、包埋作用,不利于過濾操作,導(dǎo)致芍藥苷提取率評(píng)分下降。因此,最終選擇Box-Behnken 響應(yīng)面試驗(yàn)提取時(shí)間中心點(diǎn)為2 h。
乙醇體積分?jǐn)?shù):取紫斑牡丹根皮飲片6 份,各50 g,置圓底燒瓶中,固定液料比為25 倍,提取時(shí)間為2 h,乙醇體積分?jǐn)?shù)考察范圍設(shè)置為45%,55%,65%,75%,85%,95%,分別按2.1.2 項(xiàng)下方法制備供試品溶液,按2.1.1 項(xiàng)下色譜條件進(jìn)樣測(cè)定,考察乙醇體積分?jǐn)?shù)對(duì)紫斑牡丹中丹皮酚、芍藥苷提取率綜合評(píng)分的影響,結(jié)果見圖2 C。可見,乙醇體積分?jǐn)?shù)在50%~60%時(shí),丹皮酚、芍藥苷的提取率綜合評(píng)分隨乙醇體積分?jǐn)?shù)的升高而升高;當(dāng)乙醇體積分?jǐn)?shù)高于60%時(shí),丹皮酚、芍藥苷提取率綜合評(píng)分開始顯著下降,可能與芍藥苷成分的極性密切相關(guān)。因此,最終選擇Box-Behnken 響應(yīng)面試驗(yàn)乙醇體積分?jǐn)?shù)的中心點(diǎn)為55%。
2.3 Box-Behnken 響應(yīng)面法優(yōu)化提取工藝
2.3.1 試驗(yàn)設(shè)計(jì)與結(jié)果
通過對(duì)影響綜合評(píng)分的因素進(jìn)行全面考察后,最終選取液料比(因素A)、提取時(shí)間(因素B)、乙醇體積分?jǐn)?shù)(因素C)和提取次數(shù)4 個(gè)關(guān)鍵影響因素作為本試驗(yàn)考察的自變量,鑒于提取次數(shù)為非連續(xù)型變量(不能無限賦值),該因素?zé)o法參與回歸分析,結(jié)合實(shí)際生產(chǎn)及文獻(xiàn)[14-16],暫定提取次數(shù)為2次。據(jù)Box-Behnken中心組合原理,取因素A、因素B、因素C 3 個(gè)關(guān)鍵因素,每個(gè)因素各設(shè)定低、中、高3 個(gè)水平,依次賦值為-1,0,+1,Box-Behnken響應(yīng)面試驗(yàn)因素與水平見表1。按試驗(yàn)組編號(hào)對(duì)應(yīng)的因素與水平進(jìn)行提取操作,計(jì)算各編號(hào)組中丹皮酚和芍藥苷的提取率,以提取物中丹皮酚提取率(Y1)和芍藥苷提取率(Y2)的總權(quán)重綜合評(píng)分為評(píng)價(jià)指標(biāo),采用加權(quán)評(píng)分法計(jì)算兩者總權(quán)重綜合評(píng)分,總權(quán)重綜合評(píng)分=(丹皮酚提取率/丹皮酚提取率最大值)×50+(芍藥苷提取率/芍藥苷提取率最大值)×50。結(jié)果見表2。

表1 Box-Behnken響應(yīng)面試驗(yàn)因素與水平Tab.1 Factors and levels of the Box-Behnken test
表2 Box-Behnken響應(yīng)面試驗(yàn)設(shè)計(jì)與結(jié)果Tab.2 Design and results of the Box-Behnken test
2.3.2 模型擬合與方差分析
采用Design-Expert軟件對(duì)表2中的數(shù)據(jù)進(jìn)行回歸分析,得因素A、因素B 和因素C 與總權(quán)重綜合評(píng)分的線性擬合回歸模型Y=95.74+14.66A+3.07B-2.36C+2.52AB-2.98AC+0.93BC-14.67A2-0.88B2-2.54C2。方差分析結(jié)果見表3。可見,建立的回歸方程模型F=960.42,P<0.000 1,表明擬合模型差異有統(tǒng)計(jì)學(xué)意義;失擬項(xiàng)P=0.770 1>0.05,差異不顯著,表明未知因素對(duì)結(jié)果干擾較小,試驗(yàn)誤差小,故判斷所建立的模型預(yù)測(cè)性良好。回歸模型中變量A,B,C,AB,AC,A2,C27 項(xiàng)對(duì)總權(quán)重綜合評(píng)分的線性效應(yīng)均較顯著(P<0.01)。回歸方程一次項(xiàng)中,以因素A 對(duì)因變量的總權(quán)重綜合評(píng)分影響最突出;因素B 次之,且影響均為正相關(guān);因素C對(duì)總權(quán)重綜合評(píng)分的影響為負(fù)相關(guān)。回歸方程二次項(xiàng)中,以A2和C2對(duì)總權(quán)重綜合評(píng)分的影響均為負(fù)相關(guān),其中以因素A 的影響最顯著,因素C影響次之[14-16]。

表3 方差分析結(jié)果Tab.3 Results of the analysis of variance
采用Design-Expert 軟件對(duì)表3 中的試驗(yàn)結(jié)果作圖,固定某一因素,可得任意2 個(gè)因素交互作用對(duì)綜合評(píng)分影響的三維響應(yīng)面及等高線圖,詳見圖3。
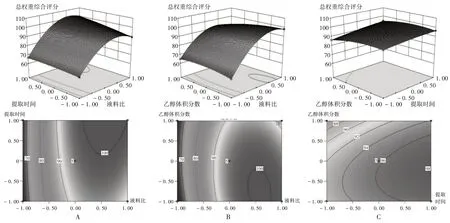
A.提取時(shí)間與液料比 B.液料比與乙醇體積分?jǐn)?shù) C.提取時(shí)間與乙醇體積分?jǐn)?shù)圖3 各影響因素交互作用對(duì)總權(quán)重綜合評(píng)分影響的二維等高線和三維響應(yīng)面圖A.Extraction time and liquid-solid ratio B.Liquid-solid ratio and ethanol volume fraction C.Extraction time and ethanol volume fractionFig.3 2D contour and 3D response surface maps of the interaction of various influencing factors on the total weight comprehensive scores
可見,因素A與因素B、因素A與因素C的三維響應(yīng)面圖均為陡峭開口向下的凸面,表明在所選定考察范圍內(nèi)存在響應(yīng)值的最大值;因素A 與因素B、因素A 與因素C的響應(yīng)值等高線圖均為圓形至橢圓形,其對(duì)應(yīng)三維響應(yīng)面圖為高度卷曲的曲面,表明自變量與因變量之間的函數(shù)關(guān)系并非單純的一元線性關(guān)系,故因素A、因素B、因素C 與總權(quán)重綜合評(píng)分間的線性關(guān)系采用多元線性方程描述更合理。通過Design-Expert 軟件統(tǒng)計(jì)數(shù)據(jù)分析,系統(tǒng)預(yù)測(cè)推薦的最佳參考工藝為液料比28.25 倍,提取時(shí)間147.2 min,乙醇體積分?jǐn)?shù)52.1%,該條件下理論最優(yōu)總權(quán)重綜合評(píng)分可達(dá)104.02,丹皮酚提取率為0.51%,芍藥苷提取率為5.42%。為方便實(shí)際操作,將該工藝參數(shù)調(diào)整為液料比28 倍,提取時(shí)間150 min,乙醇體積分?jǐn)?shù)52%。
2.3.3 驗(yàn)證試驗(yàn)
取紫斑牡丹根皮飲片3 份,各50 g,按優(yōu)選工藝進(jìn)行丹皮酚、芍藥苷提取。此工藝條件下丹皮酚提取率為0.49%(RSD=1.33%,n=3),芍藥苷提取率為5.38%(RSD=1.07%,n=3),總權(quán)重綜合評(píng)分103.62,與回歸方程的預(yù)測(cè)值基本接近,驗(yàn)證了該模型預(yù)測(cè)的準(zhǔn)確性。
3 討論
正交試驗(yàn)是對(duì)孤立的試驗(yàn)點(diǎn)進(jìn)行分析的一種優(yōu)化多變量系統(tǒng)的有效試驗(yàn)設(shè)計(jì)工具,能給出最佳因素水平組合,但無法找出整個(gè)區(qū)域因素最佳組合和響應(yīng)值的最優(yōu)值[17]。響應(yīng)面法通過對(duì)響應(yīng)面等值線的分析尋求最優(yōu)工藝參數(shù),將多因素試驗(yàn)中因素與指標(biāo)的相互關(guān)系用二次多項(xiàng)式擬合。該方法研究因素與響應(yīng)值、因素間的交互作用,獲得的預(yù)測(cè)模型多為曲面,在試驗(yàn)條件尋優(yōu)過程中,可連續(xù)對(duì)各水平進(jìn)行分析[18]。響應(yīng)面法獲得的預(yù)測(cè)模型為曲面,線性方程為多元線性回歸,故此模型的擬合度、失擬項(xiàng)參數(shù)對(duì)模型預(yù)測(cè)的準(zhǔn)確性有較高要求,否則模型會(huì)失去其預(yù)測(cè)意義,導(dǎo)致系統(tǒng)給出的預(yù)測(cè)值出現(xiàn)較大偏差;響應(yīng)面設(shè)計(jì)無法對(duì)試驗(yàn)的非連續(xù)型變量(如提取次數(shù))進(jìn)行考察,通常需單獨(dú)考察;響應(yīng)面優(yōu)化系統(tǒng)給出的工藝參數(shù)是理論基礎(chǔ)上的,參數(shù)往往需結(jié)合生產(chǎn)實(shí)際加以修正,并對(duì)其進(jìn)行工藝驗(yàn)證。
本研究中通過單因素試驗(yàn)獲取響應(yīng)面試驗(yàn)關(guān)鍵因素的中心點(diǎn),在確立相應(yīng)中心點(diǎn)基礎(chǔ)上,采用Box-Behnken 響應(yīng)面法優(yōu)化紫斑牡丹中丹皮酚和芍藥苷提取工藝。通過線性擬合模型發(fā)現(xiàn),一次項(xiàng)中液料比與總權(quán)重綜合評(píng)分呈正相關(guān),且液料比影響最大;乙醇體積分?jǐn)?shù)對(duì)總權(quán)重綜合評(píng)分的影響為負(fù)相關(guān),提示乙醇體積分?jǐn)?shù)并非越大越好。當(dāng)乙醇體積分?jǐn)?shù)超過57.5%時(shí),總權(quán)重綜合評(píng)分降至70,為維持較好的芍藥苷提取率,故乙醇體積分?jǐn)?shù)應(yīng)嚴(yán)格控制在50%~53%。二次項(xiàng)中,盡管A2,C2與總權(quán)重綜合評(píng)分呈負(fù)相關(guān),但兩者的線性效應(yīng)均高度顯著(P<0.01),其中以液料比的影響最大,提取時(shí)間次之,提示液料比是提取過程中應(yīng)重點(diǎn)監(jiān)控的因素,液料比過大,丹皮酚蒸餾液體積過大,影響重結(jié)晶效率;液料比過小,蒸餾液提取不完全。三維響應(yīng)面圖顯示,交互項(xiàng)中液料比和提取時(shí)間對(duì)總權(quán)重綜合評(píng)分有較大影響。本研究結(jié)果顯示,乙醇體積分?jǐn)?shù)為52%時(shí)對(duì)芍藥苷有良好的選擇性,考慮到實(shí)際操作需要,在合理范圍內(nèi)對(duì)液料比和提取時(shí)間進(jìn)行適當(dāng)調(diào)整,最終優(yōu)選紫斑牡丹中丹皮酚和芍藥苷提取工藝為液料比28倍,提取時(shí)間150 min,乙醇體積分?jǐn)?shù)52%。

