甲醇/正庚烷混合燃料自燃特性實驗與數值模擬研究
張東,王秋凱,李興奇,王自鑫,馮立巖
大連理工大學 能源與動力學院,遼寧 大連 116024
以可再生能源制取的綠色甲醇是一種碳中和燃料。推廣綠色甲醇應用對于實現碳中和、碳達峰戰略目標意義重大[1]。甲醇具有燃燒清潔、儲運方便、抗爆性好等優點,是一種優質替代燃料。然而,甲醇的十六烷值低,難以自燃,在發動機中燃用甲醇時需要采用火花塞點燃或者微量噴射柴油引燃[2]。對于缸徑大、轉速低的船用甲醇發動機,火花塞無法提供足夠的點火能量,必須采用柴油引燃的方式。微量噴射柴油引燃的甲醇發動機主要包括低壓噴射甲醇的預混合燃燒模式[3?4]與高壓噴射甲醇的擴散燃燒模式[5]。此外,甲醇/柴油雙燃料機還可以根據不同港口的燃料加注條件自由選擇以甲醇或者柴油為主燃料工作。因此,船用甲醇發動機以甲醇/柴油雙燃料機為主要形式。MAN 公司的ME-LGIM 甲醇/柴油二沖程雙燃料機即采用在原柴油機缸蓋加裝甲醇噴射系統,以實現原柴油機到甲醇/柴油雙燃料機的轉換[6]。甲醇/柴油雙燃料機性能的改善則依賴于對甲醇/柴油燃燒特性的深入理解。由于甲醇/柴油雙燃料機的燃燒涉及甲醇和柴油混合物的自燃過程和火焰傳播過程,其復雜性較高,需要通過燃燒基礎實驗和燃燒數值模擬等研究方法深入理解甲醇/柴油的自燃特性和燃燒特性。甲醇/柴油燃料自燃特性的基礎實驗研究為甲醇/柴油燃料著火性能研究提供重要的基礎數據,同時也為燃燒數值模擬研究的反應機理提供標定依據。柴油組分眾多且復雜,因此一般選用與之十六烷值近似的正庚烷替代其進行自燃特性研究。詳細反應機理規模過大,需要經過簡化以應用于發動機燃燒計算中。簡化過程為:將經過驗證的化學動力學機理應用于化學動力學分析,通過反應速率與敏感性分析等化學動力學分析方法得出反應過程中的關鍵物質與反應,將機理中的關鍵物質與反應保留而去除多余的物質與反應即得到骨架機理。骨架機理需要重新經過實驗數據驗證。同時,針對單一燃料提出的反應機理(如愛爾蘭國立大學(National University of Ireland,NUI)的正庚烷詳細機理[7])應用于混合燃料的化學動力學分析仍然需要混合燃料的自燃特性實驗數據進行驗證。
近年來,研究人員應用激波管和快速壓縮機等基礎實驗設備開展了甲醇單一燃料和甲醇/柴油替代物(本文采用正庚烷)燃料自燃特性研究。其中,快速壓縮機的工作過程及溫度壓力最貼近發動機,是自燃特性研究的重要實驗設備。Kumar 等[8]、Wang 等[9]和Burke 等[10]分別應用激波管、快速壓縮機、流動反應器等實驗設備進行了甲醇自燃特性研究。將實驗測得的滯燃期與組分濃度等數據與機理預測數據進行對比,并對甲醇的化學動力學機理進行發展。一些研究機構和學者針對正庚烷自燃特性進行了研究[11?12],并且提出了相應的動力學機理。Li 等[13]利用激波管進行了高溫低壓條件下甲醇/正庚烷混合物自燃特性研究。研究發現,在當量比Φ=1 時,甲醇比例增加會使滯燃期縮短,這是由于其增加了關鍵基團超氧化氫(HO2)。HO2隨后分別與燃料和氫基(H)反應,造成自由基池的爆炸性增長。然而其高溫低壓實驗工況與甲醇/柴油雙燃料機的高壓低溫實驗工況相差較大。Zhu 等[14]采用加熱激波管與加熱快速壓縮機進行了甲醇/柴油(由正十六烷、異十六烷、1-甲基萘組成的柴油替代物)混合物的滯燃期測量。研究結果表明甲醇添加對于混合燃料的自燃具有非線性抑制作用。Wu 等[15]利用激波管、快速壓縮機與定容彈進行了甲醇/正庚烷滯燃期與層流火焰速度的測量,對于研究甲醇/柴油雙燃料機的燃燒特性具有重要的意義。然而,Zhu 與Wu 等對于不同甲醇/柴油(或正庚烷)混合比例的混合氣,其僅進行了當量比為1 情況下的滯燃期測量。對于缸內直噴的甲醇/柴油雙燃料機來說,其燃燒形式為擴散燃燒,缸內不同位置混合氣混合比例差異較大。因此,需要對于更寬廣范圍的實驗工況與甲醇/正庚烷混合比例下的混合氣自燃特性進行研究。
綜上所述,雙燃料機工作條件下的燃料自燃特性對于其燃燒特性分析與燃燒機理的優化具有重要的意義,然而目前國內外對于甲醇柴油雙燃料的相關研究相對較少。為闡述甲醇/柴油雙燃料機在著火及燃燒過程中燃料間相互作用,為甲醇雙燃料機燃燒機理的優化提供理論指導,本文采用快速壓縮機,以正庚烷作為柴油替代物,研究了溫度(630~910 K)、壓力(1.5~3.2 MPa)、不同甲醇/正庚烷比例(25/75、50/50、75/25、90/10)與當量比(0.67~4.00)下甲醇/正庚烷氣相混合物的著火特性。根據實驗數據驗證了NUI 的正庚烷詳細機理,進而進行化學動力學分析,探究甲醇/正庚烷著火過程中的相互作用機理,得出氧化過程中的關鍵物質與反應。
1 自燃特性實驗與模擬方法
1.1 快速壓縮機
實驗采用自主搭建的快速壓縮機,其主要參數與示意分別如表1 和圖1 所示。
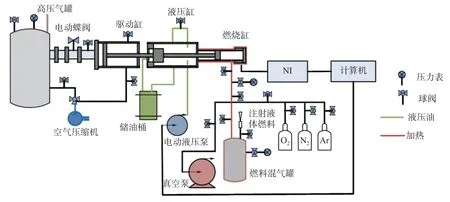
圖1 快速壓縮機示意

表1 快速壓縮機主要參數
快速壓縮機是模擬內燃機壓縮過程,提供定容燃燒環境的實驗裝置。快速壓縮機試驗臺分為驅動系統、液壓系統、燃燒系統、配氣系統、數據采集系統5 個部分。高壓氣罐作為驅動系統的動力來源,將運動部件迅速推進到上止點。液壓系統確定活塞的下止點,并在活塞到達上止點前起緩沖作用。燃燒缸是快速壓縮機的核心部分,是混合氣自燃發生和監測壓力的區域。實驗采用縫隙活塞以抑制燃燒缸內卷生渦流,確保燃燒缸內溫度均勻性[16]。數據采集系統由氣缸壓力傳感器AVL GH14DK、電荷放大器AVL 2P2x、NI 采集設備CRIO-9 042 組成,記錄燃燒缸內缸壓變化。有效壓力與有效溫度作為滯燃期測量對應的物理條件[17?18]。有效壓力peff的定義為上止點壓力pmax與由于熱損失而造成的壓力下降的最低值pmin之間的壓力積分平均值,有效溫度Teff依據絕熱壓縮積分計算得到,即
式中:p0、T0分別為初始壓力和初始溫度, γ為混合氣與溫度相關的比熱比。通過改變p0、T0或壓縮比進而改變peff與Teff。圖2 是燃燒缸內壓力曲線與滯燃期定義。其中,非反應壓力曲線是將混合氣中氧氣替換為氮氣,用來模擬上止點后的熱損失。0 時刻為活塞到達上止點時刻。一階段滯燃期τ1和總滯燃期τ分別定義為上止點時刻與第一階段放熱和燃料燃燒造成的壓力上升斜率最大值對應時刻之間的時間間隔[19]。
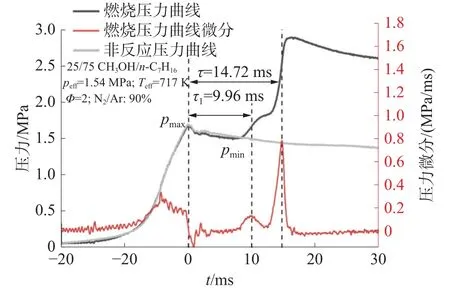
圖2 實驗壓力曲線與滯燃期定義
1.2 混合氣制備
混合氣儲存在由304 不銹鋼制成的20 L 混氣罐中,各組分比例遵循道爾頓分壓定律。配置實驗混合氣前,需要先將混氣罐加熱到初始溫度。甲醇與正庚烷的分壓力分別低于其飽和蒸氣壓的1/3,以確保其不會出現冷凝現象。實驗采用的氮氣、氧氣、氬氣的純度為99. 99%。為了表征不同工況下擴散燃燒缸內不同區域混合氣比例與濃度的差異,本文進行了寬廣實驗條件下的混合氣自燃特性研究,混合氣的具體配比如表2 所示。圖3 是MAN LGI 甲醇柴油機,圖4 是對應的甲醇柴油噴油示意。圖4 中數字分別對應表2 混合氣比例,忽略燃料噴束外的燃料濃度極低部分。甲醇與柴油油束交匯處為燃料最濃區,向外擴散燃料濃度逐漸降低,最外圈到最內圈分別設置當量比為0.67~4.00,同一圈內(即相同當量比下)從左向右柴油濃度逐漸降低,分別設置25/75、50/50、75/25、90/10 以表示不同位置甲醇/柴油混合比例的差異。

圖3 MAN LGI 甲醇柴油機
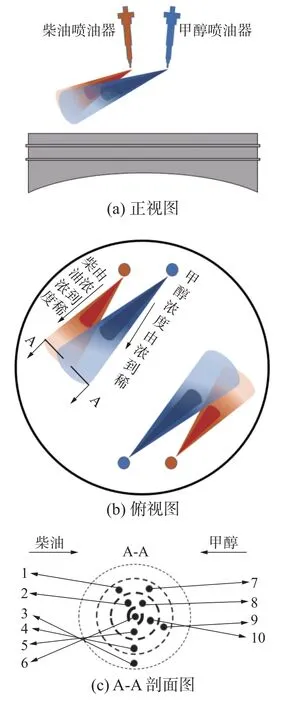
圖4 甲醇柴油噴油示意
每次試驗開始前,首先將燃燒室抽至真空狀態,然后將混氣罐中的混合氣充入燃燒室中。電動液壓泵在液壓缸中建立高壓油壓,使活塞固定在下止點。待電動蝶閥完全開啟后,利用電磁閥關閉電動液壓泵,活塞在驅動壓力作用下迅速到達上止點并保持在上止點,形成定容燃燒環境。
1.3 設備有效性與動力學模型
為了驗證實驗設備的有效性,首先進行了單一正庚烷自燃特性的驗證實驗。實驗上止點壓力為1.5 MPa,混合氣中正庚烷占比0.95%,O2占比10.45%,氬氣與氮氣共占比88.6%,如圖5 所示。為了更好地擬合阿倫尼烏斯公式,對于縱坐標滯燃期做對數處理,對橫坐標溫度做1 000/T(1 000β)處理。在相近實驗條件下,將本文的實驗數據與Yu 等[20]的研究結果進行對比,本文的滯燃期測試結果及變化趨勢與其基本一致,體現了設備的有效性。燃燒過程的模擬采用CHEMKIN PRO 軟件,選用的計算模型為封閉零維均質反應器模型,求解定容絕熱能量方程。由于正庚烷機理中包含甲醇子機理,因而在模擬過程中采用正庚烷機理即可。準確的動力學模型對于化學動力學分析十分重要,本文研究選用的動力學機理是NUI 的詳細正庚烷機理。該機理中包含1 252 種物質與基團、5 336個反應。該機理針對單一正庚烷燃料提出,對于甲醇/正庚烷混合燃料滯燃期的預測能力需要進行驗證。在模擬過程中采用等效容積法[18]計算滯燃期,即將上止點后由于熱損失而造成的壓力下降轉化為容積的變化,使計算更加精準。
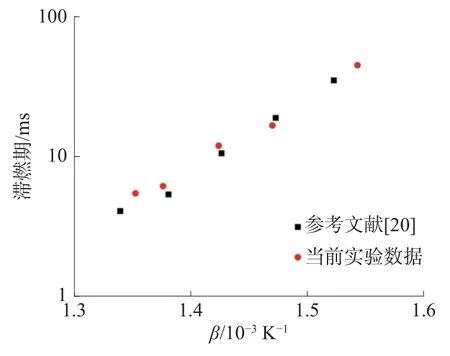
圖5 實驗數據與參考文獻中數據的比較
2 自燃特性實驗結果及數值模擬
2.1 實驗結果
2.1.1 不同壓力下CH3OH/n-C7H16物質的量比變化對于滯燃期影響
圖6 是在Φ=1 與Φ=2、壓力分別為15、3.2 MPa下,滯燃期隨混合氣中甲醇/正庚烷物質的量比例變化的情況。由圖6 可知,NUI 機理可以預測到滯燃期變化趨勢,并且對于滯燃期數值預測準確性較高,可以用于后續的化學動力學分析。在2 種當量比與壓力下,混合氣中甲醇與正庚烷物質的量比為25/75、50/50 時,均觀測到負溫度系數(negative temperature coefficient,NTC)區域,而混合氣中甲醇與正庚烷物質的量比為75/25、90/10時,基本沒有NTC 區域。在試驗溫度區間內,隨著混合氣中甲醇比例的增加,系統反應活性降低,滯燃期增加。隨著溫度升高,不同物質的量比例混合燃料的滯燃期逐漸接近。根據圖6(a)、圖6(c)和圖6(b)、圖6(d)對比可以發現,壓力升高可以顯著降低滯燃期。這是由于壓力升高可以增加分子碰撞頻率,從而加速反應,縮短滯燃期。
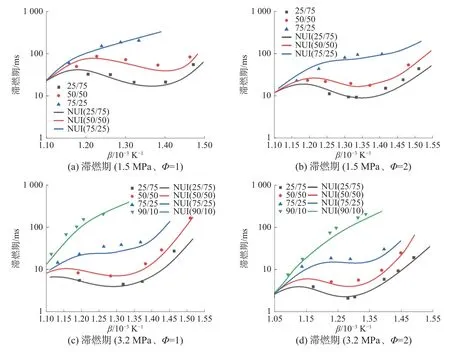
圖6 不同甲醇/正庚烷摩爾比下滯燃期
2.1.2 當量比變化對于滯燃期影響
圖7 是在壓力為3.2 MPa,甲醇/正庚烷摩爾比例分別為25/75、50/50、75/25、90/10 下,滯燃期隨混合氣當量比變化的情況。由圖7 可知,在實驗工況下,隨著當量比的增加,混合氣滯燃期縮短,這與甲醇/正庚烷混合物在高溫工況下的情況有一些不同。在高溫工況(T>1 200 K)下,甲醇/正庚烷物質的量比例為30/70、50/50 時,Φ=1 比Φ=0.5時滯燃期長;而甲醇/正庚烷物質的量比例為70/30、90/1 時,Φ=1 比Φ=0.5 時滯燃期短[13]。這是由于甲醇與正庚烷在高溫與低溫下反應活性差距不同導致的。同時,根據圖7(b)可以發現,隨著當量比增加到一定程度,滯燃期下降程度變緩。
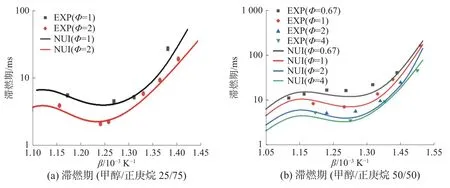
圖7 不同當量比下滯燃期
2.1.3 兩階段燃燒
正庚烷自身燃燒具有兩階段燃燒表現,甲醇與正庚烷混合氣中正庚烷比例較高時仍然具有兩階段燃燒表現。圖8 是壓力為1.5 MPa、甲醇/正庚烷物質的量比例為25/75、50/50、當量比分別為1、2 時的一階段滯燃期數據。1.5 MPa 下,甲醇比例為25%與50%的混合氣的一階段滯燃期均沒有NTC 表現,即其他條件相同時,混合氣一階段滯燃期隨著溫度升高而降低。隨著當量比增加,混合氣一階段滯燃期降低;隨著混合氣中正庚烷比例的增加,一階段滯燃期降低。對比可以發現,混合氣中正庚烷所占比例對于一階段滯燃期的影響要大于當量比。
自燃特性實驗數據可以體現雙燃料機缸內不同區域混合氣自燃規律,同時,也為反應機理的驗證提供依據。反應機理經過驗證可用于化學動力學分析,得出反應過程中的關鍵物質與反應,為骨架機理的搭建提供理論依據。
2.2 數值模擬結果
2.2.1 化學動力學分析
為了進一步探究甲醇/正庚烷混合氣的自燃特性,首先進行了一些關鍵自由基與基團的摩爾濃度隨時間變化的數值分析。圖9 是900 K、3.2 MPa 條件下各自由基與物質及溫度變化情況。值得注意的是,甲醇與正庚烷均在燃燒前反應完全,正庚烷總反應速率持續增大,而甲醇總反應速率前期非常緩慢,后迅速增長超越正庚烷直到反應完全。
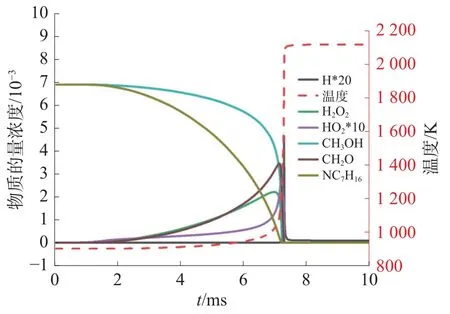
圖9 物質的量濃度及溫度變化情況
2.2.2 反應速率與敏感性分析
通過反應速率與敏感性分析可以進一步探究甲醇正庚烷混合氣氧化過程的關鍵反應。對于甲醇正庚烷(25/75、50/50、75/25、90/10)、當量比1 和2、稀釋比90%N2的混合氣在900 K、3.2 MPa進行反應速率與敏感性分析。反應速率分析表明了影響各組分生成或消耗最大的化學反應的反應速率隨時間的變化情況。反應速率為正表示生成該物質,負表示消耗。標準化敏感性系數用來表征影響著火過程的反應,定義為
式中:ki為動力學機理中第i個反應的反應速率常數。各反應與NUI 機理中反應序號對應。敏感性系數為正表示降低系統反應活性,延長滯燃期,為負表示提高系統反應活性,縮短滯燃期。
圖10 和11 分別為900 K、3.2 MPa 下正庚烷與甲醇反應速率變化情況。表3 為正庚烷與甲醇生成與消耗的主要反應。由圖10 可知,不同甲醇正庚烷比例與不同當量比下,正庚烷氧化過程中主要反應基本相同。當前條件下脫氫反應是正庚烷消耗速率最快的反應。其中,正庚烷與OH 的脫氫反應(R4209、R4210、R4211、R4212)是正庚烷氧化過程中的主導反應,其次是同H 和HO2的脫氫反應(R4201、R4202、R4203、R4204、R4218、R4219)。燃燒前,脫氫反應的反應速率持續增大,使正庚烷總體消耗速率持續增大。
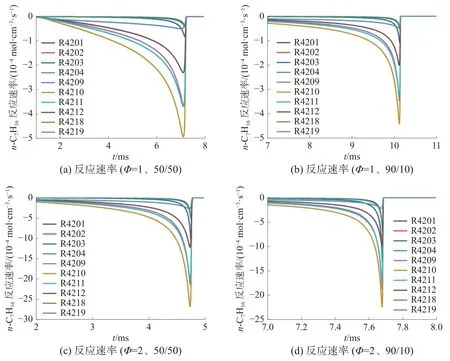
圖10 正庚烷反應速率變化情況
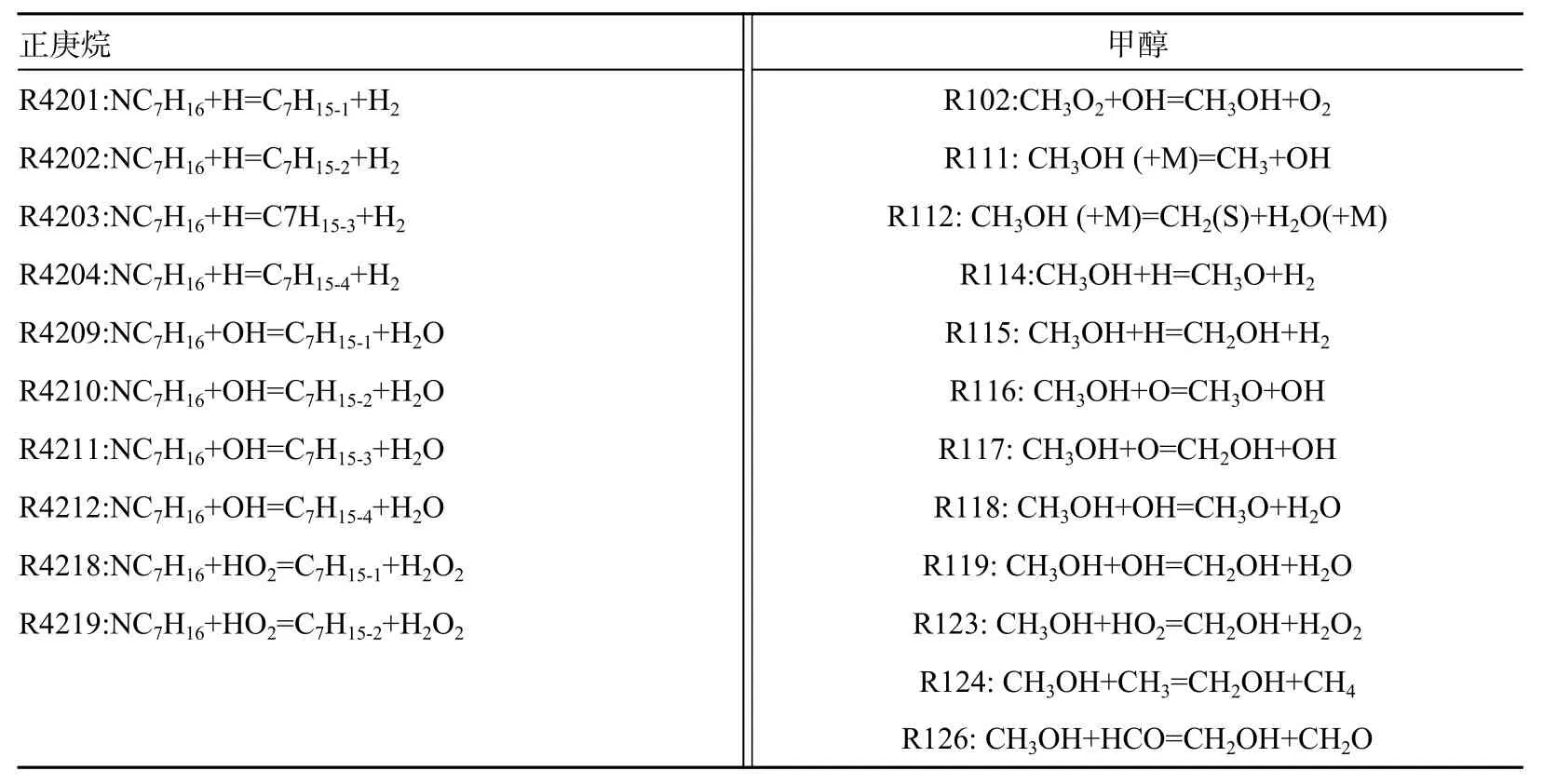
表3 正庚烷與甲醇生成和消耗的主要反應
如圖11 所示, 甲醇含量較低時, R111(CH3OH (+M)=CH3+OH(+M))反應生成甲醇的反應速率相對較大,因此甲醇在反應初期消耗速率較慢。R119(CH3OH+OH=CH2OH+H2O)反應消耗甲醇,這2 個反應是甲醇氧化過程中的重要反應。R119 是甲醇與正庚烷競爭OH 基的主要反應,對于整體自燃反應具有抑制作用。相同當量比下甲醇比例增加會加劇對于H、OH 等自由基的競爭,降低正庚烷的反應速率,抑制系統氧化過程。當量比增加使甲醇(R119 等)與正庚烷(R4218、R4219 等)反應速率均加快,但是正庚烷相關反應對于系統反應促進程度更明顯,因此滯燃期縮短。
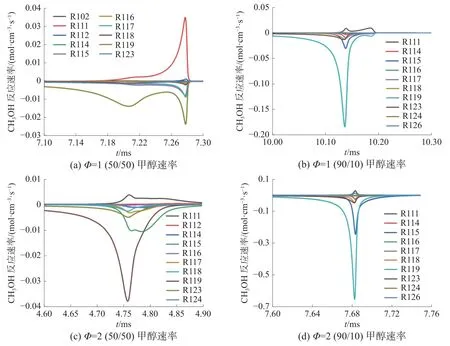
圖11 甲醇反應速率變化情況
圖12 是H、OH 等關鍵自由基反應速率變化情況。其中,H 主要來源于燃料,后期通過甲醛(formaldehyde,CH2O)、氧氣(O2)等小分子進行生成與消耗反應。 OH 的主要生成反應是R21(H2O2(+M)=2OH(+M)),主要消耗反應是與CH2O 進行的脫氫反應(R156)。由圖12 可知,HO2和CH2O 與甲醇正庚烷存在小分子自由基(H、OH)的競爭關系,并且反應速率快得多。
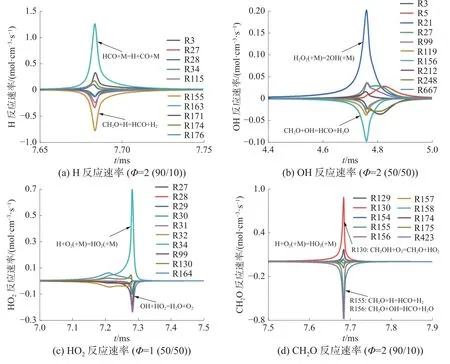
圖 12 關鍵物質反應速率變化情況
圖13 是900 K、3.2 MPa 甲醇/正庚烷(25/75、50/50、75/25、90/10)當量比分別為1 和2 的標準化敏感性系數。由圖13 可知,在該工況下,甲醇/正庚烷混合物對于反應R32 最為敏感,并且R32 的HO2生成穩定的H2O2降低系統反應活性。正庚烷與HO2基的脫氫反應(R4218、R4219、R4220)、與OH 的脫氫反應(R4209)均有利于提高系統反應活性,并且隨著混合氣中正庚烷比例的增加,提升程度更大。H2O2的分解反應(R21)生成活躍的OH,是促進系統氧化過程進行的重要反應。甲醇與OH 基的脫氫反應(R119)敏感性系數為正,阻礙系統的自燃過程。該反應(R119)在甲醇與正庚烷比例相近時(50/50、75/25),對于系統氧化過程的抑制程度更強。正庚烷氧化中間產物的β 分解(R4315、R4316、4318)對于系統的氧化過程具有抑制作用。
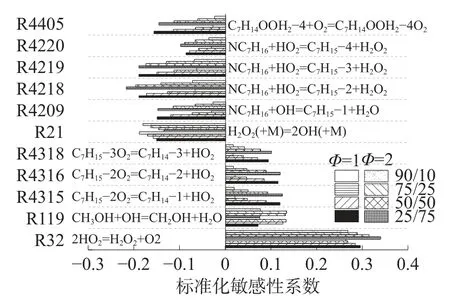
圖13 標準化敏感性系數
3 結 論
1)本文利用快壓機實驗平臺測量了甲醇/正庚烷(25/75、50/75、75/25、90/10)在1.5~3.2 MPa、630~910 K、當量比0.67~4.00 下的滯燃期數據。在實驗溫度壓力區間內,部分混合氣具有NTC 現象。在低溫工況下,總滯燃期隨壓力升高而降低。總滯燃期與一階段滯燃期隨當量比增加而降低、隨混合氣中甲醇所占比例增加而增加。其中,當量比增加到一定程度,滯燃期下降減緩。
2)化學動力學分析中,低溫工況下,正庚烷主要通過OH 進行脫氫反應,其次是H、HO2,提高系統反應活性。甲醇作為燃料,同時是正庚烷氧化路徑上的組分。甲醇初始濃度較低時,氧化過程中有一部分甲醇生成,而甲醇初始濃度較高時,氧化過程中生成的甲醇基本可以忽略。甲醇與正庚烷存在OH 的競爭關系,這也是低溫下混合氣中甲醇含量越多滯燃期越長的原因。同時,R21 反應生成OH,是重要的促進系統氧化過程進行的反應。R32 反應HO2生成穩定的H2O2是系統氧化過程中最敏感的反應。
本文進行的自燃特性研究有助于對現有的化學動力學模型進行檢驗和驗證,后續將進一步得到適用于甲醇柴油雙燃料機燃燒計算的骨架機理。

