基于超高效液相色譜—串聯質譜同時測定大鼠血漿中杜仲制劑的藥代動力學研究
董瑩瑩 郭琴 高煥 張立石 柏冬
杜仲為杜仲科植物杜仲EucommiaulmoidesOliv的干燥樹皮,是我國歷史悠久的名貴中藥材,該植物是稀有瀕危植物,已被列為國家二級保護樹種。它是中國最有價值的補藥之一,具有養肝補腎、強身健骨、預防流產的作用[1]。現代藥理學研究表明,杜仲在降低血壓[2]、抑制炎癥[3]、降低血糖[4]、減輕肝損傷[5]、減輕神經炎癥[6]、抗骨關節炎[7]等方面具有重要作用。正是由于杜仲具有多種藥理活性,在臨床上應用廣泛,主要用于片劑、膠囊劑、顆粒劑、配方顆粒四種劑型。
目前,雖然對杜仲的藥代動力學有一些研究[8-9],但對杜仲及其制劑的藥代動力學分析尚未進行研究。本研究基于超高效液相色譜—串聯質譜(ultra high performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)技術建立杜仲及其制劑中原兒茶酸、京尼平苷酸、松脂醇二葡萄糖苷、無梗五加苷B、松脂醇葡萄糖苷、京尼平苷、綠原酸、咖啡酸等8個成分的同時測定方法,并應用于四種杜仲制劑的藥代動力學研究。
1 材料與方法
1.1 儀器
Agilent 1260高分離度快速液相色譜儀,Agilent 6410質譜儀,美國Agilent科技公司;TGL-16MC型低溫離心機;SB-5200DT超聲波清洗機,寧波新芝生物科技股份有限公司;VORTEX 3型渦旋混合器,德國IKA公司
1.2 藥品和試劑
杜仲飲片,江西普真藥業有限公司,批號:20190322;杜仲全粒膠囊,江西普真藥業有限公司,批號:Z20055116;杜仲顆粒,貴州參芪藥業有限公司,批號:Z52020394;杜仲配方顆粒,廣東伊芳藥業有限公司,批號:20160214;京尼平苷酸、松脂醇二葡萄糖苷、無梗五加苷B、松脂醇葡萄糖苷,上海源葉生物技術有限公司,批號分別為Y02A9H57757、J06J9T65071、X26D9L78667、B21724;原兒茶酸、京尼平苷、綠原酸、咖啡酸,中國北京國家食品藥品監督管理總局,批號分別為110809-200604、111828-201604、0753-200111、110885-201703;3,4-二羥基苯乙酸,美國Sigma-Aldrich 公司,批號:850217-1G;乙腈,美國Fisher Scientific公司;甲醇、甲酸,Thermo Fisher Scientific中國公司。
1.3 動物
24只清潔級雄性SD大鼠,體質量(300±20)g,購于SPF(北京)生物科技有限公司,實驗動物許可證號:SCXK (京) 2016-0002,該實驗經過由中國中醫藥科學院中醫基礎理論研究所醫學倫理委員會批準(批準文號:2019-052)。
1.4 檢測條件
安捷倫SB C18色譜柱(2.1 mm×50 mm,1.8 μm);流動相由0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B)組成,流速為0.3 mL/min,梯度洗脫(0~1分鐘,5%B;1~3分鐘,45%B;3~6.4分鐘,65%B),停止時間和后處理時間分別為6.4分鐘和8分鐘,進樣體積為2 μL,柱溫為35℃。
電噴霧電離源(electrospray ionization,ESI),負離子模式掃描,多反應監測(Multiple Reaction Monitoring,MRM)模式。離子源溫度為350 ℃,鞘氣為氮氣(99.9%),氣體流速設定為12 L/min,毛細管電壓為4 000 V,霧化氣體壓力為40 psi。待測成分定量分析離子對及質譜參數。見表1。

表1 8種化合物和內標成分(IS)的優化參數
1.5 對照品溶液的制備
分別精密稱取原兒茶酸、京尼平苷酸、松脂醇二葡萄糖苷、無梗五加苷B、松脂醇葡萄糖苷、京尼平苷、綠原酸、咖啡酸對照品適量,加甲醇制成濃度分別為10.00 μg/mL、10.22 μg/mL、10.14 μg/mL、8.85 μg/mL、10.18 μg/mL、10.02 μg/mL、7.98 μg/mL、10.45 μg/mL的混合對照品溶液。用甲醇將上述混合對照品溶液稀釋10個系列濃度,比例為5倍,置于在4 ℃下保存,備用。
1.6 內標溶液(IS)的制備
精密稱取內標物3.4-二羥基苯乙酸適量,加甲醇制備成濃度為10.05 μg/mL的內標溶液,置于在4 ℃下保存,備用。
1.7 供試品溶液
杜仲飲片:稱取杜仲飲片260 g,用8倍量去離子水煎煮40分鐘,過濾后,濾渣再采用6倍量去離子水煎煮30分鐘,合并濾液,減壓濃縮至100 mL。全杜仲膠囊:取全杜仲膠囊過60目篩,精密稱取50 g,用去離子水溶解至100 mL溶解樣品。杜仲顆粒:稱取杜仲顆粒135 g,用去離子水100 mL溶解樣品。杜仲配方顆粒:稱取杜仲配方顆粒13 g,用去離子水100 mL溶解樣品。
1.8 血漿樣品的制備
向100 μL血漿中加入20 μL內標物溶液(10.05 μg/mL)和310 μL酸化乙腈(300 μL乙腈+10 μL 5%甲酸)。將混合物渦旋3分鐘,在冰浴中超聲提取10分鐘,以12 000 r/min離心10分鐘。將上清液轉移到干凈的試管中,并通過真空冷凍干燥蒸發至干燥狀態。然后加入100 μL流動相(乙腈∶水=1∶4)渦旋3分鐘溶解殘渣,超聲提取10分鐘,12 000 r/min離心10分鐘后取上清液,即為血漿樣品。
1.9 給藥以及血漿的收集
24只雄性SD大鼠,適應性喂養一周后,隨機分成4組,包括杜仲飲片組、全杜仲膠囊組、杜仲顆粒組和杜仲配方顆粒組,每組6只。實驗前,大鼠禁食12小時。按照1.7項下的方法制備供試品溶液,灌胃給藥,劑量分別為杜仲飲片組(104 g/kg)、全杜仲膠囊組(20 g/kg)、杜仲顆粒組(54 g/kg)、杜仲配方顆粒組(5.2 g/kg)。在給藥前和給藥后15分鐘、30分鐘、1小時、2小時、4小時、6小時、8小時、12小時、24小時摘眼球取血,置于肝素鈉抗凝管中,3 000 r/min離心15分鐘,取上清液即為血漿,置于-80℃下保存備用。
1.10 統計學方法
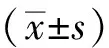
2 結果
2.1 專屬性
分別對空白血漿樣品,加入混合對照的空白血漿樣品,以及口服給藥后從大鼠收集的血漿樣品,按照1.8項下方法處理后進行UPLC-MS/MS分析,所有化合物和內標物的代表性MRM色譜圖如圖1所示,在8種化合物和內標物的保留時間內,基質中沒有出現任何干擾,說明該方法的專屬性良好。

注:A為空白血漿;B為加入標準化合物和內標的空白血漿;C為口服給藥從鼠中收集血漿樣品,1為原兒茶酸;2為京尼平苷酸;3為松脂醇二葡萄糖苷;4為無梗五加苷B;5為松脂醇葡萄糖苷;6為京尼平苷;7為綠原酸;8為咖啡酸;9為3.4-二羥基苯乙酸(IS)。
2.2 標準曲線
將混合對照品溶液加入到空白血漿中,按照1.4項下方法操作,制成標準曲線血漿樣品,測定各成分的含量,每種濃度制備三個樣品。標準方程由分析物濃度與內標物濃度之比(X)和相應的峰面積比(Y)構成。采用加權最小二乘法(1/χ2)得到各化合物及其峰面積的標準回歸方程。結果如表2所示,8種成分的r值均在0.9971~0.9988之間,表明所有化合物在相應范圍內有良好的線性關系。

表2 8種化合物的線性回歸方程r、線性范圍LLOD和LLOQ(n=3)
2.3 精密度和準確度
取大鼠空白血漿100 μL,加入3種質量濃度的混合對照品溶液20 μL(高濃度為1 000 μg/mL;中濃度為200 μg/mL;低濃度為50 μg/mL)制備質控樣品,每種濃度平行制備5個樣品,按照1.8項下方法處理后,按照1.4項檢測條件進行 UPLC-MS/MS 分析,連續測定3天,分別計算精密度和準確度。結果如表3所示,8種成分的精密度均小于15%,8種成分的準確度均在±15 %以內,這表明該方法具有良好的可靠性和重復性。

表3 8種化合物的精密度和準確度(n=5)
2.4 穩定性
取大鼠空白血漿100 μL,加入3種質量濃度的混合對照品溶液(高:1 000 μg/mL;中:200 μg/mL;低:50 μg/mL)制備質控樣品,按照1.8項下方法處理后,對不同儲存環境下的樣品(凍融循環3次;樣品在-80℃下保存15天;樣品在25℃的室溫下放置24小時)按照1.4項下檢測條件進行 UPLC-MS/MS 分析,每種環境平行制備5個樣品。結果如表4所示,8種成分的RSD均小于15%,表明血漿樣品在不同環境中是穩定的。

表4 8種化合物的穩定性考察(n=5)
2.5 提取回收率和基質效應
取大鼠空白血漿100 μL,加入3種質量濃度的混合對照品溶液20 μL(高:1 000 μg/mL;中:200 μg/mL;低:50 μg/mL)制備質控樣品,按照1.8項下方法處理后,按照1.4項檢測條件進行 UPLC-MS/MS 分析,記錄各成分峰面積與內標峰面積的比值(A);取大鼠空白血漿100 μL,按照1.8項下方法處理后加入質控樣品,進樣分析,記錄各成分峰面積與內標峰面積的比值(B);取上述高、中、低3個質量濃度的混合對照品溶液,進行分析,記錄峰面積與內標峰面積的比值(C);每種質量濃度平行制備5個樣品。提取回收率=A/B×100%,基質效應=B/C×100%。結果如表5所示,8種成分的提取物回收率在73.7%到95.0%之間,這表明在處理血漿樣品以沉淀蛋白質的過程中,分析物沒有顯著損失。8種成分的基質效應范圍為71.7%~130.5%,表明無明顯基質干擾。

表5 8種化合物的提取回收率及基質效應
2.6 藥代動力學
大鼠灌胃給藥4種杜仲制劑后,采用UPLC-MS/MS分析不同采樣點的血藥濃度,以時間為橫坐標(x),血藥濃度為縱坐標(y)作圖。通過Phoenix Winnonlin 8.1軟件進行非房室模型分析,計算血藥濃度—時間曲線下面積(AUC0-∞),半衰期(t1/2z)、達峰時(Tmax)、最大血藥濃度(Cmax)、表觀分布容積(Vz/F)、清除率(CLz/F)、平均駐留時間(MRT0-∞)等藥代動力學參數,結果見表6、表7。
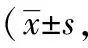
表6 口服杜仲制劑后化合物的AUC0-∞、t1/2z、Tmax和Cmax參數比較鼠只=6)
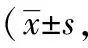
表7 口服杜仲制劑后化合物的Vz/FCl2/F和MRT0-∞參數鼠只=6)
3 討論
杜仲包含多種活性成分,其中木脂素類成分最豐富。例如在《中華人民共和國藥典》(2020年版)中,松脂醇二葡萄糖苷是杜仲質量控制的指標性成分,在調節高血壓、炎癥、氧化應激方面發揮著關鍵作用[10]。松脂醇葡萄糖苷在成骨細胞分化和基質礦化中具有生物學作用,這表明它可能在骨質疏松癥和牙周炎等骨病中具有合成代謝作用[11]。據報道,京尼平苷和京尼平苷酸具有抗氧化和抗凋亡活性,是修復DEP誘導的皮膚損傷的潛在候選藥物[12]。原兒茶酸可通過抗氧化和抗炎活性在腦和肝臟中發揮保護作用,其潛在機制可能是通過調節NF-κB/COX-2途徑[13]。Zang H等[14]人通過順鉑誘導的AKI小鼠和人類腎臟-2細胞模型,發現無梗五加苷B是治療AKI的潛在藥物。綠原酸可劑量依賴性地抑制人肝癌細胞Hep-G2和Huh-7的活性,但不影響正常人肝細胞QSG-7701的活性和生長[15]。由于相鄰羥基和分子內雙鍵的結構,咖啡酸具有良好的抗氧化活性[16]。因此,本研究選擇原兒茶酸、京尼平苷酸、松脂醇二葡萄糖苷、無梗五加苷B、松脂醇葡萄糖苷、京尼平苷、綠原酸和咖啡酸作為杜仲的指標成分進行藥代動力學研究。
為了在較短時間內實現最佳的分離和獲得良好的峰形,對流動相進行了考察。在本研究中,分別測試了甲醇、乙腈和水中不同比例的酸和鹽。最后,選擇0.1%甲酸水溶液(溶劑A)和0.1%甲酸乙腈溶液(溶劑B)作為流動相。
本研究采用液液萃取的方法處理血漿樣品,采用UPLC-MS/MS進行測定,結果表明該方法具有良好的專屬性、線性、精密度、準確度、提取回收率、基質效應、穩定性。杜仲補肝腎藥效明確,采用該方法研究杜仲及其制劑中的8種成分在大鼠體內的藥代動力學,對于進一步揭示不同杜仲制劑的藥效物質基礎研究具有重要意義。由于非房室模型限制條件少,適合于大部分藥物,因此本研究采用非房室模型估算藥代動力學參數。結果顯示,不同杜仲制劑中的成分在大鼠體內藥代動力學特征不同。根據血藥濃度—時間曲線下面積(AUC0-∞)可得出,杜仲顆粒中的原兒茶酸、無梗五加苷B、綠原酸、咖啡酸四種成分在大鼠體內暴露高于其他劑型,全杜仲膠囊中的京尼平苷酸、松脂醇二葡萄糖苷、松脂醇葡萄糖苷、京尼平苷四種成分在大鼠體內的成分高于其他劑型。根據達峰時間(Tmax)可得出,杜仲飲片中的原兒茶酸、京尼平苷酸、咖啡酸三種成分在大鼠體內的吸收快于其他劑型,杜仲顆粒中的松脂醇二葡萄糖苷、無梗五加苷B、綠原酸三種成分在大鼠體內的吸收快于其他劑型,杜仲配方顆粒中的京尼平苷在大鼠體內的吸收快于其他劑型。通過口服給藥后,8種成分在不同劑型中的表觀分布容積(Vz/F)和清除率(Clz/F)差異較大,說明在體內的過程不一致。根據不同制劑的藥代動力學參數來看,8種成分在AUC0-∞、t1/2z、Tmax、Cmax、Vz/F、Clz/F、MRT0-∞方面均不相同,這表明同一藥物的不同劑型,它們的釋藥速度、起效快慢及作用強度均不相同。
綜上所述,本研究基于UPLC-MS/MS法的多反應監測模式,建立同時測定原兒茶酸、京尼平苷酸、松脂醇二葡萄糖苷、無梗五加苷B、松脂醇葡萄糖苷、京尼平苷、綠原酸、咖啡酸8種成分的分析方法,并用該方法分析杜仲及其制劑在大鼠中的藥代動力學,對杜仲制劑在臨床應用上具有重要指導意義。

