升降散體外抗流感病毒A/PR8/34/H1N1株的作用研究*
郭雨菲 于會勇 秦欣欣 劉國星 劉 暢李 磊 聶天旸 劉蓮蓮 翟志光 王成祥△
(1.北京中醫藥大學,北京 100029;2.北京中醫藥大學第三附屬醫院,北京 100029;3.北京市隆福醫院,北京 100010;4.臨渭劉尊基中醫診所,陜西 臨渭 714000;5.北京市鼓樓中醫醫院,北京 100009;6.中國中醫科學院中醫基礎理論研究所,北京 100700)
甲型流感病毒(IAV)是引起急性肺損傷/急性呼吸窘迫綜合征(ALI/ARDS)的重要病原體,特別在免疫力下降的人群中具有起病急、進展快、死亡率高的特點,給全球帶來嚴重的醫療與經濟負擔。最新研究顯示流感病毒感染人數約占冬春季節所有急性呼吸道感染的三分之一[1]。據世界衛生組織(WHO)估計,每年有近10%的世界人口受到流感的侵襲,29~65萬人死于流感[2]。IAV 具有高變異性,易導致耐藥病毒株的出現、疫苗效力下降以及全球范圍的大流行,而抗流感病毒藥物研發的滯后、疫苗接種率低、藥物存在不良反應和受耐藥性影響等,使得抗流感治療仍然面臨嚴峻的挑戰[3-4]。
IAV 感染大多歸屬于中醫學“時行感冒”“溫病”“疫病”范疇[5]。升降散出自《傷寒瘟疫條辨》,由僵蠶、蟬蛻、姜黃、大黃4 味藥組成,具有升清降濁、清熱祛風之功效。“溫邪上受,首先犯肺”,邪熱內郁,肺氣不得清肅,氣機升降失常,因此絕大多數外感熱病是以熱郁不能透達為病機。升降散中以僵蠶為君,蟬蛻為臣,升浮宣透,透達郁熱,正合《黃帝內經》“火郁發之”之旨;用僵蠶、蟬蛻升清而入衛氣之分以開上焦,升陽中之清陽;姜黃、大黃降濁由氣而及營血,理氣血由中而達下焦,降陰中之濁陰,以達到氣機升降調和之功。現已有實驗研究表明升降散具有抗流感病毒作用,但其作用機制仍不明確。本研究從細胞的層面,體外觀察升降散干預流感病毒亞甲型鼠肺適應株(A/PR8/34/H1N1)所致細胞病變的影響,驗證升降散體外對IAV 的抑制作用,并進一步探索其抗病毒作用機制,為研發防治流感病毒感染的中藥新藥提供實驗基礎。
1 材料與方法
1.1 病毒及細胞株 病毒株:流感病毒亞甲型鼠肺適應株(A/PR8/34/H1N1,以下簡稱PR8),由中國病預防控制中心傳染病所饋贈,病毒經雞胚傳代后,紅細胞凝集實驗測得血凝滴度為1∶128。細胞株:狗腎細胞(MDCK),由中國病預防控制中心傳染病所饋贈。細胞用含有10%胎牛血清和1%雙抗的DMEM 培養基,在37 ℃,5%CO2培養箱中培養。
1.2 藥物 升降散顆粒劑:僵蠶6 g,蟬蛻3 g,大黃12 g,姜黃9 g。購自北京康仁堂藥業有限公司,采用水煮工藝提取有效成分,質量可控。磷酸奧司他韋膠囊(75 mg,國藥準字H20065415,批號0221901015,宜昌東陽光長江藥業股份有限公司)。藥物稀釋后經0.22 μm濾膜過濾除菌保存。
1.3 試劑與儀器 PBS 緩沖液(美國Gibco 公司,貨號20012043),DMEM 培養液(美國Gibco 公司,貨號11995065),青、鏈霉素母液(10 000 U/mL 青霉素G、10 000 μg/mL 硫酸鏈霉素,美國Gibco 公司,貨號15140122),HEPES(德國Sigma公司,貨號H4034-500 g),牛血清白蛋白組分V(7.5%溶液,美國Sigma 公司,貨號15260),胎牛血清(FBS,美國Gibco 公司,貨號10099141),EDTA 胰蛋白酶(0.05%胰酶,美國Gibco公司,貨號25300062),TPCK 胰酶(美國Sigma 公司,貨號T8802-50MG),二甲基亞砜(DMSO,美國Sigma 公司,貨號506008),Cell Counting Kit-8(CCK8,北京翱擎生物科技有限公司,貨號AQ308),TRIzol Reagent[天根生化科技(北京)有限公司,貨號DP424],逆轉錄試劑盒(德國DBI Bioscience 公司,貨號DBI-2220);熒光定量PCR 檢測試劑盒(美國GeneCopoeia 公司,貨號AOPR-1200)。超凈工作臺(北京東聯哈爾儀器制造有限公司,型號BCN-1360),CO2培養箱(美國NUAIRE 公司,型號NU-5510E),臺式高速冷凍離心機(德國Eppendorf公司,型號5810R),生物安全柜(Ⅱ級B2型,美國NUAIRE 公司,型號NU-425-600E),熒光定量PCR儀(美國ABI 公司,型號7500);微量核酸定量儀(美國Merinton公司,型號SMA4000)。
1.4 病毒滴度測定 用病毒生長液將流感病毒PR8原液稀釋成1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7各濃度梯度。將MDCK 細胞以1×105個/mL的密度接種至96 孔板上,100 μL/孔,在CO2培養箱中37 ℃、5% CO2孵育至細胞基本長滿單層,吸棄舊培養液,加入以上濃度梯度的病毒液,100 μL/孔,每個濃度梯度設置8 個復孔,并設置正常對照孔(只加入病毒生長液),在CO2培養箱中吸附2 h 后棄病毒液,PBS 溶液洗滌后每孔加入100 μL 細胞維持液,繼續于CO2培養箱中培養。在倒置顯微鏡下觀察細胞形態變化,同時記錄特征性細胞病變(CPE)的孔數。培養2 d 后,統計出現病變孔數,按Reed-Muench 公式計算病毒的半數細胞培養感染劑量(TCID50)。
1.5 藥物對細胞的毒性測定 升降散顆粒和磷酸奧司他韋用細胞維持液分別從50 mg/mL和4 mg/mL對半稀釋成6 個濃度梯度,加入長滿單層MDCK 細胞的96 孔板上,100 μL/孔,每個濃度梯度設置6 個復孔,并設置正常對照孔(只加入細胞維持液)。96孔板在CO2培養箱中37 ℃、5%CO2下孵育48 h 后,倒置顯微鏡下觀察CPE。吸棄孔內培養液后用PBS 緩沖液洗滌3 遍,在每孔中加入100 μL 細胞維持液和10 μL CCK8溶液,并設置空白對照組(不含細胞,只加入維持液和CCK8 溶液),繼續在CO2培養箱中培養1~4 h,在450 nm 波長處對每個孔的吸光度值(A 值)進行測定,計算細胞的存活率,計算公式:細胞存活率=(A藥物組-A空白組)÷(A正常組-A空白組)×100%。以90%以上細胞存活率的藥物最小稀釋倍數為藥物的最大無毒濃度(TC0);用Reed-Muench公式計算藥物的半數中毒濃度(TC50)。
1.6 升降散體外抗流感病毒PR8 的作用 升降散與磷酸奧司他韋稀釋至TC0,96 孔板上接種MDCK 細胞培養至長滿單層后,按照以下3 種不同給藥方式進行干預給藥。1)預防作用:在孔內加入藥物,100 μL/孔,每組設置6 個復孔,同時設置正常細胞對照組和病毒對照組,作用4 h 后吸棄并用PBS 緩沖液洗滌孔內藥液,將100TCID50流感病毒PR8 接種于細胞,100 μL/孔,正常細胞對照組加入病毒生長液,在CO2培養箱中37 ℃下吸附2 h 后吸棄并用PBS 緩沖液洗滌孔內病毒液,換細胞維持液繼續培養。2)直接作用:將100TCID50流感病毒PR8 和藥物混合,37℃下作用4 h,將混合液接種于MDCK細胞,100 μL/孔,每組設置6個復孔,正常細胞對照組加入細胞維持液與病毒生長液的等量混合液,病毒對照組只加入病毒液,在CO2培養箱中37 ℃下作用2 h 后吸棄并用PBS 緩沖液洗滌孔內液體,換細胞維持液繼續培養。3)治療作用:將100TCID50流感病毒PR8 接種于細胞,100 μL/孔,正常細胞對照組加入病毒生長液,在CO2培養箱中37℃下吸附2 h后吸棄并用PBS緩沖液洗滌孔內病毒液,在孔內加入藥物,100 μL/孔,每組設置6 個復孔,正常細胞對照組和病毒對照組加入細胞維持液,作用4 h后吸棄并用PBS 緩沖液洗滌孔內藥液,換細胞維持液繼續培養。按上述給藥方法,觀察并記錄各組CPE,待病毒對照組的CPE(++++)時,用CCK8 法測定并計算細胞存活率(測定和計算方法同1.5),并計算藥物對感染細胞的抗病毒有效率(ER)。計算公式:ER=(A藥物組-A病毒對照組)÷(A正常對照組-A病毒對照組)×100%。
1.7 流感病毒PR8 感染細胞Caspase-3、Caspase-8、Caspase-9 mRNA 升降散與磷酸奧司他韋稀釋至TC0,96 孔板上接種MDCK 細胞培養至長滿單層后,將100TCID50流感病毒PR8和藥物等量混合,37 ℃下作用4 h 后將混合液接種于MDCK 細胞,100 μL/孔,每組設置3 個復孔,空白(正常細胞對照)組加入細胞維持液與病毒生長液的等量混合液,病毒對照組只加入病毒液,在CO2培養箱中37 ℃下作用2 h 后吸棄并用PBS緩沖液洗滌孔內液體,換細胞維持液繼續培養,在藥物處理后的12、24、48 h 收集細胞,用Trizol 法提取各組細胞的總RNA。逆轉錄成cDNA,以cDNA 為模板,分別加入Caspase-3、Caspase-8、Caspase-9 引物進行擴增,見表1,引物均由北京利科麗生物科技有限公司設計與合成。PCR 反應為20 μL 體系,含cDNA 2 μL,2× All-in-One qPCR Mix 10 μL,上下游引物(2 μmol/L)各2 μL,50×Rox Reference Dye 0.4 μL,雙蒸水3.6 μL。反應條件:95℃10 min,95℃10 s,55℃20 s,共40 個循環,反應結束后分析熔解曲線。根據標準品反應后所得到的數值獲得標準曲線,采用2-ΔΔCt法計算目的基因mRNA 的相對表達量(QR):QR=2-ΔΔCt,ΔΔCt= (Ct待測樣本,目的基因-Ct待測樣本,內參基因) -(Ct對照樣本,目的基因-Ct對照樣本,內參基因)。

表1 actb、Caspase-3、Caspase-8、Caspase-9的引物序列
1.8 統計學處理 應用SPSS28.0 統計軟件。計量資料以(±s)表示,多組樣本間比較采用單因素方差分析,方差齊時,用LSD 進行多重比較,方差不齊采用非參數因子Kruskal-Wallis秩和檢驗。兩組間比較,滿足正態性采用t檢驗,不滿足正態性采用Mann-Whitney秩和檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 病毒滴度測定結果 培養48 h 后,倒置顯微鏡下可以觀察到隨著稀釋倍數的增加,細胞病變程度逐漸降低。統計細胞出現病變的孔數后,根據Reed-Muench 公式計算病毒的TCID50,得到TCID50=10-5.20。本實驗將采用100TCID50作為攻毒濃度。
2.2 藥物對細胞毒性測定結果 磷酸奧司他韋和升降散的濃度增加,對MDCK細胞產生的毒性隨之加重,鏡下表現為細胞形態變圓、皺縮,胞內顆粒增多,細胞粘連、破裂、脫落死亡等。根據CCK8 法測得磷酸奧司他韋和升降散的TC0分別為0.25、6.25 mg/mL,TC50分別為0.76、19.69 mg/mL,即確定0.25、6.25 mg/mL 分別為磷酸奧司他韋和升降散體外抗流感病毒作用的最高允許濃度。
2.3 升降散體外抗流感病毒PR8的作用 3種給藥方式下病毒對照組細胞明顯病變,細胞拉長、粘連,或細胞變圓、脫落,甚至碎裂、溶解等,而升降散組與磷酸奧司他韋組的CPE程度較輕,且吸光度值較高。CCK8法測得各組不同給藥方式下的細胞存活率和抗病毒有效率(ER)如表2、表3 所示。3 種給藥方式下升降散和磷酸奧司他韋組的細胞成活率均高于病毒對照組(P<0.05),升降散組的細胞存活率不如磷酸奧司他韋組,其中直接作用下,升降散的抗病毒有效率最高(ER=52.37%),而通過預防病毒侵入細胞來抗病毒的ER 較低,表明升降散具有一定的抗流感病毒PR8 株作用。后續實驗即以直接作用為給藥方式。

表2 各組不同給藥方式下細胞存活率比較(%)
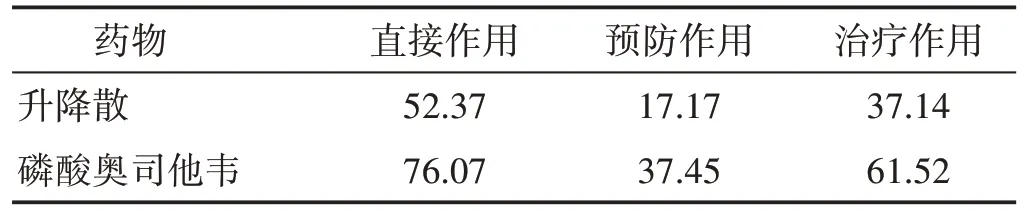
表3 不同給藥方式下藥物抗病毒有效率(%)
2.4 流感病毒PR8 感染細胞Caspase-3、Caspase-8、Caspase-9 mRNA 表達水平 見表4。與空白組相比,攻毒12、24、48 h 后,病毒對照組的Caspase-3、Caspase-8、Caspase-9基因mRNA均有顯著上調(P<0.05),且隨著時間的延長呈明顯上升趨勢。磷酸奧司他韋組MDCK 細胞在12、24、48 h 的Caspase-3、Caspase-8、Caspase-9 基因mRNA 表達明顯低于病毒對照組(P<0.01)。與病毒對照組相比,升降散組MDCK 細胞在12、24、48 h 的Caspase-3、Caspase-8、Caspase-9 基因mRNA 表達均被顯著下調,差異具有統計學意義(P<0.05或P<0.01)。
表4 各組細胞Caspase-3、Caspase-8、Caspase-9 mRNA相對表達比較(±s)

表4 各組細胞Caspase-3、Caspase-8、Caspase-9 mRNA相對表達比較(±s)
注:與空白組比較,*P <0.05。
組 別空白組(n=3)病毒對照組(n=3)磷酸奧司他韋組(n=3)升降散組(n=3)時間12 h 24 h 48 h 12 h 24 h 48 h 12 h 24 h 48 h 12 h 24 h 48 h Caspase-3 1.00±0.12 1.06±0.04 1.08±0.06 4.92±0.07*6.41±0.16*8.03±0.48*2.06±0.17△△3.24±0.40△△4.17±0.42△△2.94±0.10△△4.37±0.18△△5.34±0.96△△Caspase-8 1.00±0.04 1.17±0.16 1.08±0.07 5.14±0.58*6.71±0.44*7.76±0.59*1.75±0.15△△3.06±0.31△△4.73±0.92△△3.53±0.38△△4.25±0.78△△6.26±0.94△Caspase-9 1.00±0.06 1.06±0.08 1.09±0.21 4.99±0.71*6.57±1.02*9.30±1.09*2.92±0.25△△3.86±0.61△△4.98±0.40△△3.81±0.20△△5.09±0.46△7.25±0.32△
3 討 論
流感病毒是造成呼吸道疾病的常見病原體之一,其致病性強、易變異、傳播能力強,因此具有強危害性。病毒進入細胞后的增殖分為吸附、內吞、脫殼、生物合成、組裝和出芽6 個過程[6]。現代研究表明流感病毒的致病機制主要有誘導宿主細胞凋亡/自噬/焦亡、造成細胞氧化應激損傷和細胞因子風暴等學說。不同機制相互聯系、相互影響,形成復雜的網絡。目前研究已發現多種中藥(如黃芩[7]、板藍根[8]、無毒干蟾[9]等)和中藥復方(如麻黃湯[10]、連花清瘟顆粒[11]等)、中藥活性成分提取物(如黃芩苷[12]、荊芥揮發油[13]等)具有體內外抗流感病毒效果。由于流感病毒的變異性和耐藥性的增加,中藥抗病毒的多途徑、多靶點等優勢逐漸顯現。
本實驗研究設計3 種給藥方式,分別觀察升降散是否具有對病毒的直接作用、對病毒侵入細胞的預防作用和對病毒穿入細胞后的治療作用,從而探索藥物對病毒的直接滅活、阻止病毒吸附及抑制病毒進入細胞的生物合成等抗病毒作用。實驗結果表明,升降散在最大無毒濃度給藥時,3 種給藥方式下均能改善流感病毒PR8 誘導MDCK 細胞的細胞病變效應,提高細胞存活率,表明其具有體外抗流感病毒的作用。且實驗證明,升降散在最大無毒濃度給藥下,能夠通過直接滅活的方式抗流感病毒(ER>50%);升降散也能通過阻止病毒吸附及抑制病毒進入細胞的生物合成而抗流感病毒,但作用效果較低(ER<50%),結果表明其主要作用方式可能是對病毒的直接滅活作用,對于阻止病毒吸附及抑制病毒進入細胞的生物合成作用相對較弱,因此后續實驗采用直接滅活的給藥方式對其作用機制進行了初步探索。
流感病毒侵入宿主細胞后,能夠誘導宿主細胞產生凋亡反應,屬于流感病毒致病機制之一。細胞凋亡受多因子網絡的調控,有許多蛋白和細胞因子參與作用,如半胱天冬氨酸酶家族(Caspase)、Bcl-2 家族蛋白、Fas/FasL 等。細胞凋亡有多種途徑,最主要的3 個途徑是內源性途徑(線粒體途徑),外源性途徑(死亡受體途徑)和內質網途徑[14]。線粒體介導的凋亡是通過線粒體膜透化促使細胞色素C 的釋放,最終導致Caspase-9的激活以及下游的執行蛋白酶活化導致細胞凋亡,并與Bcl-2 家族蛋白的調控關系密切[15]。細胞膜表面的死亡受體及相應配體結合,形成死亡誘導信號復合物并啟動Caspase-8,Caspase-8 會激活其他執行半胱天冬酶例如Caspase-3,使細胞發生凋亡[16]。可以說Caspase-8和Caspase-9分別介導凋亡的外源性途徑和內源性途徑[17-18],而Caspase-3 是兩條途徑共同的下游效應執行蛋白酶[19]。近些年的研究發現多種中藥及有效物可以影響流感病毒感染細胞的Caspase家族蛋白的表達,從而抑制病毒誘導的細胞凋亡。盧春化等[20]用黃芪多糖干預甲型流感病毒小鼠肺炎模型,發現中藥活性成分能下調凋亡相關蛋白Caspase-3、Caspase-8、Caspase-9的表達,從而發揮抗細胞凋亡及保護肺組織的作用。劉曉婷[21]實驗研究發現黃芩苷組的Caspase-3、Caspase-8 的mRNA 表達較模型組均明顯降低,對病毒感染誘導的細胞凋亡有干預作用。鄧東沅等[22]實驗發現在體外環境下,木樨草能夠降低Caspase 相關家族蛋白的表達從而干預流感病毒H1N1感染細胞的凋亡。本實驗應用熒光定量RT-PCR 方法,檢測流感病毒PR8 感染細胞中凋亡信號轉導通路相關mRNA 的表達,研究發現,模型組Caspase-3、Caspase-8、Caspase-9 表達水平較空白組均顯著上升,表明病毒感染后確實會通過多途徑誘導宿主細胞凋亡引起細胞病變,且隨著感染時間的增加凋亡越發顯著,而升降散以最大無毒濃度給藥后12、24、48 h均可顯著下調細胞內Caspase-3、Caspase-8、Caspase-9的mRNA表達水平,表明其可通過外源性和內源性兩個途徑抑制病毒感染后宿主細胞凋亡;其中12 h 的差異性較24、48 h更明顯,提示中藥的藥效在感染早期效果更明顯,可用于流感的早期治療。
綜上所述,升降散具有一定的體外抗流感病毒作用,且能通過調控凋亡相關Caspase家族蛋白的基因表達,從而抑制流感病毒感染誘導的細胞凋亡。由于流感病毒干預機體的作用機制和涉及的基因調控網絡非常復雜,而中藥具有多靶點、多途徑的作用特點,因此升降散對流感病毒感染的干預作用機制有待深入的實驗研究。

