補(bǔ)體系統(tǒng)參與病理性疼痛的機(jī)制研究進(jìn)展*
駱 延, 梁 璇, 慕靜然, 徐 陶, 曾俊偉
(遵義醫(yī)科大學(xué)生理學(xué)教研室,貴州 遵義 563000)
慢性病理性疼痛是由于軀體感覺(jué)系統(tǒng)或者組織損傷而導(dǎo)致的疼痛,在臨床上很常見(jiàn),給患者的身心健康帶來(lái)很大危害。其治療方法涵蓋了藥物治療、經(jīng)皮神經(jīng)電刺激、運(yùn)動(dòng)及心理治療以及介入治療等方法。然而,這些治療方法也存在一些缺陷,如療效欠佳、藥物耐受、患者接受度不高等。近年研究表明,在補(bǔ)體(complement, C)系統(tǒng),補(bǔ)體成分及相應(yīng)受體的生成與活化不僅參與了一些神經(jīng)系統(tǒng)退行性疾病如帕金森病和阿爾茨海默病的發(fā)生,也參與了病理性疼痛的發(fā)生與維持[1]。機(jī)體在接受來(lái)自外界的傷害性刺激或者來(lái)源于機(jī)體內(nèi)環(huán)境中的傷害性刺激之后,感覺(jué)傳導(dǎo)通路的多個(gè)關(guān)鍵位點(diǎn)如背根神經(jīng)節(jié)(dorsal root ganglion, DRG)、脊髓背角、杏仁核、大腦皮層等區(qū)域均檢測(cè)到多種補(bǔ)體成分、及補(bǔ)體受體的表達(dá)異常。因此,有關(guān)補(bǔ)體系統(tǒng)參與病理性疼痛的發(fā)生與維持的分子機(jī)制研究受到廣泛關(guān)注。本文就這方面的新近研究進(jìn)展作一綜述,希望能夠?yàn)檠邪l(fā)新藥用于臨床鎮(zhèn)痛治療提供參考資料。
1 補(bǔ)體系統(tǒng)簡(jiǎn)介
補(bǔ)體系統(tǒng)在非特異性免疫中占有重要地位,主要包括補(bǔ)體固有成分、補(bǔ)體調(diào)節(jié)蛋白及補(bǔ)體受體,廣泛參與機(jī)體免疫和炎癥反應(yīng)。補(bǔ)體固有成分包括C1~C9,甘露糖結(jié)合凝集素(mannose-binding lectin,MBL)及B因子、D因子等;補(bǔ)體調(diào)節(jié)蛋白一般表現(xiàn)為可溶性或膜結(jié)合形式,參與調(diào)控補(bǔ)體活化和后續(xù)效應(yīng)的產(chǎn)生,主要有H因子、I因子、C1抑制因子(C1 inhibitor, C1INH)、C4b結(jié)合蛋白(C4b-binding protein,C4BP)、衰 變 加 速 因 子(decay-accelerating factor,DAF;即CD55)、膜輔因子蛋白(membrane cofactor protein, MCP;即CD46)、CD59等;補(bǔ)體受體分布在細(xì)胞膜表面,與補(bǔ)體活化過(guò)程中產(chǎn)生的活性片段結(jié)合,介導(dǎo)后續(xù)效應(yīng),主要包括補(bǔ)體受體1-5(complement receptor 1-5, CR1-5),補(bǔ)體成分1q受體(complement component 1q receptor, C1qR)、補(bǔ)體成分3a受體(complement component 3a receptor, C3aR)、補(bǔ)體成分5a受體(complement component 5a receptor,C5aR)等。補(bǔ)體激活主要有經(jīng)典激活途徑、凝集素途徑和替代途徑[2]。這三條途徑激活后形成的C3轉(zhuǎn)化酶可將C3裂解為C3a和C3b,導(dǎo)致進(jìn)一步的C5轉(zhuǎn)化酶激活,但也存在不依賴C3激活的C5轉(zhuǎn)化酶形成,隨后C5b與C6-9形成膜攻擊復(fù)合物(membrane attack complex, MAC),MAC形成穿膜的親水性通道,破壞局部磷脂雙層結(jié)構(gòu),導(dǎo)致細(xì)胞裂解[3]。在補(bǔ)體活化過(guò)程中產(chǎn)生的多種裂解片段,可結(jié)合細(xì)胞膜相應(yīng)受體而介導(dǎo)調(diào)理作用、免疫黏附作用、炎癥介導(dǎo)作用、趨化作用等。近年研究表明,補(bǔ)體系統(tǒng)的激活參與了病理性疼痛的發(fā)生發(fā)展(圖1)。
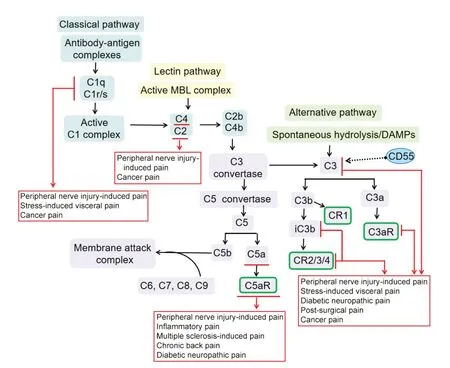
Figure 1.The associatation between the complement cascade and chronic pain.MBL: mannose-binding lectin;DAMPs: damage-associated molecular patterns.圖1 補(bǔ)體級(jí)聯(lián)反應(yīng)與慢性病理性疼痛的關(guān)系
2 補(bǔ)體系統(tǒng)參與病理性疼痛的臨床分析
在動(dòng)物和人體的血液或組織液中存在多種補(bǔ)體固有成分,在正常情況下補(bǔ)體成分含量穩(wěn)定,但在病理情況下有可能發(fā)生波動(dòng)。近年研究觀察到,在組織損傷導(dǎo)致的病理性疼痛患者,其外周血或組織液中補(bǔ)體成分含量異常,特別是補(bǔ)體激活片段明顯增加,這提示補(bǔ)體系統(tǒng)的激活可能與病理性疼痛的發(fā)生與維持有關(guān)。與正常孩童相比,急性腦創(chuàng)傷導(dǎo)致頭痛的患兒唾液標(biāo)本中,補(bǔ)體成分C1qa、C1qb、C1S、C3和C4a含量增加,補(bǔ)體調(diào)節(jié)因子CD55、CFB和C-反應(yīng)蛋白(C-reactive protein, CRP)也隨之同步增加;在慢性性腦創(chuàng)傷導(dǎo)致頭痛的患兒,其唾液標(biāo)本中C1qa、C5、C8b和CD55含量增加[4]。在纖維肌痛患者的腦脊液標(biāo)本檢測(cè)到補(bǔ)體成分C4a含量增加,推測(cè)C4a參與疼痛可能是由于C4a與蛋白酶激活受體1(protease-activated receptor, PAR1)和PAR4結(jié)合導(dǎo)致這兩種受體激活所致[5]。在類風(fēng)濕性關(guān)節(jié)炎疼痛患者,其外周血紅細(xì)胞表面補(bǔ)體受體CR1和CD59表達(dá)顯著降低,其中,CR1表達(dá)下降導(dǎo)致免疫復(fù)合物不能及時(shí)被清除,CD59表達(dá)下降則不能阻礙MAC的組裝,這均促進(jìn)了補(bǔ)體系統(tǒng)的激活,給予藥物治療提高紅細(xì)胞表面補(bǔ)體受體1(complement receptor 1, CR1)和CD59表達(dá),則關(guān)節(jié)痛減輕[6]。
隨后的一些研究報(bào)道進(jìn)一步提示,補(bǔ)體系統(tǒng)的激活可能在病理性疼痛的發(fā)生及維持過(guò)程中起重要作用。給予高烏甲素或曲馬多可明顯緩解直腸癌術(shù)后患者的痛覺(jué)感受癥狀,其視覺(jué)模擬量表VAS評(píng)分(用于評(píng)估痛覺(jué)感受)顯著降低,同時(shí)檢測(cè)到外周血C3和C4含量明顯上升,提示補(bǔ)體的激活裂解片段生成減少[7];與之相類似,神經(jīng)母細(xì)胞瘤患者給予抗GD2抗體ch14.18(可促進(jìn)補(bǔ)體激活)治療后最常見(jiàn)的副作用就是疼痛感受增強(qiáng),此時(shí)患者血清補(bǔ)體成分C3和C4含量下降,但給予另一種可以抑制補(bǔ)體激活的抗GD2抗體Hu14.18K322A進(jìn)行治療后患者痛覺(jué)感受減輕,血清C3和C4含量升高,對(duì)嗎啡的需要量明顯減少,也說(shuō)明補(bǔ)體的激活以及裂解片段生成減少有助于患者痛覺(jué)感受的減輕[8]。陣發(fā)性睡眠性血紅蛋白尿癥患者表現(xiàn)出腹痛癥狀,而在給予依庫(kù)珠單抗(eculizumab;靶向末端補(bǔ)體蛋白C5的人源化單克隆抗體)治療后,腹痛癥狀完全緩解[9]。
3 補(bǔ)體系統(tǒng)參與病理性疼痛的分子機(jī)制
近年通過(guò)形態(tài)學(xué)及分子生物學(xué)技術(shù)證實(shí),神經(jīng)系統(tǒng)中的神經(jīng)元、少突膠質(zhì)細(xì)胞、小膠質(zhì)細(xì)胞和星形膠質(zhì)細(xì)胞都能合成補(bǔ)體成分[10]。在多種病理性疼痛動(dòng)物模型,觀察到感覺(jué)傳導(dǎo)通路的多個(gè)節(jié)點(diǎn)上補(bǔ)體系統(tǒng)成分表達(dá)異常,采取相應(yīng)干預(yù)措施下調(diào)補(bǔ)體激活,抑制補(bǔ)體激活片段則具有鎮(zhèn)痛效應(yīng),這提示補(bǔ)體系統(tǒng)激活對(duì)神經(jīng)病理性疼痛的產(chǎn)生和維持起著至關(guān)重要的作用。近年該領(lǐng)域分子機(jī)制的研究進(jìn)展如下。
3.1 補(bǔ)體系統(tǒng)參與病理性疼痛的外周機(jī)制 DRG神經(jīng)元能接受外部傷害性信息,并傳達(dá)到脊髓背角。在炎性痛以及神經(jīng)痛動(dòng)物模型中,可見(jiàn)皮膚損傷區(qū)域或DRG組織補(bǔ)體成分表達(dá)上升,如:足底切口疼痛小鼠,切口處皮膚C5的mRNA表達(dá)水平上升[11];足底注射C3a和(或)C5a的炎性痛小鼠,DRG分布的C5aR表達(dá)上升[12];注射酵母聚糖-不完全弗氏佐劑到大鼠L5/S1椎間孔以誘發(fā)DRG神經(jīng)炎癥,檢測(cè)到DRG補(bǔ)體級(jí)聯(lián)反應(yīng)激活,經(jīng)典補(bǔ)體激活途徑的始動(dòng)分子C1q和C3表達(dá)增多[13];坐骨神經(jīng)慢性壓迫(chronic constriction injury, CCI)疼痛大鼠的DRG持續(xù) 高 表 達(dá)C1q[14-15];在 脊 神 經(jīng) 結(jié) 扎 大 鼠 的DRG,C1qα、C1qαβ、C1qαγ、C1r、C1s、C2、C3、C4和C7等多種補(bǔ)體成分,B、D、H和P因子,以及補(bǔ)體受體CR3表達(dá)上調(diào),但補(bǔ)體抑制物DAF表達(dá)卻明顯下調(diào)[16-17];在多發(fā)性硬化小鼠,表現(xiàn)出痛覺(jué)感受,其DRG有大量C5aR1陽(yáng)性的免疫細(xì)胞[18]。在皮膚損傷處注射C5aR拮抗劑PMX53或腹腔注射補(bǔ)體活性抑制劑眼鏡蛇毒因子CVF分別可以緩解實(shí)驗(yàn)動(dòng)物的炎性痛或神經(jīng)痛癥狀,下調(diào)DRG補(bǔ)體成分C5的表達(dá)和裂解,并抑制C5aR的表達(dá)或抑制C3的表達(dá)[11]。
從這些研究結(jié)果來(lái)看,外周神經(jīng)系統(tǒng)的補(bǔ)體系統(tǒng)激活參與了病理性疼痛的發(fā)生與維持,主要有以下3個(gè)相關(guān)機(jī)制。
3.1.1 補(bǔ)體激活促進(jìn)外周痛覺(jué)感受器的敏化 在小鼠足底切口痛模型,伴隨著補(bǔ)體成分C5表達(dá)和裂解增多,同時(shí)C類纖維對(duì)熱刺激的反應(yīng)增強(qiáng)[11];在小鼠爪部注射C3a和(或)C5a引出機(jī)械痛或熱痛敏行為,A類或C類傳入纖維動(dòng)作電位閾值降低,動(dòng)作電位發(fā)放頻率增加;這種現(xiàn)象與巨噬細(xì)胞釋放NGF和C類纖維末梢釋放降鈣素基因相關(guān)肽(calcitonin gene-related peptide, CGRP)增多有關(guān)[19-20]。在離體實(shí)驗(yàn)也證明,C3a和C5a不僅刺激培養(yǎng)的DRG神經(jīng)元胞內(nèi)鈣動(dòng)員,更促進(jìn)了辣椒素受體——瞬時(shí)受體電位陽(yáng)離子通道亞家族V成員1(transient receptor potential subfamily V member 1, TRPV1)誘發(fā)的DRG神經(jīng)元胞內(nèi)鈣動(dòng)員[12];神經(jīng)生長(zhǎng)因子(nerve growth factor, NGF)更進(jìn)一步促進(jìn)TRPV1介導(dǎo)的內(nèi)向電流幅度增加,而CGRP可以促進(jìn)DGR神經(jīng)元河豚毒素不敏感型的電壓門控的Na+內(nèi)流,引起DRG神經(jīng)元的興奮與敏感程度增加。
3.1.2 補(bǔ)體激活促進(jìn)免疫細(xì)胞活動(dòng)增強(qiáng) 補(bǔ)體系統(tǒng)的激活被認(rèn)為是慢性疼痛神經(jīng)免疫機(jī)制中的重要環(huán)節(jié)[21]。機(jī)體受到外界傷害性刺激之后,隨著補(bǔ)體級(jí)聯(lián)反應(yīng)發(fā)生,損傷局部區(qū)域的B細(xì)胞、中性粒細(xì)胞和巨噬細(xì)胞等遷移至損傷區(qū)域,釋放致痛物質(zhì)如趨化因子(C-C基序)配體2[chemokine(C-C motif) ligand 2, CCL2]、三磷酸腺苷(adenosine triphosphate,ATP)、腫瘤壞死因子α(tumor necrosis factor-α, TNFα)、前列腺素E2(prostaglandin E2, PGE2)、白細(xì)胞介素1β(interlenkin-1β, IL-1β)等,參與了痛覺(jué)敏化的維持[22]。如C5aR1基因敲除可以明顯緩解類風(fēng)濕性關(guān)節(jié)炎小鼠的疼痛癥狀,減輕關(guān)節(jié)滑液中性粒細(xì)胞浸潤(rùn)和滑膜組織巨噬細(xì)胞聚集,TNF-α和細(xì)胞間黏附分子1(intercellular adhesion molecule-1, ICAM-1)分泌相應(yīng)減少[22-23];同樣,給予C3激活抑制物Efb-C可以減輕免疫細(xì)胞的激活,減輕強(qiáng)直性脊柱炎小鼠的痛行為[24]。
3.1.3 補(bǔ)體激活參與調(diào)節(jié)神經(jīng)損傷后的軸突再生 在外周神經(jīng)損傷后,損傷區(qū)域的C1q和C3a可以減輕髓鞘相關(guān)糖蛋白對(duì)DRG神經(jīng)元軸突生長(zhǎng)的抑制作用,但C3b卻導(dǎo)致DRG神經(jīng)元活力下降,軸突生長(zhǎng)被抑制,由此可見(jiàn)補(bǔ)體的激活對(duì)于軸突損傷后的修復(fù)更像一把雙刃劍。當(dāng)外周神經(jīng)損傷后,DRG神經(jīng)元DAF表達(dá)下降,實(shí)驗(yàn)動(dòng)物表現(xiàn)出痛行為,當(dāng)神經(jīng)損傷恢復(fù)之后,DAF表達(dá)上升[25-26],痛行為減輕。可見(jiàn),補(bǔ)體活化與軸突損傷以及相應(yīng)的痛行為發(fā)展密切相關(guān)。
3.2 補(bǔ)體系統(tǒng)參與病理性疼痛的中樞機(jī)制 痛覺(jué)作為感覺(jué)的一種,由于組織損傷或神經(jīng)系統(tǒng)病變形成的傳入沖動(dòng)進(jìn)入中樞神經(jīng)系統(tǒng),首先到達(dá)脊髓,與脊髓淺層分布的中間神經(jīng)元、上行投射神經(jīng)元以及腦干下行纖維之間組成局部網(wǎng)絡(luò),這導(dǎo)致脊髓水平的痛覺(jué)敏化;隨后傷害性信息繼續(xù)上行,到達(dá)脊髓上結(jié)構(gòu)(supraspinal structures),包括丘腦、下丘腦、海馬、杏仁核、扣帶回、感覺(jué)及運(yùn)動(dòng)皮層等部位,參與痛覺(jué)信息的整合。因此,有關(guān)補(bǔ)體系統(tǒng)參與病理性疼痛的相關(guān)機(jī)制按照脊髓以及脊髓上結(jié)構(gòu)兩部分進(jìn)行闡述。
3.2.1 脊髓 脊髓背角是疼痛信息整合的重要部位,接收來(lái)自DRG輸入的傷害性信息。對(duì)CCI、脊神經(jīng)結(jié)扎和坐骨神經(jīng)分支選擇性結(jié)扎的疼痛大鼠的脊髓背角組織采用mRNA表達(dá)譜的微陣列分析及形態(tài)學(xué)技術(shù)顯示,C1qb、C1qg、C3和C4表達(dá)明顯上升,熒光雙標(biāo)觀察到C1q、C3、C4和C5aR表達(dá)于背角小膠質(zhì)細(xì)胞[27],但在皮膚肌肉切開(kāi)-牽拉痛以及足底注射完全弗氏佐劑的炎性痛小鼠也檢測(cè)到C3位于背角星形膠質(zhì)細(xì)胞[28-29];C5基因缺陷或鞘內(nèi)給予C5aR拮抗劑的坐骨神經(jīng)損傷(sciatic nerve injury, SNI)小鼠痛覺(jué)感受明顯減輕,但C6基因缺陷的SNI小鼠痛覺(jué)感受并沒(méi)有減輕,說(shuō)明補(bǔ)體裂解片段與相應(yīng)受體結(jié)合促進(jìn)了痛覺(jué)敏化,而補(bǔ)體反應(yīng)下游的MAC似乎并沒(méi)有參與痛覺(jué)敏化[27]。
目前認(rèn)為脊髓水平補(bǔ)體系統(tǒng)促進(jìn)痛覺(jué)敏化主要通過(guò)以下3個(gè)機(jī)制。
3.2.1.1 興奮性和抑制性突觸傳遞失衡 外周神經(jīng)損傷后,在脊髓背角,補(bǔ)體成分C1q增多,位于抑制性突觸的iC3b和淀粉樣前體樣蛋白2(amyloid precursor-like protein 2, APLP2)均可與小膠質(zhì)細(xì)胞的CR3結(jié)合,啟動(dòng)CR3/TREM2信號(hào)通路,溶酶體膜CD68表達(dá)上升提示小膠質(zhì)細(xì)胞溶酶體功能增強(qiáng),針對(duì)抑制性突觸進(jìn)行吞噬,導(dǎo)致抑制性突觸丟失近51%,興奮性突觸傳遞效能相對(duì)增強(qiáng),促進(jìn)慢性疼痛的維持[30-31];脊髓背角RhoA/ROCK通路激活促進(jìn)小膠質(zhì)細(xì)胞吞噬神經(jīng)元突觸碎片,參與神經(jīng)痛的維持[32]。另外,脊髓損傷導(dǎo)致大鼠神經(jīng)痛,其背角C1q、CR3和神經(jīng)元谷氨酸NMDA受體亞單位NR2B的表達(dá)同步上調(diào)[33],也支持傷害性刺激作用下,補(bǔ)體激活與脊髓背角興奮性突觸傳遞增強(qiáng)有關(guān)。
3.2.1.2 促進(jìn)膠質(zhì)細(xì)胞激活 在脊髓背角小膠質(zhì)細(xì)胞表達(dá)的補(bǔ)體受體CR3、C3aR1和C5aR,可以促進(jìn)小膠質(zhì)細(xì)胞活化,導(dǎo)致痛覺(jué)敏化。在糖尿病大鼠脊髓背角C3和CR3表達(dá)增多而補(bǔ)體調(diào)節(jié)蛋白CD55表達(dá)下降[34-35];鞘內(nèi)給予小膠質(zhì)細(xì)胞活性抑制劑米諾環(huán)素或補(bǔ)體抑制劑compstatin(以C3為靶點(diǎn))均明顯減輕癌痛大鼠的疼痛癥狀,抑制小膠質(zhì)細(xì)胞激活和CR3表達(dá),下調(diào)背角神經(jīng)元C1、C2和C3表達(dá),C3裂解產(chǎn)物iC3b減少[36];在SNI疼痛大鼠的脊髓背角小膠質(zhì)細(xì)胞C3aR1表達(dá)升高,C3aR1的激活導(dǎo)致小膠質(zhì)細(xì)胞鈣離子濃度升高,有助于促進(jìn)炎癥因子的釋放[37]。鞘內(nèi)注射C5a可以誘發(fā)大鼠冷痛覺(jué)過(guò)敏,后來(lái)證實(shí)該現(xiàn)象緣于C5a刺激小膠質(zhì)細(xì)胞分布的C5aR導(dǎo)致[38]。
3.2.1.3 影響背角神經(jīng)元功能 尾靜脈注射補(bǔ)體抑制物眼鏡蛇毒因子可明顯緩解CCI大鼠的痛行為,減輕神經(jīng)損傷導(dǎo)致的脊髓背角C3 mRNA表達(dá)上調(diào)、超氧化物歧化酶(superoxide dismutase, SOD)活性下降、丙二醛(malondialdehyde, MDA)含量增多、神經(jīng)元線粒體腫脹以及線粒體嵴碎裂等[26]。也有報(bào)道在椎間盤源性腰痛大鼠脊髓背角神經(jīng)元表達(dá)有C5aR[39],但尚不清楚C5aR激活對(duì)神經(jīng)元功能的調(diào)節(jié)作用。
3.2.2 脊髓上結(jié)構(gòu) 當(dāng)外界傷害性刺激持續(xù)作用下,脊髓水平以上包括腦干、間腦和大腦皮層,參與處理來(lái)自脊髓上行的疼痛信息并進(jìn)行整合,產(chǎn)生痛覺(jué)感受[40]。轉(zhuǎn)錄組學(xué)分析顯示,在海馬CA1區(qū)給予米諾環(huán)素可以減輕CCI大鼠疼痛癥狀,此時(shí)海馬補(bǔ)體級(jí)聯(lián)反應(yīng)激活也明顯被抑制[41]。在應(yīng)激導(dǎo)致的內(nèi)臟痛大鼠的中央杏仁核,補(bǔ)體成分C1q和C3增多,C3裂解為C3a和C3b,C3b降解為iC3b,與小膠質(zhì)細(xì)胞CR3結(jié)合,促進(jìn)小膠質(zhì)細(xì)胞激活,對(duì)興奮性突觸成分突觸后致密蛋白95(postsynaptic density protein 95, PSD95)進(jìn)行吞噬,導(dǎo)致局部突觸結(jié)構(gòu)重塑;在中央杏仁核給予米諾環(huán)素或CR3抑制劑NIF可明顯抑制小膠質(zhì)細(xì)胞的活化,降低小膠質(zhì)細(xì)胞對(duì)興奮性突觸進(jìn)行吞噬,進(jìn)而產(chǎn)生鎮(zhèn)痛效應(yīng),說(shuō)明杏仁核小膠質(zhì)細(xì)胞CR3信號(hào)通過(guò)吞噬興奮性突觸參與內(nèi)臟痛的發(fā)生和維持[42-44]。國(guó)內(nèi)研究還證實(shí),在基底外側(cè)杏仁核小膠質(zhì)細(xì)胞激活后吞噬突觸的能力增強(qiáng),導(dǎo)致癌痛大鼠的疼痛、焦慮及抑郁樣行為[45]。
與脊髓背角的情況相似,在炎性痛或神經(jīng)痛動(dòng)物模型,多個(gè)腦區(qū)如未定帶區(qū)域(丘腦網(wǎng)狀核旁的丘腦下核團(tuán),含較多GABA能抑制性神經(jīng)元)、前扣帶回皮層和感覺(jué)皮層的小膠質(zhì)細(xì)胞激活后對(duì)GABA能神經(jīng)元樹突棘成分進(jìn)行吞噬修剪,導(dǎo)致這些區(qū)域的抑制性突觸傳遞效能減退而興奮性突觸傳遞增強(qiáng),從而促進(jìn)了痛覺(jué)敏化的形成[46-48],但是否有補(bǔ)體機(jī)制的參與,還需要探討。
補(bǔ)體系統(tǒng)參與病理性疼痛分子機(jī)制的總結(jié)見(jiàn)表1。

表1 補(bǔ)體及其受體參與病理性疼痛發(fā)生和維持的機(jī)制Table 1.The mechanism of complement and their receptors in the occurrence and maintenance of pathological pain
4 補(bǔ)體系統(tǒng):鎮(zhèn)痛治療的潛在靶點(diǎn)
在臨床上,骨關(guān)節(jié)炎、類風(fēng)濕性關(guān)節(jié)炎、胰腺炎、燒傷以及手術(shù)創(chuàng)傷導(dǎo)致疼痛的患者,其關(guān)節(jié)滑液、外周血或損傷區(qū)域組織液中補(bǔ)體成分(如C3a、C5、C5a等)含量上升;在多種疼痛動(dòng)物模型的感覺(jué)傳導(dǎo)通路的多個(gè)位點(diǎn)補(bǔ)體成分及補(bǔ)體受體(CR3或C5aR)表達(dá)上升,而C3或C5基因敲除或者給予補(bǔ)體激活抑制物可以明顯減輕實(shí)驗(yàn)動(dòng)物的痛覺(jué)過(guò)敏癥狀。目前已經(jīng)在臨床上使用的以補(bǔ)體系統(tǒng)為靶點(diǎn)的藥物有C1酯酶抑制劑辛里澤(cinryze)、補(bǔ)體C3抑制劑pegcetacoplan(靶向近端補(bǔ)體蛋白C3的聚乙二醇化肽)、長(zhǎng)效C5補(bǔ)體抑制劑依庫(kù)珠單抗eculizumab和ravulizumab[22]。pegcetacoplan用于治療陣發(fā)性睡眠性血紅蛋白尿癥;辛里澤用于減輕血管性水腫;eculizumab用于神經(jīng)脊髓炎、全身性重癥肌無(wú)力以及陣發(fā)性睡眠性血紅蛋白尿癥的治療。這3種藥物均可減輕這些患者的疼痛癥狀,但這些藥物價(jià)格昂貴,且都存在一些不良反應(yīng)。因此,以補(bǔ)體系統(tǒng)為靶點(diǎn)研發(fā)價(jià)格合理且副作用小的新型鎮(zhèn)痛藥是有意義的。
正在臨床前實(shí)驗(yàn)或臨床試驗(yàn)階段的補(bǔ)體干預(yù)藥還有C5aR1抑制劑CCX168和PMX53有望用于減輕周圍神經(jīng)病變,發(fā)揮鎮(zhèn)痛效應(yīng)[49]。PMX53雖然在動(dòng)物疼痛模型展示了良好的鎮(zhèn)痛效應(yīng),但臨床試驗(yàn)的結(jié)果并不理想,缺點(diǎn)在于PMX53的口服吸收差、生物利用度低。另一種脂溶性的PMX53類似物PMX205由于口服吸收良好,可以透過(guò)血腦屏障,更有望在臨床實(shí)驗(yàn)中取得好的結(jié)果。
我國(guó)對(duì)中草藥的開(kāi)發(fā)與使用已有上千年時(shí)間,近年對(duì)天然產(chǎn)物的提取和優(yōu)化工藝水平顯著提升。相關(guān)研究表明,國(guó)內(nèi)在風(fēng)濕性多肌痛患者給予白芍總苷聯(lián)合雷公藤治療,外周血C3含量下降,疼痛癥狀明顯減輕[50];在動(dòng)物實(shí)驗(yàn)也觀察到芍藥苷可以抑制膠質(zhì)細(xì)胞激活以及后續(xù)的炎癥反應(yīng);此外,國(guó)內(nèi)研究報(bào)道,背根神經(jīng)節(jié)脈沖射頻可以緩解炎性痛大鼠脊髓背角小膠質(zhì)細(xì)胞CR3表達(dá),抑制小膠質(zhì)細(xì)胞和星形膠質(zhì)細(xì)胞激活,從而發(fā)揮鎮(zhèn)痛效應(yīng)[51],這提示除藥物治療之外,其他治療手段也有可能通過(guò)下調(diào)補(bǔ)體反應(yīng)發(fā)揮鎮(zhèn)痛效應(yīng)。

