沉默信息調(diào)節(jié)因子3通過調(diào)節(jié)線粒體功能障礙減輕特發(fā)性肺纖維化的研究進展*
楊樹森, 劉禹杉, 張儀霖, 惠 毅, 李京濤, 閆曙光,2△
(1陜西中醫(yī)藥大學(xué)基礎(chǔ)醫(yī)學(xué)院,陜西 咸陽 712046;2陜西省胃腸病證方藥重點研究室,陜西 咸陽 712046;3陜西中醫(yī)藥大學(xué)附屬醫(yī)院,陜西 咸陽 712000)
特發(fā)性肺纖維化(idiopathic pulmonary fibrosis,IPF)是一種以進行性肺瘢痕形成為主要特征慢性進行性肺部疾病[1]。IPF屬于典型且常見的纖維性間質(zhì)性肺病,其病理進程不可逆轉(zhuǎn),往往會進展為呼吸衰竭和死亡[2],確診后的平均預(yù)期壽命為3~5年[3]。抗纖維化藥物pirfenidone和nintedanib可以改善IPF患者的肺功能,但其療效不佳且副作用較大[4]。肺移植是目前延長IPF患者生存期最為有效的方法,但由于供體器官不足等因素限制了其推廣[5]。所以新的治療靶點及藥物亟待發(fā)現(xiàn)并應(yīng)用于臨床。
線粒體功能障礙是IPF的重要病理特征[6]。活性氧(reactive oxygen species, ROS)水平增加、線粒體DNA損傷和脂質(zhì)代謝異常等因素是線粒體功能障礙的相關(guān)誘因[7]。沉默信息調(diào)節(jié)因子3(silent information regulator 3, SIRT3)是一種組蛋白脫乙酰酶,它是線粒體獨有的脫乙酰酶,其通過去乙酰化線粒體內(nèi)生物功能相關(guān)蛋白來調(diào)節(jié)線粒體的諸多功能[8]。既往研究常聚焦于SIRT3在調(diào)節(jié)線粒體功能與延緩衰老的方面,近年來關(guān)于SIRT3減輕IPF的研究方興未艾,相關(guān)研究表明SIRT3可以通過修復(fù)線粒體DNA、穩(wěn)定ROS水平和調(diào)節(jié)線粒體脂質(zhì)代謝失調(diào)來緩解線粒體功能障礙,繼而減輕IPF[9]。本文將對IPF病理背景下SIRT3對線粒體功能障礙的調(diào)節(jié)作用進行綜述。
1 IPF中的線粒體功能障礙
1.1 先行條件:線粒體ROS異常 ROS是氧化代謝的副產(chǎn)物,線粒體是細胞內(nèi)ROS的主要來源[10]。內(nèi)源性ROS主要來自線粒體氧化磷酸化(oxidative phosphorylation, OXPHOS)過 程 中 的 電 子 傳 遞 鏈(electron transport chain, ETC)泄漏[11]。線粒體通過ETC進行OXPHOS,這在三磷酸腺苷(adenosine triphosphate, ATP)的合成中起著重要作用[12]。正常情況下,線粒體消耗氧氣并產(chǎn)生ATP和少量ROS,但IPF患者ATP的產(chǎn)生降低并伴隨ROS異常升高,這暗示了IPF患者的線粒體功能存在異常[13]。低水平的ROS可調(diào)節(jié)信號傳導(dǎo)等多種細胞反應(yīng)[14],但過量的ROS會破壞脂質(zhì)和DNA等細胞生物分子,誘發(fā)氧化應(yīng)激并導(dǎo)致細胞凋亡、衰老和基因突變,同時還會激活過量的炎癥介質(zhì),如腫瘤壞死因子α(tumor necrosis factor-α, TNF-α)、核因子κB(nuclear factor kappa-B, NF-κB)、核苷酸結(jié)合寡聚化結(jié)構(gòu)域樣受體蛋白3
(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)和轉(zhuǎn)錄因子激活蛋白1(activator protein-1, AP-1),盡管目前關(guān)于炎癥反應(yīng)在推動IPF進程中的關(guān)鍵地位存在爭議,但無法忽略的是,炎癥反應(yīng)普遍存在于IPF的病理進程中[15-16]。IPF中線粒體功能障礙也促進了細胞凋亡和衰老,有報告表明過量ROS顯著降低了IPF患者肺泡上皮細胞內(nèi)ETC復(fù)合體I和IV的活性,這會誘導(dǎo)細胞凋亡并推動IPF病理進程[17]。ROS會推動細胞衰老繼而誘發(fā)IPF,而衰老細胞中的線粒體會產(chǎn)生更多的ROS,這加劇了細胞內(nèi)氧化應(yīng)激水平并形成一個促IPF的惡性循環(huán)[18-19]。除了對線粒體本身的影響,ROS釋放到細胞質(zhì)會加速細胞內(nèi)氧化還原動態(tài)失衡并破壞細胞內(nèi)環(huán)境穩(wěn)態(tài)[20]。總之,ROS異常所誘發(fā)的諸多病理改變是線粒體功能障礙的先行條件,同時ROS所導(dǎo)致的氧化應(yīng)激程度會隨著IPF的進展而加重。
1.2 核心環(huán)節(jié):線粒體DNA損傷 線粒體有少量自己的DNA,每個線粒體包含一個或多個線粒體DNA拷貝,它們位于線粒體基質(zhì)中[21]。研究表明線粒體DNA受損推動了IPF病理進程[22]。線粒體DNA損傷常與氧化應(yīng)激時相伴而行,由于線粒體是體內(nèi)ROS的主產(chǎn)地,所以線粒體DNA對氧化損傷高度敏感[23]。堿基切除修復(fù)酶8-氧代鳥嘌呤DNA糖基化酶1(8-oxoguanine DNA glycosylase1, OGG1)在修復(fù)線粒體DNA損傷中起重要作用,由ROS所誘導(dǎo)的加合物 8-羥基-2′-脫氧鳥苷(8-oxo-7,8-dihydro-2'-deoxyguanosine, 8-oxo-dG)異常是導(dǎo)致線粒體DNA損傷的重要原因, OGG1通過特異性識別和切除8-oxo-dG來啟動堿基切除修復(fù)途徑。在IPF中OGG1存在功能異常,而相關(guān)研究也表明這會加速肺纖維化進程[24-25]。甲基化也是誘導(dǎo)線粒體DNA損傷的因素之一。線粒體DNA由環(huán)狀結(jié)構(gòu)組成,含有大量未甲基化的DNA,如CpG島。DNA甲基化是主要的表觀遺傳修飾形式,CpG島基因內(nèi)甲基化的發(fā)生會推動肺纖維化和其他纖維化疾病進程[26-27]。線粒體DNA損傷和突變會推動線粒體膜電位崩潰等線粒體功能的異常,這反過來又會加速ROS的產(chǎn)生并加重線粒體畸形和受損[28]。線粒體DNA損傷是導(dǎo)致線粒體功能障礙的核心環(huán)節(jié),線粒體內(nèi)遺傳信息及轉(zhuǎn)錄水平的異常改變對于線粒體的穩(wěn)態(tài)無疑是毀滅性打擊。
1.3 潛在因素:線粒體脂質(zhì)代謝異常 線粒體是脂質(zhì)代謝的關(guān)鍵細胞器[29]。IPF患者的脂質(zhì)組學(xué)研究顯示脂肪酸、膽固醇和其他脂質(zhì)的合成和活性發(fā)生改變[30]。磷脂和鞘脂是線粒體脂質(zhì)的主要組成部分,其代謝異常被認為是推進IPF病理進程的潛在因素[31-32]。在線粒體損傷過程中,肺表面活性物質(zhì)合成和肺泡動態(tài)平衡所需的膽固醇和磷脂產(chǎn)生減少,這與線粒體融合蛋白(mitofusin, Mfn)的異常相關(guān);Mfn是協(xié)調(diào)線粒體膜外融合的GTP酶,IPF中Mfn調(diào)節(jié)膽固醇與磷脂合成的功能異常會破壞上皮屏障完整性并推動纖維化過程[33-34]。有報告顯示,IPF患者肺中棕櫚酸(palmitic acid, PA)等飽和長鏈脂肪酸(longchain fatty acid, LCFA)水平較高,表明在IPF存在脂肪酸的異常積累[35]。存在于線粒體的β氧化是脂肪酸(fatty acid, FA)降解的主要途徑,在功能障礙的線粒體中這一降解過程被阻滯[36]。FA降解不足導(dǎo)致其在細胞與組織中異常堆積,F(xiàn)A的異常堆積和成分的變化可能與 IPF的病理進展有關(guān)[37]。線粒體功能異常也會影響脂質(zhì)代謝的相關(guān)因子,過氧化物酶體增殖物激活受體(peroxisome proliferator-activated receptor, PPARγ)是調(diào)節(jié)脂肪組織合成代謝的關(guān)鍵因子,其對線粒體的生物發(fā)生起著重要作用,同時PPARγ還能夠阻斷轉(zhuǎn)化生長因子β來延緩纖維化的進程,但相關(guān)研究表明IPF中PPARγ的表達被顯著抑制[38-39]。作為PPARγ的結(jié)合蛋白,PPARγ輔激活因子1α(PPARγ coactivator-1α, PGC-1α)可調(diào)節(jié)多種組織中的線粒體功能,研究表明其在調(diào)節(jié)脂質(zhì)代謝、減輕炎癥和激活抗氧化劑中起重要作用,但在功能障礙的線粒體中,PGC-1α的表達顯著降低[40-41]。線粒體脂質(zhì)代謝異常會導(dǎo)致組織中的能量耗竭和細胞信號的改變,這進一步加速了IPF的進程。
IPF中的線粒體功能障礙總結(jié)見圖1。
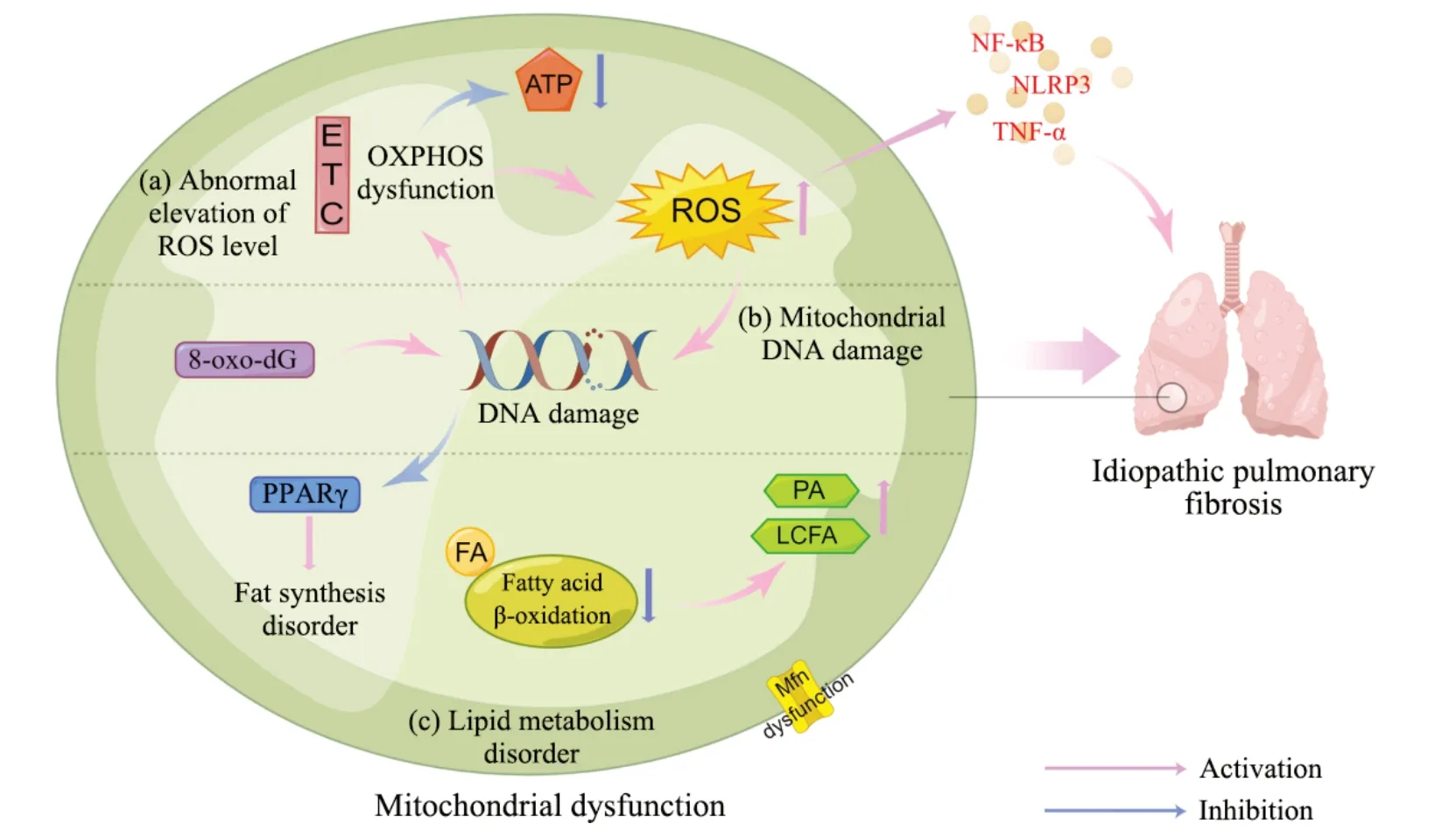
Figure 1.Mitochondrial dysfunction in idiopathic pulmonary fibrosis(created with Figdraw).ROS: reactive oxygen species;ETC:electron transport chain;OXPHOS: oxidative phosphorylation;ATP: adenosine triphosphate;8-oxo-dG: 8-oxo-7,8-dihydro-2'-deoxyguanosine;PPARγ: peroxisome proliferator-activated receptor γ;FA: fatty acid;PA: palmitic acid;LCFA:long-chain fatty acid;NF-κB: nuclear factor-κB;NLRP3: nucleotide-binding oligomerization domain-like receptor protein 3;TNF-α: tumor necrosis factor-α.圖1 特發(fā)性肺纖維化中的線粒體功能障礙
2 SIRT3對線粒體功能障礙的調(diào)節(jié)作用
2.1 SIRT3概述 在歸屬上,SIRT3是“長壽蛋白”sirtuins家族的一員,sirtuins是依賴煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)的一類脫乙酰酶,參與細胞代謝,調(diào)節(jié)包括DNA修復(fù)、炎癥反應(yīng),細胞周期或細胞凋亡等多種細胞功能[42]。在結(jié)構(gòu)上,SIRT3含有一個保守的具有兩個結(jié)構(gòu)域的酶核心,包括一個與NAD結(jié)合的大羅斯曼折疊結(jié)構(gòu)域和一個與鋅原子結(jié)合的大結(jié)構(gòu)域的兩個插入形成的小結(jié)構(gòu)域,乙酰化肽底物結(jié)合在兩個結(jié)構(gòu)域之間的縫隙上[43]。從人類遺傳學(xué)的角度來看,衰老和sirtuins家族之間最有力的聯(lián)系是SIRT3的多態(tài)性和長壽之間的關(guān)聯(lián),在sirtuins家族中目前只有SIRT3被報道可以影響人類壽命[44-45]。在分布上,SIRT3同SIRT4和SIRT5一樣都只存在于線粒體中[46]。在功能上,SIRT3已被證實參與線粒體代謝和體內(nèi)平衡的幾乎所有方面,可以保護線粒體免受各種損傷,其作為線粒體的主要去乙酰酶,在應(yīng)激和細胞代謝中發(fā)揮重要作用[47]。相關(guān)的研究表明SIRT3與多種疾病有關(guān),包括與年齡有關(guān)的疾病,心臟病、腫瘤和代謝疾病等一系列疾病[48]。SIRT3分布的特殊性決定了其與線粒體生理功能之間的關(guān)聯(lián)性,其減輕IPF也主要是通過恢復(fù)線粒體受損的功能來實現(xiàn)的,見圖2。

Figure 2.Mechanism of silent information regulator 3 (SIRT3) reversing mitochondrial dysfunction (created with Figdraw).ROS: reactive oxygen species;GSSG: oxidized glutathione;GSH: glutathione;NADPH: nicotinamide adenine dinucleotide phosphate;IDH2: isocitrate dehydrogenase 2;FOXO3a: forkhead box protein O3a;PPARγ: peroxisome proliferator-activated receptor γ;PGC-1α: PPARγ coactivator-1α;SOD2: superoxide dismutase 2;OGG1: 8-oxoguanine DNA glycosylase 1;8-oxo-dG: 8-oxo-7,8-dihydro-2'-deoxyguanosine;TFAM: mitochondrial transcription factor A;VLCAD: very-long-chain acyl-CoA dehydrogenase;LCAD: long-chain acyl-CoA dehydrogenase;MCAD: medium-chain acyl-CoA dehydrogenase;FA: fatty acid.圖2 SIRT3扭轉(zhuǎn)線粒體功能障礙的相關(guān)機制
2.2 SIRT3調(diào)節(jié)線粒體ROS水平 SIRT3主要通過激活體內(nèi)的抗氧化機制來清除多余的超氧化物。超氧化物歧化酶2(superoxide dismutase 2, SOD2)可以將超氧化物轉(zhuǎn)化為H2O2來清除線粒體內(nèi)多余的ROS[49]。研究表明SIRT3通過去乙酰化激活SOD2來控制超氧化物水平,從而保護細胞免受氧化應(yīng)激誘導(dǎo)的損傷[50]。此外,有報告表明線粒體SIRT3將叉頭框蛋白O3a(forkhead box protein O3a, FOXO3a)封存在細胞核中,這增加了Sod2轉(zhuǎn)錄,從而增強線粒體清除ROS的能力[51]。同樣遏制ROS的還包括PGC-1α,但PGC-1α主要通過激活ROS解毒酶來加速內(nèi)源性ROS的清理,研究表明SIRT3可以通過對FOXO3的去乙酰化來上調(diào)PGC-1α的表達來遏制氧化損傷[52-53]。作為重要的細胞抗氧化劑之一,GSH前體N-乙酰半胱氨酸也可以直接清除ROS[54]。還原型煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)是谷胱甘肽還原酶將氧化型谷胱甘肽(oxidized glutathione, GSSG)轉(zhuǎn)化為還原型谷胱甘肽(glutathione, GSH)所必需的,異檸檬酸脫氫酶2(isocitrate dehydrogenase 2, IDH2)是線粒體NADPH主要生產(chǎn)者[55-56]。研究表明SIRT3通過對IDH2去乙酰化來增加NADPH水平,這提高了GSH的水平[57]。SIRT3通過激活體內(nèi)多種抗氧化劑來提高抗氧化能力,改善線粒體生物發(fā)生,并通過維持線粒體形態(tài)和完整性來保護細胞免受氧化損傷。
2.3 SIRT3調(diào)節(jié)線粒體DNA損傷修復(fù) 線粒體DNA損傷部分上由氧化損傷所誘導(dǎo),所以激活ROS的清除機制是減少線粒體DNA損傷的重要手段,SIRT3所激活的抗氧化機制弱化了ROS對線粒體DNA的威脅。過量的ROS可將鳥嘌呤殘基氧化為8-oxo-dG,這些加合物加入線粒體DNA會導(dǎo)致DNA損傷[58]。堿基切除修復(fù)酶OGG1是DNA中8-oxo-dG的主要水解酶,研究表明SIRT3可以通過去乙酰化OGG1來修復(fù)線粒體DNA損傷[59]。線粒體轉(zhuǎn)錄因子A(mitochondrial transcription factor A, TFAM)是線粒體轉(zhuǎn)錄起始和線粒體DNA包裝中的關(guān)鍵因子,在病理條件下,TFAM的轉(zhuǎn)錄中斷會導(dǎo)致線粒體DNA的耗竭和線粒體生物能的不足[60-61]。研究表明SIRT3通過去乙酰化增加TFAM的表達來促進線粒體生物生成,這在一定程度上保證了線粒體DNA的穩(wěn)定[62]。除了調(diào)節(jié)線粒體DNA修復(fù)酶之外,SIRT3還可以調(diào)節(jié)抗氧化劑來保護DNA免受氧化損傷,研究顯示SOD2和OGG1的過度乙酰化會導(dǎo)致肺泡上皮細胞線粒體DNA損傷和凋亡,但SIRT3可以通過對SOD2和OGG1的去乙酰化逆轉(zhuǎn)這一進程[63]。因此,SIRT3主要通過調(diào)節(jié)修復(fù)線粒體DNA損傷相關(guān)酶和激活體內(nèi)的抗氧化系統(tǒng)來保護線粒體DNA的穩(wěn)定。
2.4 SIRT3調(diào)節(jié)線粒體脂質(zhì)代謝 SIRT3通過對線粒體中脂質(zhì)代謝相關(guān)酶的去乙酰化來發(fā)揮其代謝調(diào)節(jié)作用。研究表明SIRT3靶向如長鏈酰基輔酶A脫氫酶、中鏈酰基輔酶A脫氫酶和極長鏈酰基輔酶A脫氫酶等參與脂肪酸氧化的酶來清除累積的脂肪酸[64]。除了對線粒體酶去乙酰化之外,SIRT3還可以通過降解β-連環(huán)蛋白繼而激活其下游的PPARγ,這不僅可以維持線粒體脂質(zhì)代謝穩(wěn)態(tài),還能夠阻斷由轉(zhuǎn)化生長因子β誘導(dǎo)的纖維化進程[65]。脂質(zhì)代謝的關(guān)鍵因子PGC-1α也可以被SIRT3所激活,但SIRT3是否可以通過調(diào)節(jié)PGC-1α來直接作用于線粒體脂質(zhì)代謝還需要進一步的研究來證實。除了以上方式外,SIRT3還可以通過調(diào)節(jié)脂聯(lián)素來激活PPARγ與PGC-1α,脂聯(lián)素可以降低甘油三脂水平并以AMP活化蛋白激酶(AMP-activated protein kinase, AMPK)和PPARγ依賴性方式刺激脂肪酸氧化[66]。此外,有研究顯示SIRT3的激活會提高Mfn水平,作為驗證,SIRT3被敲低后Mfn水平無明顯變化,這表明SIRT3可以通過Mfn來調(diào)控磷脂和膽固醇水平[67]。總而言之,SIRT3主要通過調(diào)節(jié)線粒體內(nèi)脂質(zhì)代謝相關(guān)因子來維持脂質(zhì)代謝水平的穩(wěn)定。
3 SIRT3通過調(diào)節(jié)線粒體功能障礙減輕肺纖維化
無論是線粒體DNA損傷還是線粒體的脂質(zhì)代謝異常都與線粒體內(nèi)ROS水平息息相關(guān),ROS參與了線粒體功能障礙的全過程。SIRT3可以通過調(diào)節(jié)一系列的抗氧化酶來穩(wěn)定線粒體ROS水平繼而延緩IPF的進程。研究表明SIRT3缺乏并由此導(dǎo)致的SOD2去乙酰化限制存在于IPF中,抗氧化劑限制會增加由ROS誘導(dǎo)的線粒體DNA損傷,該研究為SIRT3通過調(diào)節(jié)抗氧化劑來減輕IPF提供了直接證據(jù)[68]。加合物8-oxo-dG異常是引起線粒體DNA損傷的重要原因之一,它通過復(fù)制過程中的錯誤配對誘導(dǎo)基因突變,而SIRT3可以調(diào)節(jié)線粒體DNA修復(fù)酶OGG1的乙酰化來水解氧化8-oxo-dG,從而減少線粒體DNA的損傷。相關(guān)的研究表明在IPF的病理環(huán)境下,SIRT3的過表達恢復(fù)了OGG1的水平和活性并阻止了線粒體DNA損傷,從而保護肺部免于纖維化或減輕已經(jīng)存在的纖維化,這表明SIRT3也可以通過修復(fù)線粒體DNA來減輕IPF[69]。在IPF中FA降解不足會導(dǎo)致脂肪代償性消耗以滿足機體正常需求,F(xiàn)A的異常累積又會加速了IPF進程[70]。SIRT3既通過抑制線粒體ROS的過量產(chǎn)生以及改善線粒體功能的來保障線粒體的脂質(zhì)代謝功能穩(wěn)定,又可作用于脂肪酸分解相關(guān)酶來直接參與脂質(zhì)代謝。衰老也是IPF的一個重要的驅(qū)動因素,線粒體功能障礙可以驅(qū)動衰老細胞表型,作為延緩衰老的重要因子,SIRT3通過改善線粒體生物功能來逆轉(zhuǎn)衰老進程,進而延緩了IPF進程[71-72]。線粒體功能障礙是導(dǎo)致IPF的重要因素,作為線粒體內(nèi)主要的脫乙酰酶,SIRT3通過維持線粒體內(nèi)氧化還原動態(tài)平衡、促進線粒體DNA修復(fù)以及調(diào)節(jié)脂質(zhì)代謝來恢復(fù)線粒體的正常功能,而這對于延緩IPF的病理進程具有重要意義。
4 小結(jié)與展望
綜上所述,線粒體DNA的損傷,線粒體ROS的異常以及線粒體脂質(zhì)代謝的異常存在于功能障礙的線粒體中,功能障礙的線粒體會營造一個促IPF的環(huán)境,而IPF的病理進程又進一步加劇了線粒體的功能障礙,SIRT3作為一個關(guān)鍵因子,它既能清除過量的ROS來保障線粒體DNA及其脂質(zhì)代謝功能免于氧化應(yīng)激所帶來的損傷,又可以直接調(diào)節(jié)相關(guān)因子來保護線粒體DNA以及緩解線粒體脂質(zhì)代謝的異常。
近年來,關(guān)于SIRT3調(diào)控線粒體功能障礙以及線粒體功能異常對IPF影響的研究不斷深入,但SIRT3直接調(diào)控IPF的研究還相對不足,相關(guān)調(diào)控機制尚未完善,尤其是在IPF病理環(huán)境下SIRT3以何種機制緩解線粒體的多種功能障礙。同時,SIRT3在癌癥中的作用也存在爭議,由于IPF的病理環(huán)境使其更容易發(fā)展為肺癌,所以使其靶向抑癌并且不觸發(fā)相應(yīng)的促癌機制也是研究的重點。當(dāng)前尚無特異性或選擇性的SIRT3激活劑和抑制劑,因此靶向SIRT3的單體藥物及聯(lián)合藥物的研發(fā)具有廣闊的前景。總的來說,目前亟需深入對IPF背景下SIRT3調(diào)節(jié)線粒體功能障礙的研究,并以此為基礎(chǔ)探尋疾病發(fā)生發(fā)展的新機制。此外,將SIRT3與線粒體相聯(lián)系將有望成為未來治療IPF的突破口。

