鹽脅迫下基于TMT技術(shù)的羅布麻蛋白質(zhì)組學分析
甄 熙,劉旭洋,張曉明,宛 濤*
(1 內(nèi)蒙古農(nóng)業(yè)大學 草原與資源環(huán)境學院,呼和浩特 010019;2 內(nèi)蒙古自治區(qū)人工影響天氣中心,呼和浩特 010051;3 內(nèi)蒙古自治區(qū)氣候中心,呼和浩特 010051)
蛋白質(zhì)組學是研究整個生物體內(nèi)全套的蛋白質(zhì)組及其動態(tài)變化規(guī)律的科學[1-2],植物蛋白質(zhì)組學主要通過對植物在特定條件下蛋白質(zhì)表達的種類、水平以及修飾狀態(tài)進行鑒定,解析蛋白質(zhì)功能和蛋白互作的機制[3]。目前,定量蛋白質(zhì)組學檢測方法主要有2種:iTRAQ(isobaric tags for relative and absolute quantitation)和TMT(tandem mass tags)[4]。李俊良用iTRAQ 方法對甜菜(Betavulgaris)在鹽脅迫下的蛋白質(zhì)表達進行分析,發(fā)現(xiàn)差異蛋白主要通過參與滲透調(diào)節(jié)、光合作用和能量代謝等過程抵抗鹽脅迫[5]。Chen等對耐鹽和鹽敏感2個玉米品種進行鹽脅迫處理,通過iTRAQ 方法共鑒定出1 056種差異表達蛋白,差異蛋白主要與苯丙素生物合成、淀粉和蔗糖代謝以及絲裂原活化蛋白激酶(MAPK)信號通路相關(guān)[6]。有人用TMT 技術(shù)分析了金銀花(Lonicerajaponica)的耐鹽性,發(fā)現(xiàn)苯丙素類生物合成和單萜類生物合成途徑的相關(guān)基因上調(diào)表達,差異蛋白主要參與能量代謝和碳水化合物代謝過程途徑以增強耐鹽性[7]。
近年來對羅布麻(ApocynumvenetumL.)的相關(guān)研究主要集中在藥用成分、遺傳多樣性和鹽脅迫耐受性等方面[8-10]。對于羅布麻在鹽脅迫條件下的適應機制研究大多數(shù)都集中在生理和表型方面,也有一些研究試圖從分子機制方面闡明羅布麻的耐鹽機制。基于轉(zhuǎn)錄組水平研究發(fā)現(xiàn)黃酮類物質(zhì)與羅布麻提高耐鹽性有關(guān),由于黃酮類化合物的積累,轉(zhuǎn)基因擬南芥比野生型擬南芥表現(xiàn)出更高的耐鹽性[10]。羅布麻DEAD-box解旋酶AvDH1基因在棉花基因組中穩(wěn)定遺傳,經(jīng)耐鹽性鑒定發(fā)現(xiàn)轉(zhuǎn)基因棉花株系的耐性顯著提高[11]。羅布麻黃酮醇合成酶基因AvFLS過表達能夠提高擬南芥的黃酮類化合物含量和光合速率,降低丙二醛含量,從而顯著提高轉(zhuǎn)基因擬南芥的耐鹽能力[12]。綜上所述,國內(nèi)外學者在羅布麻藥用成分、遺傳多樣性及耐鹽性等方面開展了大量研究工作,但對野生羅布麻耐鹽性機理的關(guān)注較少,從而限制了對其種質(zhì)資源的保護和發(fā)掘利用。
羅布麻雖屬于耐鹽性較強的植物,但隨著生境遭到破壞及土壤鹽漬化程度加重,羅布麻的野生種群數(shù)量逐漸縮減,探究羅布麻的耐鹽性機制,對羅布麻野生種質(zhì)資源的保護和利用具有重要意義。前期研究發(fā)現(xiàn)羅布麻對土壤鹽漬化具有較強的適應能力,研究擬通過鹽脅迫下羅布麻蛋白組學分析探究其對鹽脅迫的應答機制,以期揭示羅布麻耐鹽的分子機制并篩選出羅布麻響應鹽脅迫的關(guān)鍵蛋白,拓展羅布麻鹽脅迫應答相關(guān)的分子資源,并為羅布麻天然抗逆種質(zhì)的發(fā)掘與利用提供試驗與理論依據(jù)。
1 材料和方法
1.1 試驗材料
材料為羅布麻野生植株,取樣地點在內(nèi)蒙古杭錦旗羅布麻樣地(東經(jīng)108°44′44″,北緯40°35′23″),該樣地土壤含鹽量較高且有較多1 年生羅布麻幼苗,便于篩選長勢均勻的植株。在野外樣地,選擇植株高度、莖干粗細一致的羅布麻幼苗,放入Hoaglang營養(yǎng)液中帶回實驗室培養(yǎng)。
選取長勢良好的野生羅布麻植株,設置鹽脅迫處理組與對照組2個組別,每個處理3次重復。根據(jù)前期鹽脅迫下生理指標測定結(jié)果,選取300 mmol/L為蛋白組試驗的脅迫濃度,該脅迫濃度下羅布麻生理代謝活動最強,滲透調(diào)節(jié)物質(zhì)含量及抗氧化酶活性最高,表現(xiàn)出較強的滲透調(diào)節(jié)及代謝活性。操作過程:將試驗組羅布麻植株放于純水中小心清洗后移入配制好的脅迫營養(yǎng)液(含300 mmol/L NaCl);對照組植株清洗后移入另一不含NaCl的營養(yǎng)液中。分別脅迫0 h、2 h、6 h、12 h、24 h和48 h,取羅布麻葉片迅速放入凍存管中進行液氮深凍,然后將樣品放入-80 ℃冰箱中保存?zhèn)溆谩?/p>
1.2 蛋白提取和定量
樣品加入1%的PVPP和適量BPP溶液,使用高通量組織研磨儀振蕩3 次,每次40 s;4 ℃下12 000g離心20 min,取上清液,加入等體積Tris-飽和酚,4 ℃旋渦振蕩10 min;4 ℃下12 000g離心20 min,取酚相,加入等體積BPP溶液,4 ℃旋渦振蕩10 min;4 ℃下12 000g離心20 min,取酚相,加入5倍體積預冷的乙酸銨甲醇溶液,-20 ℃沉淀過夜;次日4 ℃下12 000g離心20 min,棄上清液,向沉淀中加入90%預冷丙酮混勻后離心棄上清液,重復2次;沉淀用蛋白裂解液(8 mol/L 尿素+1%SDS,含蛋白酶抑制劑cocktail)溶解,冰上超聲2 min;4 ℃ 12 000g離心20 min,取蛋白上清液;BCA 法測定蛋白濃度,SDS-PAGE 電泳。用Thermo Scientific Pierce BCA 試劑盒進行蛋白定量。用BCA 試劑盒配制BCA 工作液和不同質(zhì)量濃度的標準蛋白質(zhì)溶液,其質(zhì)量濃度分別為0,0.125,0.250,0.500,0.750,1.000,1.500,2.000 mg/mL。各樣品均取2 μL和18 μL水混合,加入200 μL BCA 工作液。振蕩混勻,37 ℃反應30 min,在562 nm 處讀取吸光度。
1.3 酶解烷基化以及標記
取蛋白樣品100 μg,用裂解液補充體積到90 μL,加入終濃度10 mmol/L TCEP還原劑,在37 ℃下反應60 min;加入終濃度40 mmol/L 碘乙酰胺,室溫下避光反應40 min。每管各加入預冷的丙酮(V丙酮∶V樣品=6∶1),-20 ℃沉淀4 h,10 000g離心20 min,取沉淀。用50 mmol/L TEAB充分溶解樣品,按照質(zhì)量比1∶50(酶∶蛋白)加入Trypsin在37 ℃酶解過夜。
TMT 標記與混樣,-20 ℃取出TMT 試劑(Thermofisher 90111)恢復到室溫,加入乙腈,渦旋離心,每100 μg多肽加入1管TMT 試劑(TMT10-126標記,127N 標記A2,127C 標記A3,128N 標 記B1)。室溫孵育2 h;加入羥胺,室溫反應15 min,將等量標記產(chǎn)物混合于一管中,置于真空濃縮儀濃縮處理,樣品冷凍保存?zhèn)溆谩?/p>
1.4 RPLC一維分離
用UPLC 上樣緩沖液復溶多肽樣品,用反相C18柱進行高pH 液相分離。A 相2%乙腈(氨水調(diào)pH 至10),B相80%乙腈(氨水調(diào)pH 至10),0~2 min,100% A;2~17 min,0~3.8% B;17~35 min,3.8%~24% B;35~38 min,24%~30% B;38~39 min,30%~43% B;39~40 min,43%~100% B;40~46 min,100%~0 B。紫外檢測波長為214 nm,體積流量為200 μL/min,洗脫時間為66 min。根據(jù)峰形和時間共收取20個餾份,合并成10個餾份,真空離心濃縮。
1.5 液相串聯(lián)質(zhì)譜
第二維采用納升級液相色譜串聯(lián)質(zhì)譜技術(shù)(Easy-nLC 1200 結(jié)合Q Exactive質(zhì)譜儀)進行分析。肽段用質(zhì)譜上樣緩沖液溶解,上樣后經(jīng)C18色譜柱(75 μm×25 cm,Thermo,USA)分離120 min,體積流量為300 μL/min。EASY-nLC 液相梯度洗脫,A 相2%乙腈(加0.1%甲酸),B相80%乙腈(加0.1%甲酸),0~1 min,0~5% B;1~63 min,5%~23% B;63~88 min,23%~48% B;88~89 min,48%~100% B;89~95 min,100% B。
MS和MS/MS 采集之間自動切換,質(zhì)譜分辨率分別是70 K 和35 K。MS進行全掃(350~1 300 m/z),選擇母離子top20進行二級碎裂,動態(tài)排除時間18 s。
1.6 蛋白搜庫和差異蛋白篩選
采用Protein Pilot Software 5.0(AB Sciex,美國)和Swiss Prot/UniProt數(shù)據(jù)庫進行蛋白鑒定。對質(zhì)譜下機的原始數(shù)據(jù)經(jīng)Proteome DiscovererTM Software 2.2(Thermo Fisher,美國)進行處理。搜庫過程中肽段鑒定的錯誤發(fā)現(xiàn)率(FDR)設置為FDR≤0.01。蛋白至少含有1個特異肽段。
項目共檢測到12 457個蛋白,使用R 語言計算樣本間差異顯著性P值,同時計算組間差異倍數(shù)(αFC)。顯著差異表達蛋白的篩選標準為:P<0.05且αFC>1.2為上調(diào)蛋白,P<0.05且αFC<0.83為下調(diào)蛋白。
1.7 生物信息學分析
選擇GO(gene ontology,http://www.blast2go.com/b2ghome;http://geneontology.org/)對所有的差異蛋白進行功能聚類分析,用KEGG(kyoto encyclopedia of gene and genomes,http://www.genome.jp/kegg/pathway.html)通路數(shù)據(jù)庫對差異蛋白涉及的代謝通路進行分析。用STRING 和Cytoscape軟件構(gòu)建蛋白質(zhì)相互作用網(wǎng)絡。
1.8 平行反應監(jiān)測(PRM)分析
在TMT 數(shù)據(jù)中篩選出與響應鹽脅迫相關(guān)的8個差異表達蛋白進行表達量驗證。用平行反應監(jiān)測(parallel reaction monitoring,PRM)方法對其表達水平進行驗證分析。從樣品中提取蛋白后,對質(zhì)量達標的蛋白樣品進行還原烷基化處理。樣品經(jīng)過胰蛋白酶酶解純化后,分別用FULL MS/DD-MS2(TOP20)和FULL MS-PRM 2種方法進行質(zhì)譜分析和PRM 蛋白鑒定質(zhì)譜檢測。最后,分析質(zhì)譜采集數(shù)據(jù),確認目標蛋白的目標肽段進行后續(xù)定量可行性分析。液相色譜、掃描范圍和質(zhì)譜分辨率等參數(shù)與TMT 蛋白質(zhì)組測序的條件相同。
2 結(jié)果與分析
2.1 鹽脅迫下羅布麻葉片蛋白提取檢測結(jié)果
對羅布麻葉片鹽脅迫樣品進行蛋白質(zhì)定量測序,共得到569 883張圖譜,用轉(zhuǎn)錄組建立的蛋白組數(shù)據(jù)庫對原始質(zhì)譜數(shù)據(jù)進行搜庫,鑒定到59 274個肽段,12 457 個蛋白。蛋白質(zhì)提取檢測,肽段長度范圍在5~20個氨基酸之內(nèi)(圖1,A、B),表明酶解充分且后續(xù)鑒定結(jié)果可靠。氨基酸個數(shù)從1~5到41~60之間蛋白覆蓋度都高于15%,高于15%的蛋白覆蓋度達到91.61%(圖1,C、D),說明鑒定結(jié)果可靠。
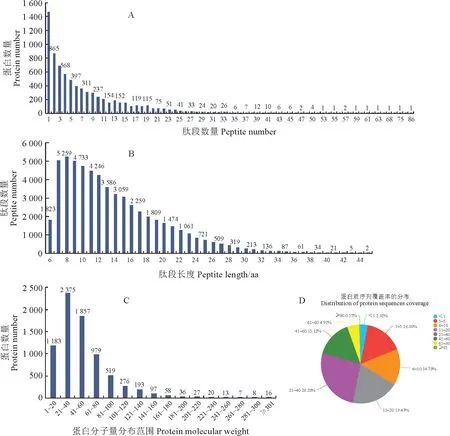
圖1 蛋白的鑒定與分析A.肽段數(shù)量分布;B.肽段長度分布;C.蛋白分子量分布;D.蛋白覆蓋度分布。Fig.1 Analysis and identification of proteinsA.Peptide number distribution.B.Peptide length distribution.C.Molecular weight distribution of the identified proteins.D.Distribution of protein sequence coverage.
2.2 鹽脅迫下羅布麻葉片差異表達蛋白分析
對羅布麻在鹽脅迫的不同時間鑒定到不同數(shù)量和不同種類的差異表達蛋白(differentially expressed proteins,DEPs),T2 vs T0 組差異蛋白424,其中上調(diào)蛋白281,下調(diào)蛋白143;T6 vs T0差異蛋白645,上調(diào)485,下調(diào)160;T12 vs T0共檢測到791個差異蛋白,上調(diào)蛋白409,下調(diào)蛋白382;T24 vs T0檢測到1 001 個差異蛋白,上調(diào)546,下調(diào)455;T48 vs T0差異蛋白1 227,上調(diào)576,下調(diào)651。以上結(jié)果(圖2)表明,在羅布麻響應鹽脅迫的過程中,隨時間延長有更多差異表達蛋白參與脅迫過程。

圖2 差異表達蛋白(DEPs)的火山圖紅色代表上調(diào)蛋白,藍色代表下調(diào)蛋白,灰色代表非顯著差異的蛋白。Fig.2 Volcano plot of DEPsRed points () represent up-regulated proteins,blue ones () represent down-regulated proteins,and unchanged proteins are gray points ().
2.3 鹽脅迫下羅布麻葉片差異蛋白的GO 分析
為深入了解差異蛋白的功能,對羅布麻鹽脅迫2 h、6 h、12 h、24 h、48 h與對照0 h對比獲得的差異蛋白進行GO 分析(表1)。差異蛋白GO 功能注釋主要包括生物學過程(biological process,GOBP)、細胞成分(cellular component,GO-CC)、分子功能(molecular function,GO-MF)。在T2 vs T0比較組(圖3,A)中共鑒定到424個差異表達蛋白,有83,13,4,3個差異表達蛋白分別富集在氧化還原酶活性、鈣離子結(jié)合、肉桂醇脫氫酶活性和茉莉酸代謝過程,顯著富集的主要有葉綠素代謝過程、細胞壁修飾、酸性磷酸酶活性、天冬氨酸酯酶活性、氧化還原酶活性等。T6 vs T0組鑒定到的差異蛋白中,生物學過程(GO-BP)主要富集在:核糖核蛋白復合物生物發(fā)生、細胞成分生物發(fā)生、肽生物合成過程、細胞質(zhì)翻譯等;細胞成分(GO-CC)主要富集在胞質(zhì)大核糖體亞基、胞質(zhì)小核糖體亞基、類核等;分子功能(GO-MF)主要富集在rRNA 結(jié)合、核糖體的結(jié)構(gòu)成分、結(jié)構(gòu)分子活性(圖3,B)。T12 vs T0組篩選出的差異蛋白中分別有128,5,3,3個差異蛋白富集在氧化還原酶活性、乙酰輔酶A 生物合成過程、維生素E生物合成過程和異檸檬酸脫氫酶活性,富集顯著性最高的主要為細胞酰胺代謝過程、胞質(zhì)大核糖體、rRNA 結(jié)合等(圖3,C)。T24 vs T0組差異蛋白富集最多的為氧化還原酶活性通路共有163個差異表達蛋白,占這一過程中差異蛋白總數(shù)的16.3%,其余富集顯著性較高的有脂肪酸代謝過程、碳水化合物代謝過程、多糖代謝過程、細胞壁、水解酶活性等(圖3,D)。T48 vs T0組有195個差異蛋白富集在氧化還原酶活性通路,其余富集顯著性最高的有內(nèi)肽酶調(diào)節(jié)活性、細胞壁、碳水化合物代謝過程等(圖3,E)。
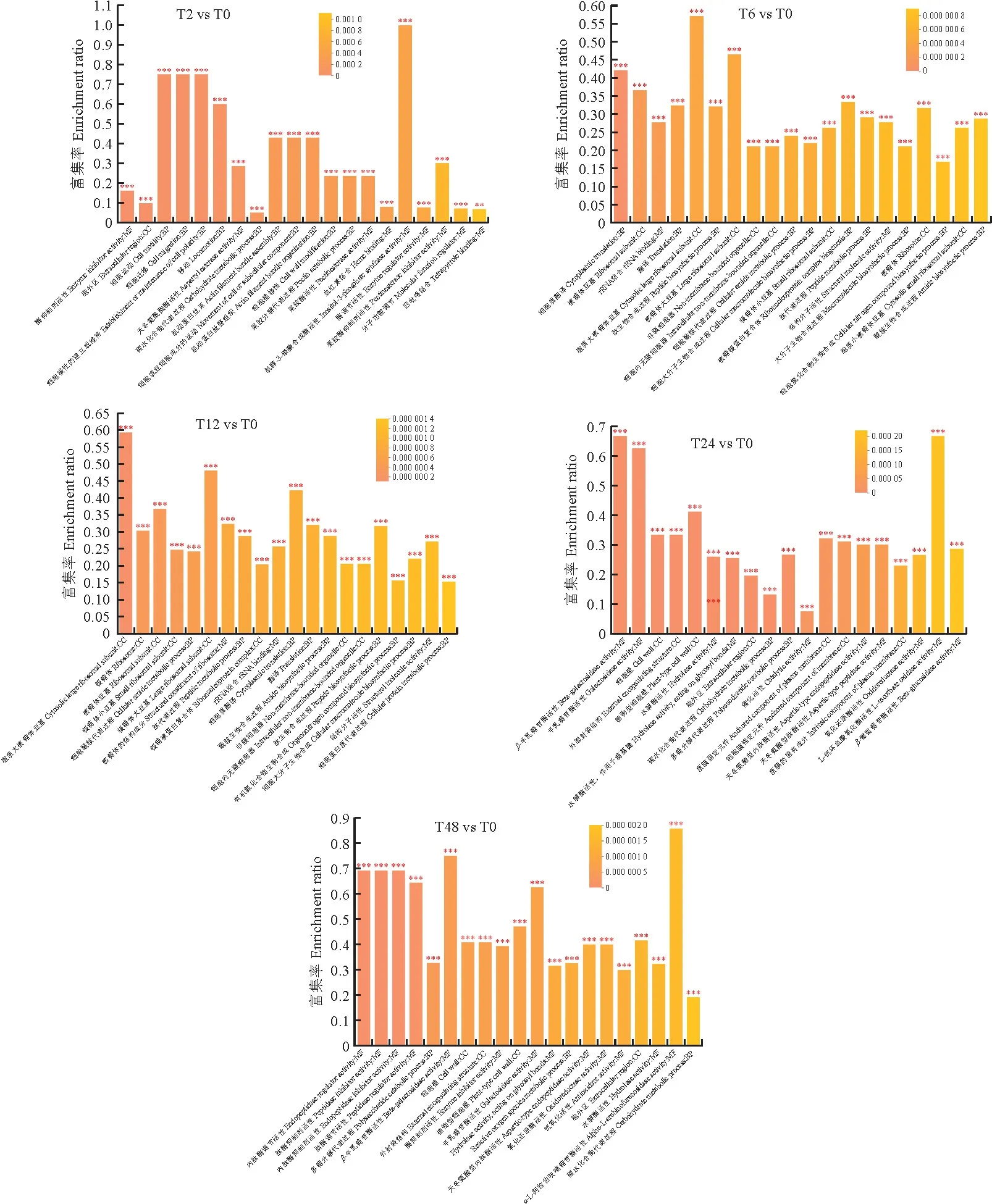
圖3 鹽脅迫下羅布麻差異表達蛋白的GO 富集分析P<0.001標記為***,P<0.01標記為**,P<0.05標記為*。下同。Fig.3 GO of DEPs in A.venetum under salt stressP<0.001 marks as ***,P<0.01 marks as **,P<0.05 marks as *.The same as below.
2.4 羅布麻葉應答鹽脅迫差異蛋白的KEGG 分析
KEGG 分析表明,在羅布麻鹽脅迫2 h、6 h、12 h、24 h和48 h與對照0 h相比,分別有82,100,99,112,111個差異表達蛋白參與了代謝途徑,參與最多的為碳水化合物代謝、氨基酸代謝和翻譯通路(圖4)。可見羅布麻鹽脅迫過程中,隨著脅迫時間的延長,差異表達蛋白參與了更多代謝通路。
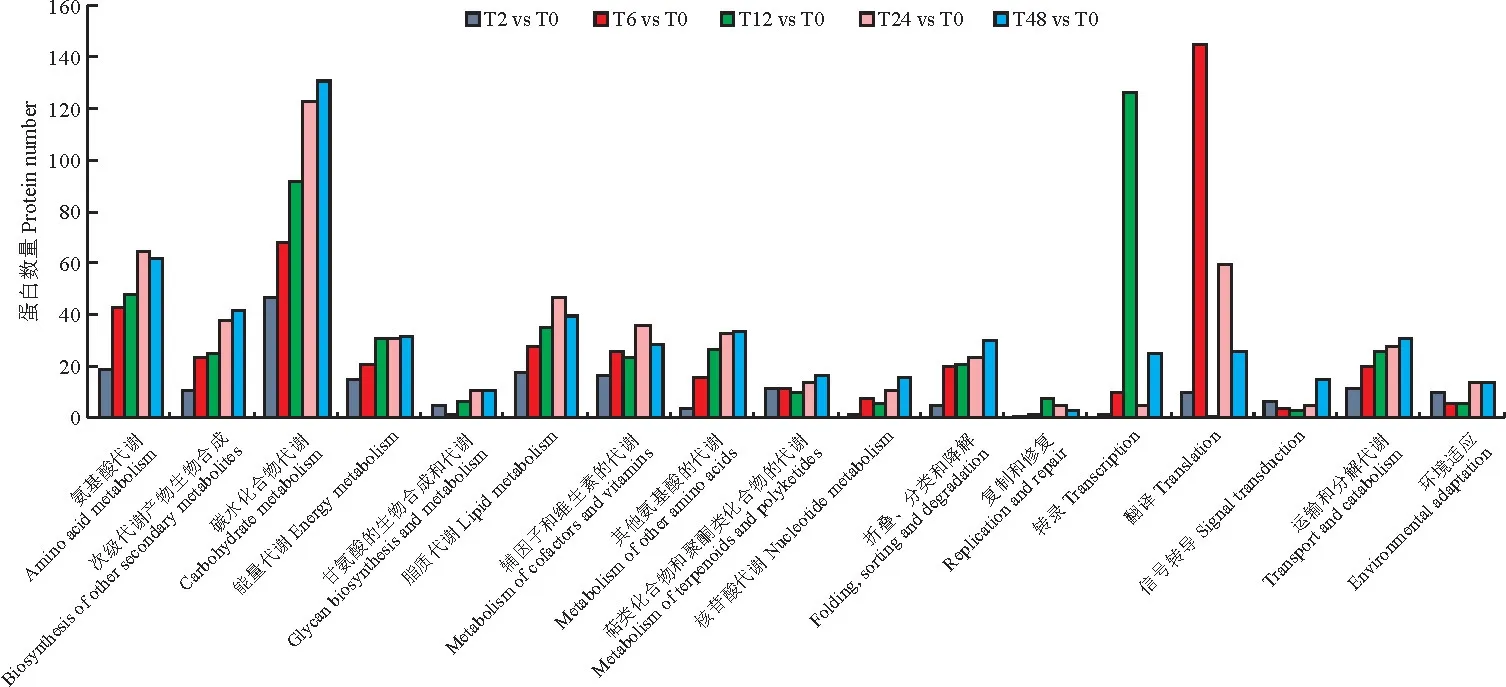
圖4 鹽脅迫下羅布麻差異表達蛋白質(zhì)的KEGG 代謝通路分析Fig.4 KEGG pathway of DEPs in A.venetum under salt stress
T2 vs T0組差異蛋白主要富集在:卟啉和葉綠素代謝、鞘脂代謝、亞油酸代謝。T6 vs T0組差異蛋白主要富集在:核糖體和黃酮類生物合成、丙酮酸代謝、檸檬酸循環(huán)(TCA循環(huán))。T12 vs T0組差異蛋白主要富集在:核糖體和黃酮類生物合成、苯丙烷生物合成、淀粉和蔗糖代謝。T24 vs T0組差異蛋白主要富集在:黃酮類生物合成,淀粉和蔗糖代謝,脂肪酸生物合成,甘氨酸、絲氨酸和蘇氨酸代謝。T48 vs T0組差異蛋白主要富集在:苯丙烷生物合成、淀粉和蔗糖代謝、MAPK信號通路、戊糖和葡萄糖醛酸的相互轉(zhuǎn)化。見圖5。
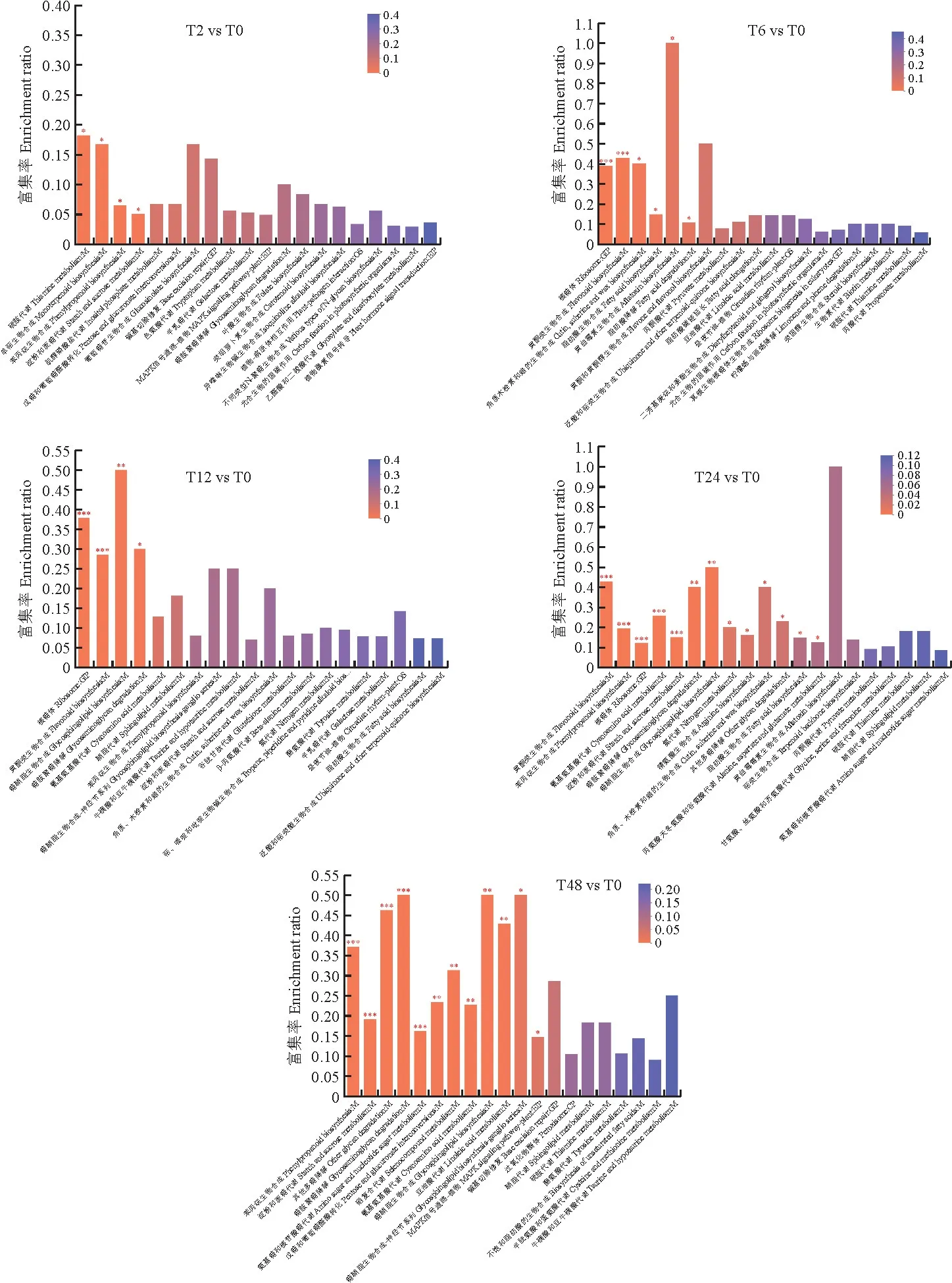
圖5 鹽脅迫下羅布麻差異蛋白的KEGG 富集Fig.5 KEGG enrichment of DEPs in A.venetum under salt stress
2.5 鹽脅迫下羅布麻葉片共有的差異蛋白分析
共有差異蛋白的韋恩圖分析表明,有11個蛋白在2 h、6 h、12 h、24 h、48 h羅布麻響應鹽脅迫過程中差異表達(圖6)。其中,有5個蛋白下調(diào)表達,5個蛋白上調(diào)表達,另外有1個蛋白在2 h時表達量增加,之后表達量降低(圖7)。進一步進行GO 富集分析發(fā)現(xiàn),這些共有差異蛋白主要富集在:蛋白質(zhì)-FAD 連接、轉(zhuǎn)運蛋白活性的負調(diào)控、離子跨膜轉(zhuǎn)運蛋白活性的負調(diào)節(jié)、陰離子跨膜轉(zhuǎn)運的負調(diào)控、陰離子通道活性的負調(diào)節(jié)、噻唑代謝過程等通路。
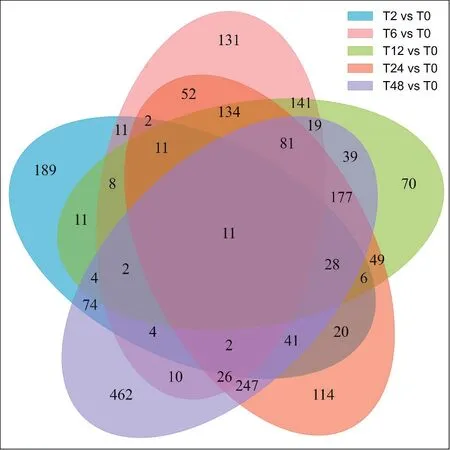
圖6 共有差異蛋白的韋恩圖分析Fig.6 Venn diagram analysis of common DEPs in A.venetum
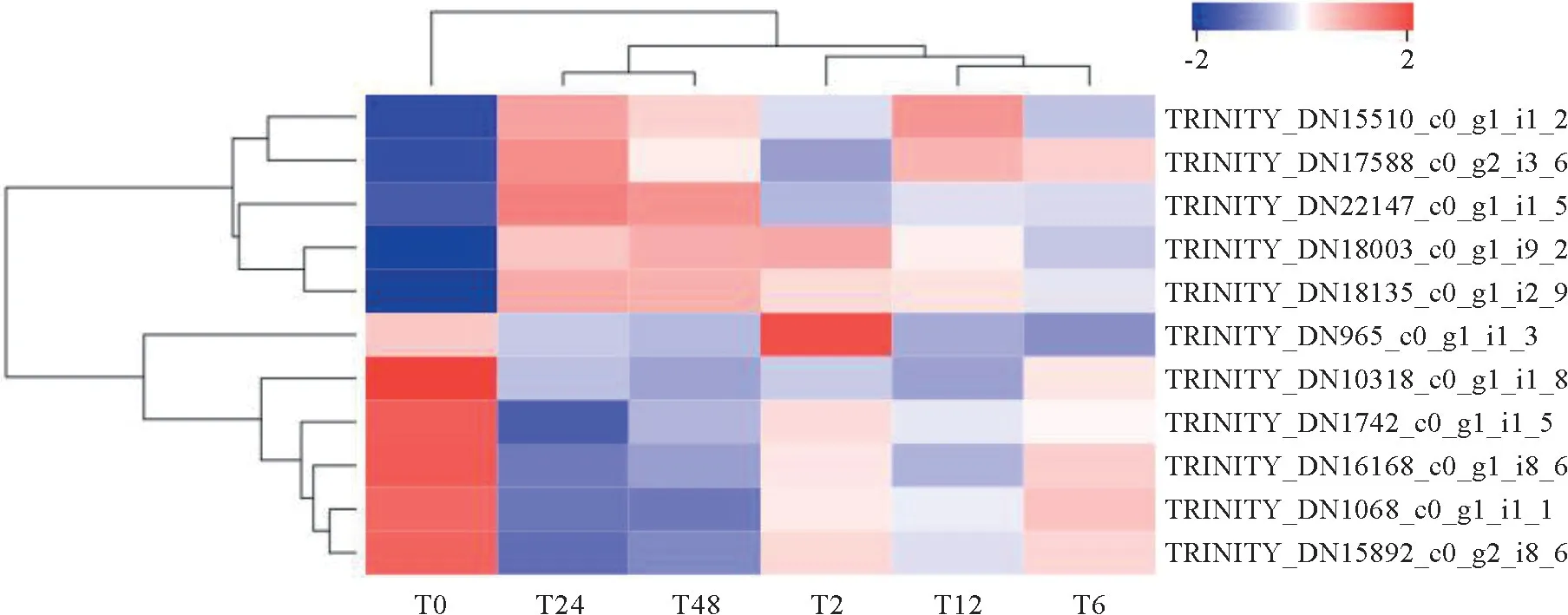
圖7 共同差異表達蛋白表達模式分析Fig.7 Expression patterns of the common DEPs
2.6 鹽脅迫下羅布麻葉片差異蛋白網(wǎng)絡互作分析
為了研究羅布麻在鹽脅迫下如何通過蛋白互相作用進行鹽脅迫信號的傳遞,筆者通過String分析,采用網(wǎng)絡建模的方法,構(gòu)建出蛋白質(zhì)相互作用網(wǎng)絡,從而挖掘出蛋白間相互作用中的關(guān)鍵蛋白(表2)。

表2 蛋白網(wǎng)絡分析中的名稱描述Table 2 Description of protein names in the network analysis
對不同脅迫時間點的差異蛋白以及所有差異蛋白分別進行String分析,得到處于網(wǎng)絡互作核心位置的蛋白(圖8)。T2 vs T0組得到的差異表達蛋白中處于網(wǎng)絡核心位置的高表達蛋白為30S核糖體蛋白S9(TRINITY_DN1083_c0_g1_i2_2)(圖8,A);T6 vs T0組處于核心的高表達蛋白為40S核糖體蛋白S3-3樣(TRINITY_DN13429_c0_g1_i1_3)(圖8,B);T12 vs T0組的核心蛋白為未知蛋白(TRINITY_DN17640_c1_g1_i1_3)和60S核糖體蛋白L3-2(TRINITY_DN13265_c0_g1_i1_9)(圖8,C);T24 vs T0 組為60S 核糖體蛋白L3-2(TRINITY_DN13265_c0_g1_i1_9)和40S核糖體蛋白S19-3樣(TRINITY_DN23552_c0_g1_i1_3) (圖8,D);T48 vs T0組為細胞分裂周期5樣蛋白亞型X2(TRINITY_DN17302_c0_g2_i5_7)和60s核糖體蛋白l44(TRINITY_DN15103_c0_g1_i2_6)(圖8,E)。對所有差異表達蛋白進行蛋白互作網(wǎng)絡分析之后得到的核心蛋白為40S 核糖體蛋白S27(TRINITY_DN15887_c0_g3_i1_3)(圖8,F)。
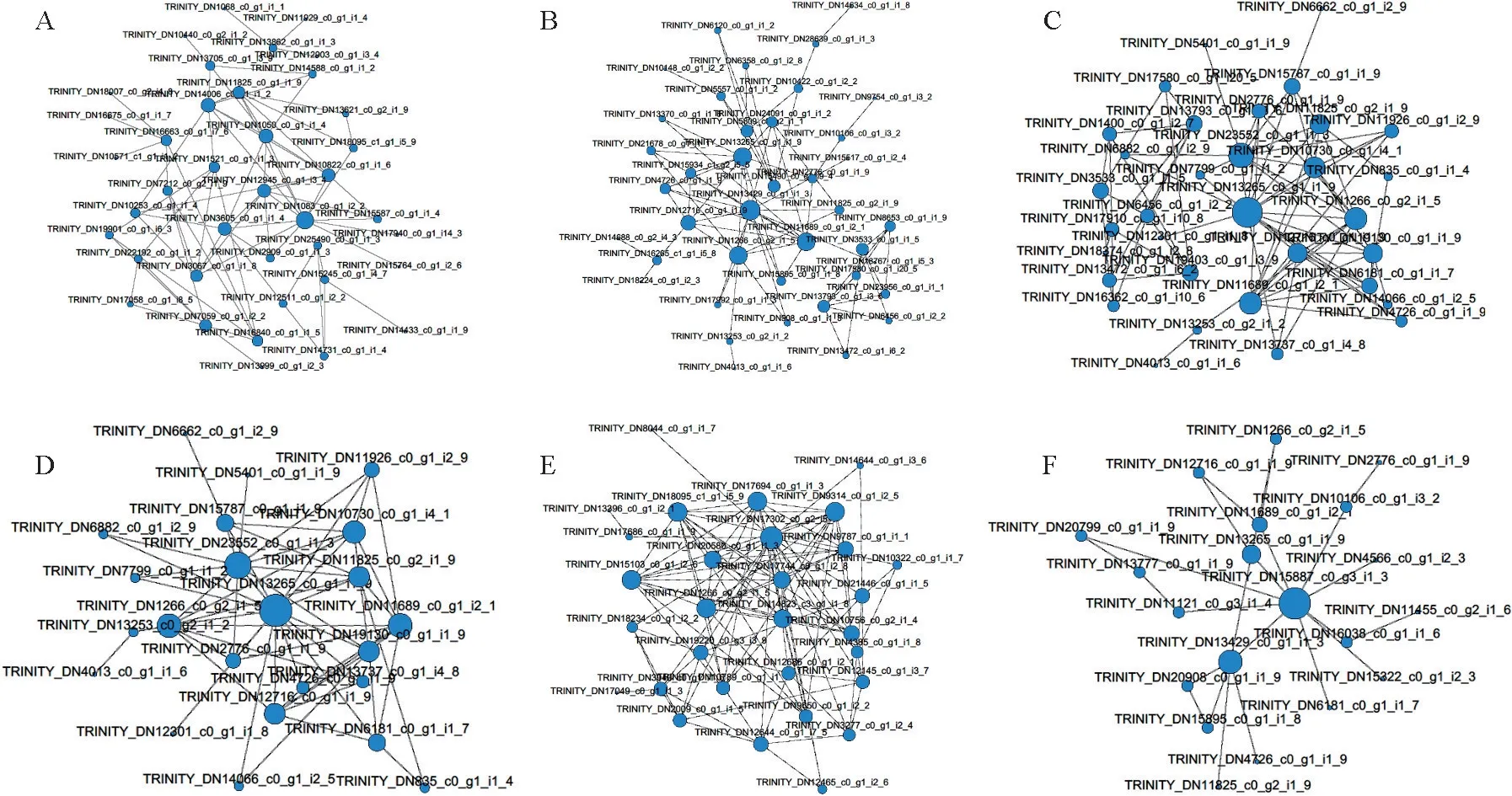
圖8 差異蛋白的蛋白互作網(wǎng)絡分析A.T2 vs T0;B.T6 vs T0;C.T12 vs T0;D.T24 vs T0;E.T48 vs T0;F.所有差異蛋白。Fig.8 Protein-protein interaction analysis of the DEPsA.T2 vs T0.B.T6 vs T0.C.T12 vs T0.D.T24 vs T0.E.T48 vs T0.F.All differential proteins.
2.7 差異蛋白表達水平PRM 驗證
根據(jù)TMT 實驗結(jié)果,隨機選取8個與糖代謝、氧化還原、光合作用和滲透調(diào)節(jié)等過程相關(guān)的差異表達蛋白進行PRM(parallel reaction monitoring)驗證分析。在T2 vs T0、T6 vs T0、T12 vs T0、T24 vs T0和T48 vs T0比較組中,8個蛋白的TMT 定量結(jié)果和PRM 定量結(jié)果中表達趨勢一致。其中,TRINITY_ DN12352_c0_g1_i1_6、TRINITY_DN12386_c0_g1_i2_8和TRINITY_DN16647_c0_g1_i9_2,這3個蛋白在鹽脅迫0 h、2 h、6 h、12 h、24 h和48 h均表現(xiàn)為上調(diào)表達且與TMT 結(jié)果趨勢(表3)一致。PRM 結(jié)果表明蛋白組數(shù)據(jù)是可信的,能為進一步研究提供依據(jù)。
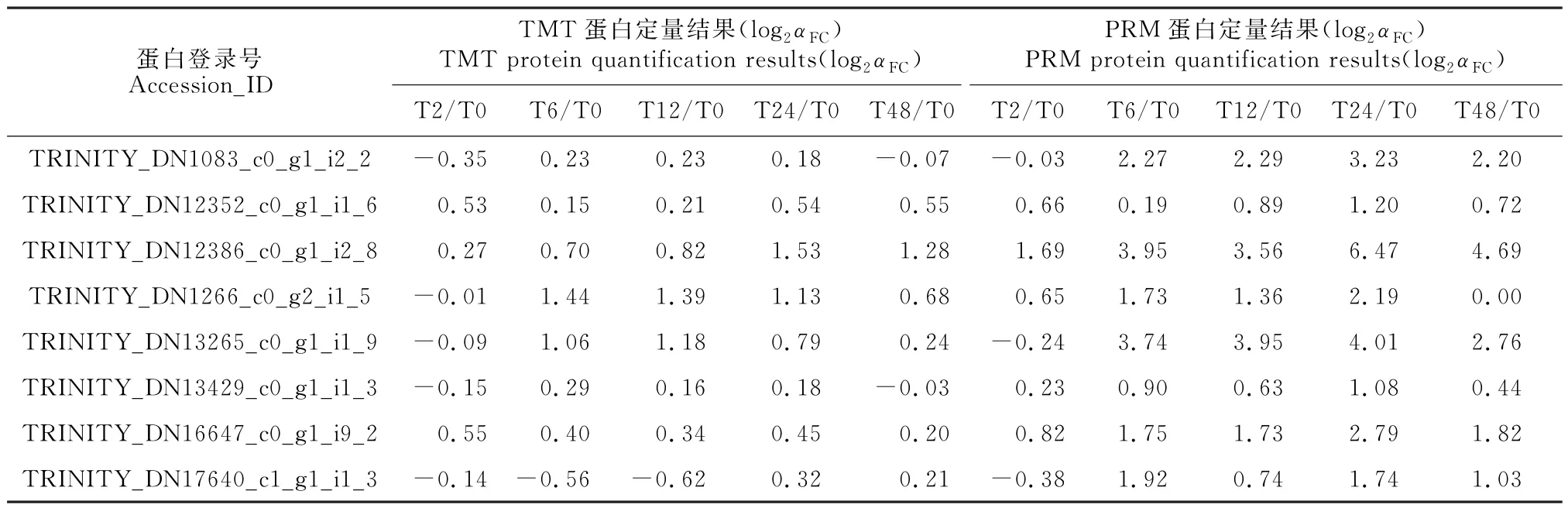
表3 差異表達蛋白的PRM 驗證結(jié)果Table 3 PRM validation of the differentially expressed proteins
3 討論
3.1 參與光合與能量代謝相關(guān)的蛋白質(zhì)及作用
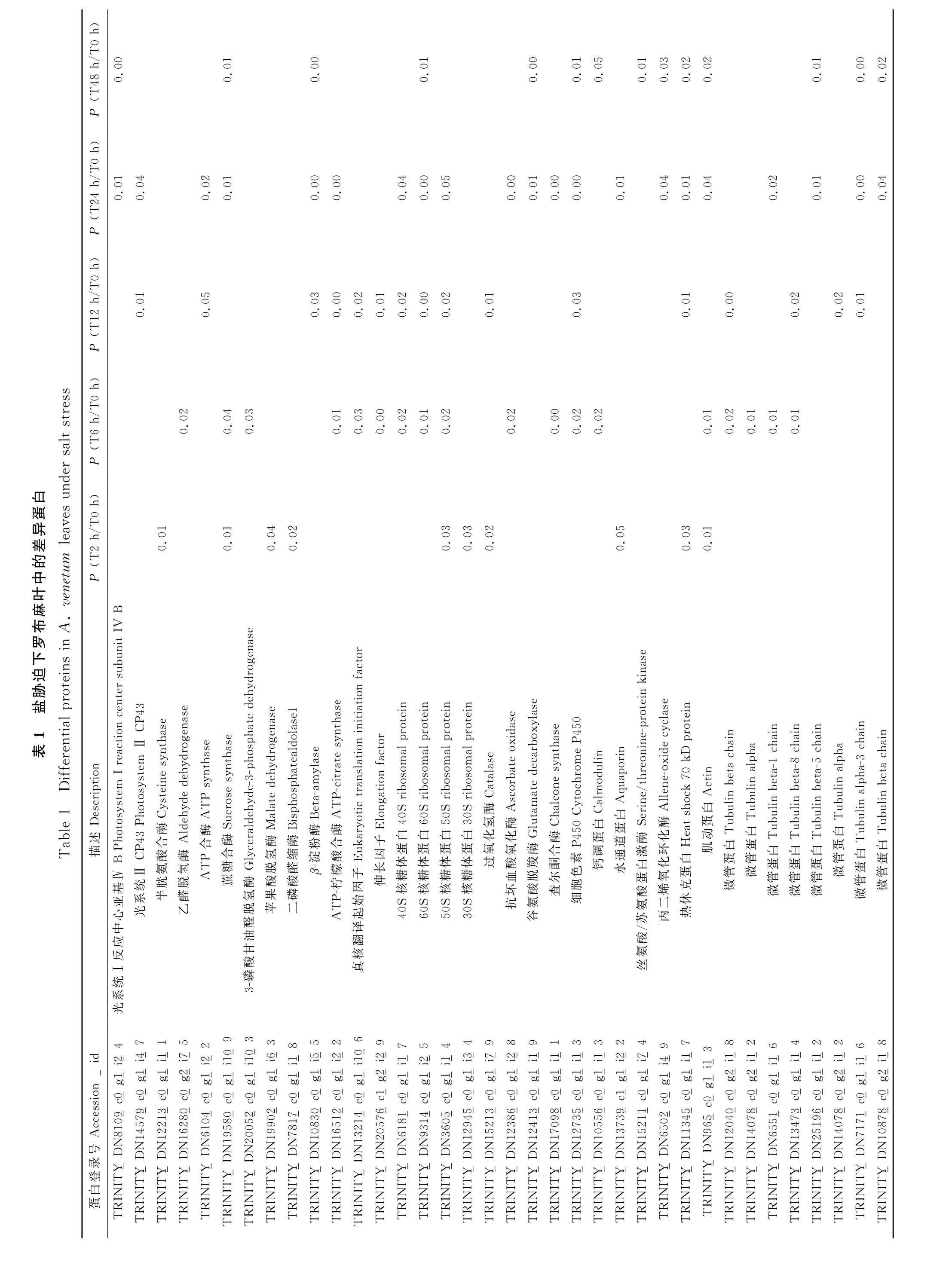
鹽脅迫通過破壞生理過程,導致不充分的光合作用,使植物生長發(fā)育受到抑制。光合作用是一種光驅(qū)動的氧化還原過程,涉及將光能轉(zhuǎn)化為化學能。在高等植物中,類囊體膜位于葉綠體中,嵌入類囊體膜的4種蛋白復合物參與電子傳遞過程包括:光系統(tǒng)Ⅱ(PSⅡ)、細胞色素(Cyt) b6/f、光系統(tǒng) Ⅰ(PS Ⅰ)和ATP合酶復合物。2個光系統(tǒng)(PSⅠ和PSⅡ)都是色素-蛋白質(zhì)復合物。Neelam 等研究表明PSⅡ在鹽脅迫條件下會受到損傷,且與PSⅠ相比,PSⅡ的損傷率更高[13]。本研究中光系統(tǒng)Ⅰ相關(guān)蛋白在鹽脅迫12 h、24 h和48 h上調(diào),光系統(tǒng)Ⅱ相關(guān)蛋白在24 h下調(diào)(表1),表明光系統(tǒng)Ⅱ可能對鹽脅迫更為敏感,利用光能驅(qū)動水的光解維持光合效率受到抑制。而光系統(tǒng)Ⅰ自12~48 h均保持穩(wěn)定的表達豐度,表明48 h鹽脅迫處理光系統(tǒng)Ⅰ未受到損傷。
由于鹽脅迫作用導致植物能量代謝發(fā)生顯著改變,本研究中蔗糖合酶(sucrose synthase,SuSy)在鹽脅迫2 h、6 h、24 h、48 h時表現(xiàn)為上調(diào)表達,β-淀粉酶(beta-amylase 9,BMY)在12 h、24 h、48 h時表現(xiàn)為上調(diào),ATP-檸檬酸合酶上調(diào),乙醛脫氫酶(aldehyde dehydrogenase)6 h時下調(diào)表達,但在48 h時表現(xiàn)為上調(diào)。其余差異蛋白表現(xiàn)為下調(diào),包括半胱氨酸合酶(cysteine synthase,OASA)在2 h時下調(diào),ATP合酶12 h、24 h、48 h時下調(diào),參與糖酵解的3-磷酸甘油醛脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GADP)、二磷酸醛縮酶(fructose-bisphosphate aldolase)以及參與檸檬酸循環(huán)的蘋果酸脫氫酶(malate dehydrogenase,MAD)在2 h、6 h、12 h、24 h和48 h一直表現(xiàn)為下調(diào)表達(表1)。在NaCl脅迫下,植物降低能量代謝率以節(jié)約能量并限制ROS 進一步產(chǎn)生[14]。此前有報道稱,在NaCl處理的擬南芥根中,糖酵解、檸檬酸循環(huán)、線粒體呼吸和磷酸戊糖途徑組分的轉(zhuǎn)錄豐度普遍降低[15]。因此,在該研究中觀察到參與糖酵解、檸檬酸循環(huán)的8種蛋白質(zhì)的表達量在NaCl處理后的1個或多個時間點降低并不奇怪。
植物幾丁質(zhì)酶不僅作用于植物防御相關(guān)過程,而且在非生物脅迫耐受中也起重要作用。在擬南芥中,編碼Ⅱ類幾丁質(zhì)酶的AtPR3基因被高鹽誘導[16]。幾丁質(zhì)酶活性在短期脅迫時變化不明顯,隨著脅迫時間的增加而上升,本研究中有4個幾丁質(zhì)酶均在48 h上調(diào)表達(表1),這與鹽脅迫下紫花苜蓿[17]的研究結(jié)果一致。
3.2 參與蛋白質(zhì)合成和氨基酸代謝有關(guān)的蛋白質(zhì)及作用
轉(zhuǎn)錄相關(guān)蛋白和轉(zhuǎn)錄因子在耐鹽性中起關(guān)鍵作用,在鹽脅迫條件下上調(diào)伸長因子有助于維持正常的蛋白質(zhì)合成以提高耐鹽性[18]。鑒定到的伸長因子(elongation factor)主要集中在6 h和12 h下調(diào)表達,在24 h 上調(diào)表達。真核翻譯起始因子(eukaryotic translation initiation factor,eTIF)全部上調(diào)表達(表1)。前人研究發(fā)現(xiàn)真核翻譯起始因子5A(eukaryotic translation initiation factor 5A,eIF5A)不僅能夠直接調(diào)控蛋白質(zhì)的合成,還能通過促進某些蛋白質(zhì)的高效表達,間接調(diào)控細胞自噬、核質(zhì)運輸、mRNA 的降解及抵抗環(huán)境脅迫等[19]。這些伸長因子和真核翻譯起始因子上調(diào)表達使羅布麻能夠維持較高的耐鹽性。
研究發(fā)現(xiàn)鹽脅迫能夠誘導許多與蛋白質(zhì)合成相關(guān)的蛋白表達量發(fā)生變化[20]。本研究也鑒定到與蛋白質(zhì)合成相關(guān)的差異表達蛋白,主要包括40S核糖體蛋白、60S 型核糖體蛋白、30S 核糖體蛋白和50S核糖體蛋白(表1)。在這項研究中蛋白質(zhì)合成相關(guān)蛋白在鹽脅迫下保持較高的數(shù)量和活性,與水稻在逆境下核糖體蛋白發(fā)生時空調(diào)控[21]相一致,表明核糖體蛋白基因家族是調(diào)控植物抗逆性的寶貴資源,在植物耐鹽性方面發(fā)揮著重要作用。
3.3 參與抗氧化和次生代謝相關(guān)的蛋白質(zhì)及作用
非生物脅迫導致植物體內(nèi)活性氧(reactive oxygen species,ROS)的過度產(chǎn)生,ROS 一方面會對細胞成分造成損害,另一方面可以作為應激反應的信號分子[17]。植物可以通過復雜的機制調(diào)節(jié)ROS水平,例如用抗壞血酸過氧化物酶(APX)、谷胱甘肽過氧化物酶(GPX)、谷胱甘肽S-轉(zhuǎn)移酶(GST)和超氧化物歧化酶(SOD)清除ROS。該研究中過氧化物酶(peroxidase,POD)和APX,這2種蛋白均表現(xiàn)出同樣的趨勢,即隨著脅迫時間延長蛋白數(shù)量和表達量增加,該結(jié)果與前期生理指標測定結(jié)果中POD活性的變化趨勢一致。羅布麻在鹽脅迫下POD和APX 上調(diào)表達,與高鹽脅迫下紅樹林(Kandelia candel)中的POD、SOD、APX 和CAT 蛋白質(zhì)豐度顯著增加[22]相一致。因此,這些參與氧化還原穩(wěn)態(tài)的蛋白質(zhì)呈現(xiàn)出上調(diào)表達意味著羅布麻啟動了ROS清除機制,以減輕鹽誘導的氧化脅迫,從而增強耐鹽能力。
谷氨酸脫羧酶(glutamate decarboxylase,GAD)在擬南芥響應NaCl脅迫過程中,不同的GAD 蛋白表現(xiàn)出不同的表達特性[23]。本研究中僅鑒定到1個GAD,響應鹽脅迫過程中在12 h、24 h、48 h 時下調(diào),該結(jié)果與紫花苜蓿葉片響應鹽脅迫的結(jié)果[20]一致。原因可能為GAD 不僅對NaCl有反應,而且還參與其他代謝過程,因為GAD4也被證明在擬南芥中被誘導以響應缺氧[24]、冷處理[25]和干旱脅迫[26]。本研究還鑒定到1 個查爾酮合酶(chalcone synthase,CHS)在6 h、12 h、24 h表達上調(diào),與甘草在鹽脅迫條件下高表達結(jié)果[27]一致。查爾酮是黃酮類形成的中間體,在植物對鹽脅迫的反應中起重要作用[28]。
細胞色素P450(pytochrome P450,CYP)是植物中最大的蛋白質(zhì)家族[29],廣泛參與次生代謝產(chǎn)物的生物合成,并對植物響應非生物脅迫具有重要作用。研究表明小麥鹽脅迫下TaCYP81D5 上調(diào)表達,加速消除ROS 增強小麥苗期和生殖期的耐鹽性[30]。隨著脅迫時間的延長,本研究中細胞色素P450蛋白的數(shù)量逐漸增加并且蛋白表達量也隨之發(fā)生變化(表1),表明這些蛋白質(zhì)在減輕植物損害中起重要作用,但隨著脅迫加重其表達水平受到顯著抑制。
3.4 信號轉(zhuǎn)導和逆境防御相關(guān)蛋白質(zhì)及作用
SOS信號途徑與植物耐鹽性密切相關(guān),其實質(zhì)就是調(diào)節(jié)細胞內(nèi)Na+的動態(tài)平衡[31]。植物在NaCl脅迫下能夠在幾秒鐘內(nèi)提升Ca2+濃度,升高的Ca2+水平可激活處于SOS信號途徑上游的Ca2+結(jié)合蛋白SOS3(salt overly sensitive 3),SOS3感知到Ca2+信號后與下游絲氨酸/蘇氨酸蛋白激酶SOS2互作形成SOS3-SOS2 激酶復合體,在質(zhì)膜H+-ATPase產(chǎn)生的質(zhì)子梯度驅(qū)動下,將Na+從胞質(zhì)移到表皮的質(zhì)外體中[32]。植物細胞在響應鹽脅迫維持滲透平衡的過程中,主要是通過調(diào)控根系導水率,水通道蛋白(AQP)能夠調(diào)節(jié)植物根莖葉的滲透壓,進而調(diào)控導水率動態(tài)變化[33]。對紫花苜蓿水通道蛋白基因MsPIP2;2的功能研究表明,在鹽脅迫條件下,該基因能夠通過促進轉(zhuǎn)基因植物中Na+的外排和K+的保留來緩解鹽毒害,高濃度(≥6 mmol/L)Ca2+可以增強MsPIP2;2轉(zhuǎn)基因擬南芥的耐鹽性[34]。本研究鑒定到的蛋白中參與SOS信號途徑的蛋白包括:鈣調(diào)蛋白(calmodulin,CAM)、鈣依賴性蛋白激酶(calcium-dependent protein kinase,CDPK)、水通道蛋白、絲氨酸/蘇氨酸蛋白激酶,其中CaM前期下調(diào)表達,到48 h時上調(diào)表達,絲氨酸/蘇氨酸蛋白激酶在48 h下調(diào)表達。與離子穩(wěn)態(tài)相關(guān)的水通道蛋白在上調(diào)表達,表明隨著鹽脅迫時間的延長,需要維持葉片內(nèi)水分吸收和運動的需求增加。在這些蛋白的協(xié)同作用下完成羅布麻響應鹽脅迫維持滲透平衡。
在非生物脅迫下,植物激素茉莉酸已被證明可有效提高植物的脅迫耐受性[35],丙二烯氧化環(huán)化酶(allene-oxide cyclase,AOC)是茉莉酸合成過程的關(guān)鍵酶[36],對番茄外源應用AOC 能夠提高其耐鹽能力。有研究發(fā)現(xiàn)AOC 在擬南芥響應鹽脅迫過程中表達量下降[18],本研究在差異蛋白中檢測到1個AOC在12 h、24 h、48 h時表達量下降,此結(jié)果與紫花苜蓿響應鹽脅迫該蛋白表達量下降[37]一致。
在逆境條件下,熱休克蛋白(heat shock 70 kD protein,HSP)可以通過重新折疊蛋白質(zhì)來重建正常的蛋白質(zhì)構(gòu)象并維持細胞穩(wěn)態(tài),從而保護植物免受脅迫[38]。本研究中鑒定到的熱休克蛋白在不同脅迫時間呈上調(diào)或下調(diào)表達,但蛋白數(shù)量隨鹽脅迫時間延長增加。金銀花鹽脅迫下3個熱休克蛋白上調(diào)表達,以增強金銀花對鹽脅迫產(chǎn)生防御反應[7],但在煙葉中這種蛋白顯著下調(diào)[39],這意味著這些蛋白質(zhì)在不同時間、不同劑量脅迫條件下表現(xiàn)出不同的反應。
3.5 細胞分裂和細胞結(jié)構(gòu)相關(guān)蛋白質(zhì)及作用
本研究鑒定得到與細胞分裂、細胞結(jié)構(gòu)維持相關(guān)的蛋白有2種,分別為肌動蛋白(actin)和微管蛋白(tubulin alpha)。肌動蛋白在真核生物的生命活動中占據(jù)重要地位,不僅是構(gòu)建細胞骨架所必需的物質(zhì),而且在細胞運動、物質(zhì)運輸、能量和信息傳遞、細胞分裂等過程中起著重要作用[18]。羅布麻中的肌動蛋白在鹽脅迫下表達量顯著增加,但隨著脅迫時間延長表達量降低,可能細胞結(jié)構(gòu)受到一定程度的破壞。微管蛋白在植物細胞的分裂和生長中起著關(guān)鍵作用。NaCl處理暗發(fā)大豆結(jié)果表明,微管蛋白α鏈(I1K2I1)和微管蛋白β鏈(I1K7J4,I1LDR2)的豐度均因鹽處理而降低,而微管蛋白特異性伴侶蛋白A(C6T5I8)的豐度增加[39]。本研究共發(fā)現(xiàn)8個微管蛋白,不同時間蛋白種類和表達量不同,在6 h時發(fā)現(xiàn)4個微管蛋白表達量全部增加,12 h時有1個微管蛋白降低,24 h時有3個蛋白表達量下降,到48 h時微管蛋白表達量全部降低,隨著脅迫時間延長下調(diào)表達的微管蛋白數(shù)量逐漸增加,這些變化表明它們可能通過復雜的調(diào)節(jié)機制參與應對羅布麻的鹽脅迫過程。
4 結(jié)論
用TMT 技術(shù)對鹽脅迫下羅布麻葉片進行定量蛋白質(zhì)組學研究,分析不同時間鹽脅迫蛋白質(zhì)組表達水平的差異,并對差異表達蛋白進行GO 和KEGG 分析以及String網(wǎng)絡互作分析,根據(jù)鹽脅迫下羅布麻蛋白質(zhì)組表達水平的差異,篩選出羅布麻應答鹽脅迫的關(guān)鍵蛋白。
(1)共鑒定得到12 457個蛋白,脅迫時間2 h、6 h、12 h、24 h 和48 h,得到差異蛋白分別為424,645,791,1 001,1 227個。對差異蛋白進行GO 富集分析表明,差異蛋白主要參與氧化還原酶活性途徑、內(nèi)肽酶調(diào)節(jié)活性、細胞壁、碳水化合物代謝過程等。KEGG 富集分析表明,差異蛋白參與最多的為核糖體、黃酮類生物合成、檸檬酸循環(huán)(TCA 循環(huán))、黃酮類生物合成、淀粉和蔗糖代謝以及丙酮酸代謝等過程。
(2)對不同時間點差異蛋白進行韋恩分析,得到11個差異蛋白為共有蛋白,GO 富集分析發(fā)現(xiàn),這些共有差異蛋白主要富集在蛋白質(zhì)-FAD 連接、轉(zhuǎn)運蛋白活性的負調(diào)控、離子跨膜轉(zhuǎn)運蛋白活性的負調(diào)節(jié)、陰離子跨膜轉(zhuǎn)運的負調(diào)控、陰離子通道活性的負調(diào)節(jié)和噻唑代謝過程等通路。
(3)差異蛋白網(wǎng)絡互作分析發(fā)現(xiàn),不同脅迫時間的差異蛋白網(wǎng)絡互作所得到的蛋白主要以核糖體蛋白為主,其中60S 核糖體蛋白L3-2(TRINITY_DN13265_c0_g1_i1_9)在脅迫12 h和24 h的差異蛋白中均為核心蛋白,表明核糖體蛋白在羅布麻響應鹽脅迫過程中發(fā)揮著重要作用。

