氯氟醚菊酯對斑馬魚胚胎及仔魚心臟發育的毒性及氧化損傷作用
李瑞瑞, 周 寧, 吳夢琪, 徐文平, 陶黎明, 張 陽
(上海市化學生物學重點實驗室,華東理工大學 藥學院,上海 200237)
氯氟醚菊酯 (結構式見圖式1) 是一種廣泛使用的擬除蟲菊酯類殺蟲劑[1]。目前,它是市場上家庭用衛生殺蟲劑的主要品種之一,常被用作蚊香或蚊香液類產品[2]。伴隨它的大量使用,其環境暴露風險也受到了越來越多的關注。2017 年Pierre等使用大鼠模型評價了氯氟醚菊酯類蚊香的急性毒性,發現該產品經肺吸收,具有高毒性風險,主要表現為麻木、嗜睡等[3]。2021 年,埃及報道,吸入氯氟醚菊酯類蚊香煙霧的小白鼠出現細胞凋亡、組織病理學改變和生化指標的破壞[4]。也有研究表明,含氯氟醚菊酯的蚊香對人體存在一定的毒性風險,如肺炎[5]、腦損傷[6]、呼吸道黏膜損傷和過敏[7]等。此處,還有大量研究表明,同類別農用擬除蟲菊酯類殺蟲劑 (高效氯氰菊酯、溴氰菊酯、功夫菊酯等) 的持續使用會對人體和動物產生多種毒性,比如神經、內分泌干擾[8]、發育及生殖[9]、心臟毒性等。其中溴氰菊酯還可引起斑馬魚的發育毒性、細胞凋亡、心血管系統損傷和焦慮樣行為,也會促進谷氨酸能突觸之間的興奮性神經遞質的釋放,導致成年斑馬魚社會行為的過度活躍[10];高效氯氰菊酯可能通過延緩性腺發育、干擾性激素分泌和影響HPG 軸基因的表達而對斑馬魚的生殖系統產生毒性[11]。
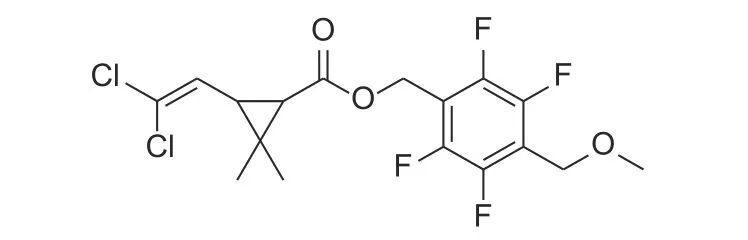
圖式 1 氯氟醚菊酯結構式Scheme 1 The structural formula of meperfluthrin
生物體細胞內活性氧物質 (reactive oxygen species,ROS) 的過量產生與累積會導致氧化應激的發生,從而打破氧化還原平衡狀態[12]。氧化應激的發生可能引起DNA、蛋白質和脂質等生物分子的氧化損傷,導致細胞功能異常,甚至發生凋亡或壞死[13]。為了對抗氧化應激產生的有害效應,生物體內有一套復雜的抗氧化防御系統,包括抗氧化酶,如超氧化物歧化酶 (SOD)、過氧化氫酶 (CAT) 及谷胱甘肽過氧化物酶 (GSH-Px) 等。這些抗氧化物質可以中和ROS,從而減輕其對細胞的損傷[14-15]。心臟作為推動血液循環的主要器官,對于動物的生長發育乃至存活都具有重要的生命意義。生物體一旦發生氧化應激,對心臟組織將產生一定的毒害作用,同時會引發生物體的心血管病變等。斑馬魚Danio rerio模型因胎心透明,心臟及血管發育等表觀形態易于被觀察研究,目前已被廣泛應用到毒理學研究領域[16]。
鑒于此,本研究評估了氯氟醚菊酯對斑馬魚心臟結構和功能的影響,包括心房和心室的形成、心臟收縮和泵血功能等;初步探討了氯氟醚菊酯引起心血管毒性的潛在機制,旨在探究氯氟醚菊酯急性暴露對斑馬魚胚胎及仔魚發育時期心血管發育的毒性效應,為氯氟醚菊酯的安全使用與風險管控提供科學依據。
1 材料與方法
1.1 試驗動物
斑馬魚成魚由國家斑馬魚資源中心提供。雌、雄斑馬魚(5 月大) 分別飼養,飼養水溫控制在(28 ± 1) ℃,pH 值為7.2,電導率約為500 μS/cm,飼養房內光周期設置光照14 h 和黑暗10 h 交替,每日早、晚喂食鮮活豐年蟲。
1.2 試劑和材料
氯氟醚菊酯 (meperfluthrin,CAS:352271-52-4;純度≥99.5%),江蘇揚農化工股份有限公司提供。將氯氟醚菊酯粉末溶于二甲基亞砜 (DMSO),于4 ℃下保存。2′,7′-二氯二氫熒光素二乙酸酯(DCFH-DA)、RIPA 裂解緩沖液和吖啶橙 (AO,acridine orange) 染色試劑,均來自Sigma-Aldrich(美國)。Caspase 兔抗,購自生工生物 (中國上海)。與氧化應激有關的商業檢測試劑盒,購自碧云天生物技術有限公司。用于mRNA 分析的TRIzol 試劑、逆轉錄酶、SYBR-Green Master Mix 和引物,均購自武漢賽維爾生物科技有限公司。CFX 96 孔,購自Labselect (中國北京)。磷酸鹽緩沖溶液 (PBS,phosphate buffer saline) 等其他化學試劑,均購自上海泰坦科技有限公司。
A1 HD25 共聚焦顯微鏡 (日本尼康公司);SMZ745T 體式顯微鏡 (日本尼康公司);CSW-DZ01倒置熒光顯微鏡 (德國徠卡公司);QuantStudio 5 實時熒光定量PCR 儀 (美國Thermo Fisher 公司)。
1.3 試驗方法
1.3.1 急性毒性測試 將斑馬魚成魚(雌雄比例1 : 1)在產卵前1 晚置于育種缸中進行黑暗處理,第2 天早上抽掉缸中隔板,使其在強光刺激下開始交配。交配后1 h 采集胚胎,用胚胎培養液清洗3 次,置于28 ℃恒溫培養箱內。將受精后6 h 的斑馬魚胚胎分別暴露于質量濃度分別為0、0.05、0.1、0.2、0.4、0.8、1.6 和3.2 μg/mL 的氯氟醚菊酯藥液中后,記錄胚胎暴露72 h 的死亡情況。
將受精后6 h 的斑馬魚胚胎分別暴露于0、0.2、0.4、0.8 μg/mL 的氯氟醚菊酯藥液中,每24 h 記錄心率 (每分鐘跳動次數,bpm)。于48 h 和72 h統計并計算孵化率。
1.3.2 心血管毒性評估 基于本課題組先前的研究,靜脈竇-動脈球 (SV-BA) 的間距和心包面積被勾勒出,以測量心包水腫的嚴重程度[13]。Tg(kdrl:EGFP)斑馬魚的胚胎分別經0、0.2、0.4、0.8 μg/mL的氯氟醚菊酯藥液暴露72 h 后,使用PBS 清洗3 次,并用5 mg/L 的三卡因麻醉,而后在共聚焦顯微鏡下采集圖像,使用NIS 軟件進行圖像分析,通過心臟部位的熒光強度和心房與心室的面積評估氯氟醚菊酯對斑馬魚仔魚的心臟毒性;通過腸下靜脈的血管排列情況評價氯氟醚菊酯對仔魚的血管毒性。
1.3.3 與氧化應激相關的酶活性檢測 為了評估分別暴露于0、0.2、0.4、0.8 μg/mL 氯氟醚菊酯藥液72 h 胚胎的氧化應激水平,檢測了與氧化應激有關的抗氧化酶 (SOD、CAT、GSH-Px) 活性以及丙二醛 (MDA) 和ROS 的含量水平,通過檢測心臟部位的熒光強度評價藥物對胚胎心臟的毒性效應。
每組收集30 枚胚胎,隨機取樣,在暴露72 h后用PBS 清洗3 次,并在冰上勻漿,根據先前的研究報告,使用試劑盒測定SOD、CAT、GSH-Px的酶活性和MDA 的含量水平,使用DCFH-DA 探針檢測在藥液中暴露72 h 后斑馬魚仔魚的活性氧水平[17]。經不同濃度的氯氟醚菊酯藥液處理斑馬魚胚胎72 h 后,用PBS 洗滌3 次,之后用5 mL ROS 檢測液 (20 μmol/L DCFH-DA) 在28 ℃黑暗條件下孵育30 min。隨后,用PBS 清洗仔魚3 次。最后,使用倒置熒光顯微鏡捕捉整個仔魚的實時圖像。
1.3.4 病理學切片 為了評估斑馬魚心臟的組織病理學變化,進行了蘇木精伊紅 (hematoxylin-eosin,HE) 染色。將暴露于0、0.2、0.4、0.8 μg/mL 的氯氟醚菊酯藥液72 h 的野生型AB 斑馬魚仔魚在4%多聚甲醛溶液、4 ℃環境下固定過夜。然后用HE染色進行組織學觀察。于體式顯微鏡下采集圖像。
1.3.5 RNA 提取和實時熒光定量PCR 用TRIzol試劑提取0、0.2、0.4、0.8 μg/mL 的72 hpf (hours post fertiliation, 受精后小時)仔魚 (每組約30 尾)的總RNA。通過qRT-PCR 檢測凋亡基因的表達水平,包括心肌蛋白標記基因myl7、心肌細胞轉錄因子myh6和心室早期發育標記基因vmhc。
引物由賽維爾公司合成,引物序列如表1 所示。qRT-PCR 反應體系根據2 × Universal Blue SYBR Green qPCR Master Mix 試劑盒(G3326)開展,實時熒光定量PCR 儀的反應運行程序為:①95 ℃預變性30 s;②95 ℃變性15 s,60 ℃退火10 s,72 ℃延伸30 s,40 個循環;③熔解曲線程序:95 ℃,15 s;60 ℃,1 min;95 ℃,20 s,步進0.15 ℃/s。以β-actin為內參,用2-ΔΔCt法計算目的基因的表達水平[13]。
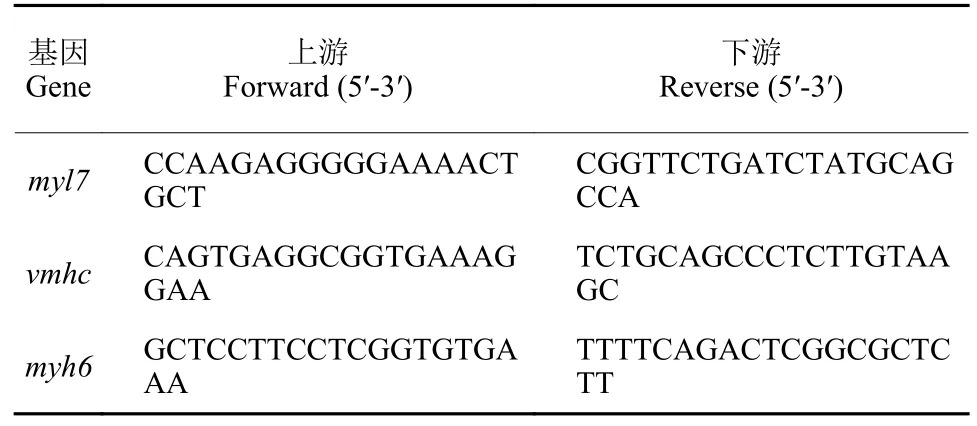
表1 引物序列Table 1 Primer sequences
1.3.6 統計學分析 實驗數據的統計以3 個重復為單位,采用SPSS 25.0 計算機程序 (IBM 公司,美國紐約) 進行。分析結果以平均值 ± 標準差(SD) 表示。顯著性概率水平設定為顯著差異*,P≤ 0.05;極顯著差異**,P≤ 0.01。
2 結果與分析
2.1 急性毒性
根據不同濃度檢測終點統計到的死亡率數據,利用OriginPro 2023b 統計學軟件繪制了“濃度-致死率”效應曲線,如圖1 所示,并擬合得到了氯氟醚菊酯對斑馬魚的72 h-LC50值為0.756 μg/mL,95%置信區間為0.724~1.003 μg/mL。根據急性毒性結果,選擇LC50值作為最高濃度,故將藥液暴露質量濃度設置為0、0.2、0.4、0.8 μg/mL。
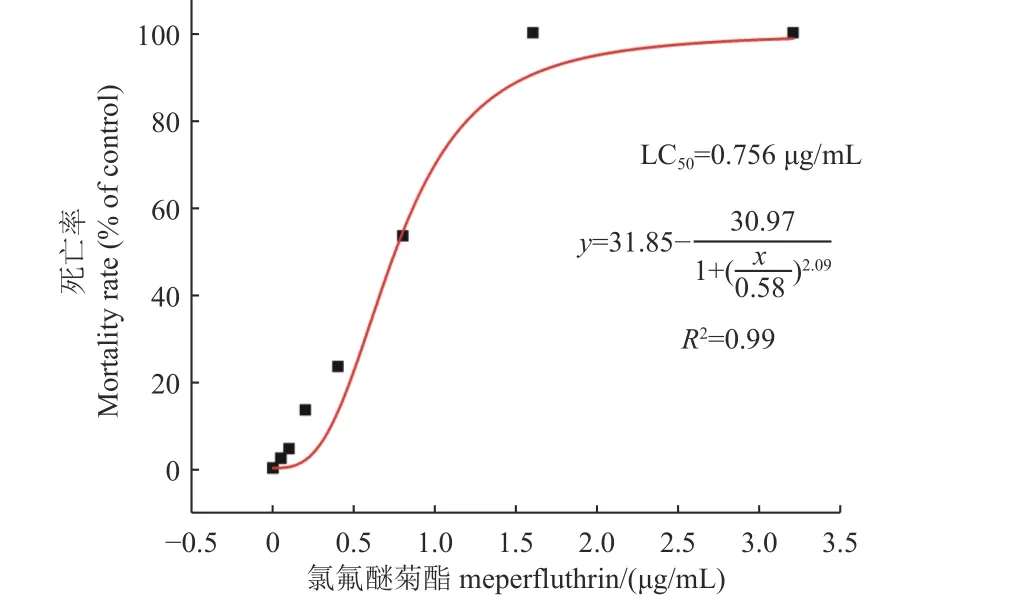
圖1 氯氟醚菊酯對斑馬魚胚胎-仔魚的致死率(72 h)Fig.1 Mortality of meperfluthrin to zebrafish embryo-larvae (72 h)
2.2 氯氟醚菊酯對斑馬魚胚胎的發育毒性
2.2.1 氯氟醚菊酯誘導斑馬魚胚胎的發育畸形
將6 hpf 的斑馬魚胚胎在不同質量濃度的氯氟醚菊酯中急性暴露72 h,每24 h 進行一次表型觀察,結果發現,斑馬魚胚胎從24 h 開始出現不同程度的畸形特征,包括脊柱彎曲、尾部彎曲、心包水腫或卵黃囊腫大 (圖2A),其中0.4 和0.8 μg/mL劑量暴露組的致畸率顯著,卵黃囊腫大的畸形占比最高 (圖2B)。
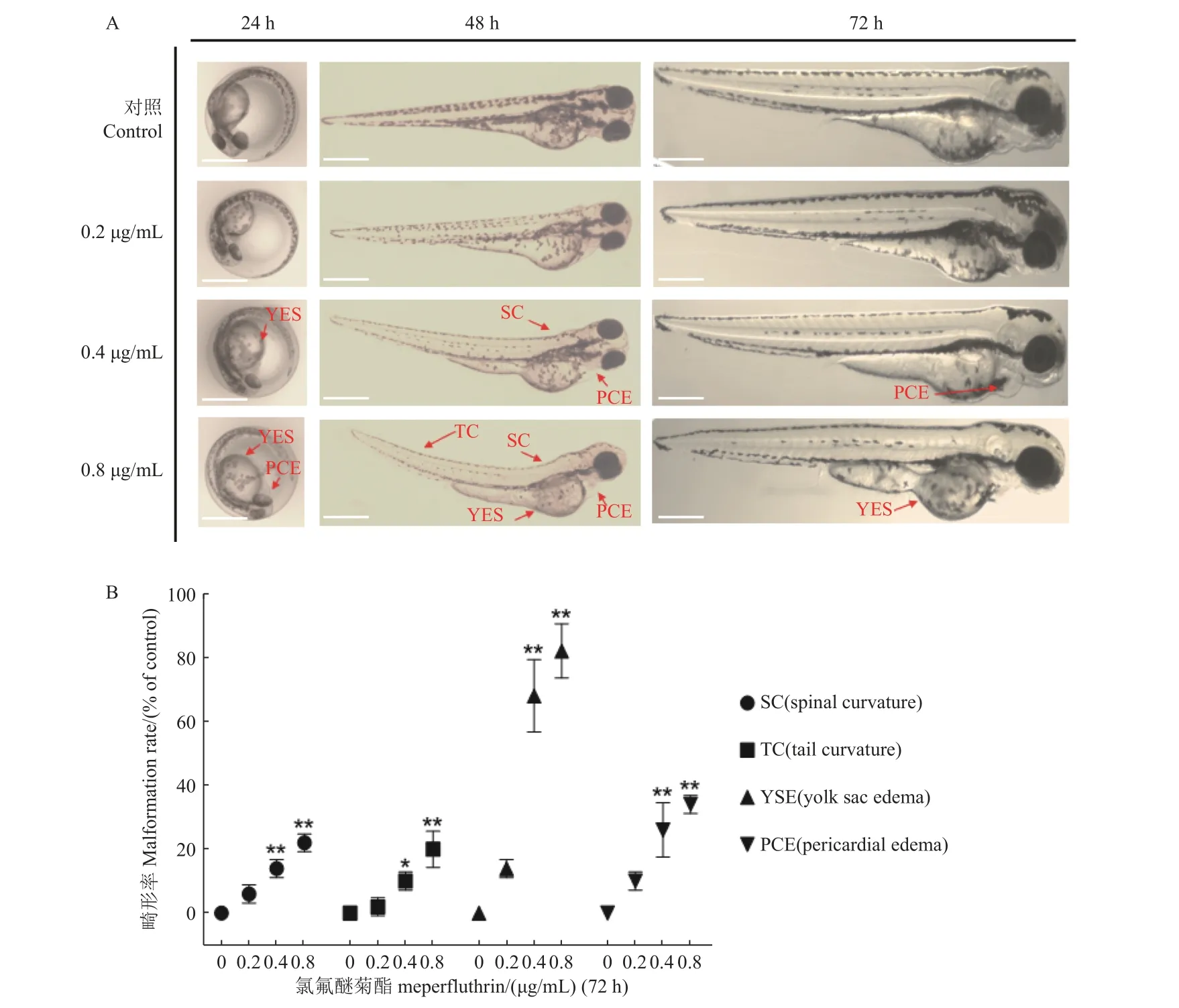
圖2 A.氯氟醚菊酯誘導斑馬魚產生脊柱彎曲 (SC)、尾部彎曲 (TC)、卵黃囊腫大 (YSE)和心包水腫 (PCE) 等畸形現象;B.氯氟醚菊酯對斑馬魚的畸形率統計Fig.2 A.Meperfluthrin induced malformations including spinal curvature (SC), tail curvature (TC), yolk sac edema (YSE),and pericardial edema (PCE) in zebrafish; B.Statistical analysis of malformation rate in zebrafish induced by meperfluthrin
2.2.2 氯氟醚菊酯對斑馬魚胚胎及仔魚的發育毒性 斑馬魚胚胎暴露于梯度質量濃度的氯氟醚菊酯24、48 和72 h 后,其心率與對照組相比被顯著抑制 (圖3A),其中48 h 的心率最高。如圖3B 所示,0.2 μg/mL 的氯氟醚菊酯對斑馬魚胚胎的孵化率沒有影響,但在0.4 和0.8 μg/mL 劑量暴露組中,48 hpf 的斑馬魚胚胎孵化顯著延遲,72 hpf 的胚胎孵化不受暴露液質量濃度的影響,這可能是因為48 hpf 的胚胎各項機能發育不完善,免疫力較弱,難以抵御藥劑的作用。由圖3C 可以看出,0.4 和0.8 μg/mL 的劑量組,斑馬魚仔魚的體長明顯縮短。此外,隨著氯氟醚菊酯質量濃度的增大,斑馬魚仔魚眼部和頭部面積出現顯著減小(圖3D、3E)。說明氯氟醚菊酯的暴露延緩了斑馬魚胚胎的早期發育。

圖3 氯氟醚菊酯誘導斑馬魚胚胎的發育毒性Fig.3 Developmental toxicity induced by meperfluthrin in zebrafish embryos
2.3 氯氟醚菊酯對斑馬魚仔魚的心臟毒性
2.3.1 氯氟醚菊酯誘導斑馬魚仔魚心臟線性化采用HE 染色觀察斑馬魚仔魚心臟的組織病理學變化,結果 (圖4) 表明,與對照相比,0.2、0.4 和0.8 μg/mL 的氯氟醚菊酯處理使斑馬魚仔魚心臟的心室擴大和線性化 (白色箭頭指示),說明氯氟醚菊酯損害了斑馬魚仔魚心臟的發育形態。

圖4 氯氟醚菊酯對斑馬魚心臟組織的影響(72 h)Fig.4 Effects of meperfluthrin on zebrafish heart tissue (72 h)
2.3.2 氯氟醚菊酯對斑馬魚仔魚心臟SV-BA 間距的影響 測量藥物暴露后的斑馬魚仔魚的SVBA 間距和心包面積發現,與對照相比,暴露于0.2、0.4 和0.8 μg/mL 的氯氟醚菊酯的仔魚呈現SV-BA間距顯著加寬 (圖5B) 和心包面積增大 (圖5C) 的現象,并具有濃度依賴性。
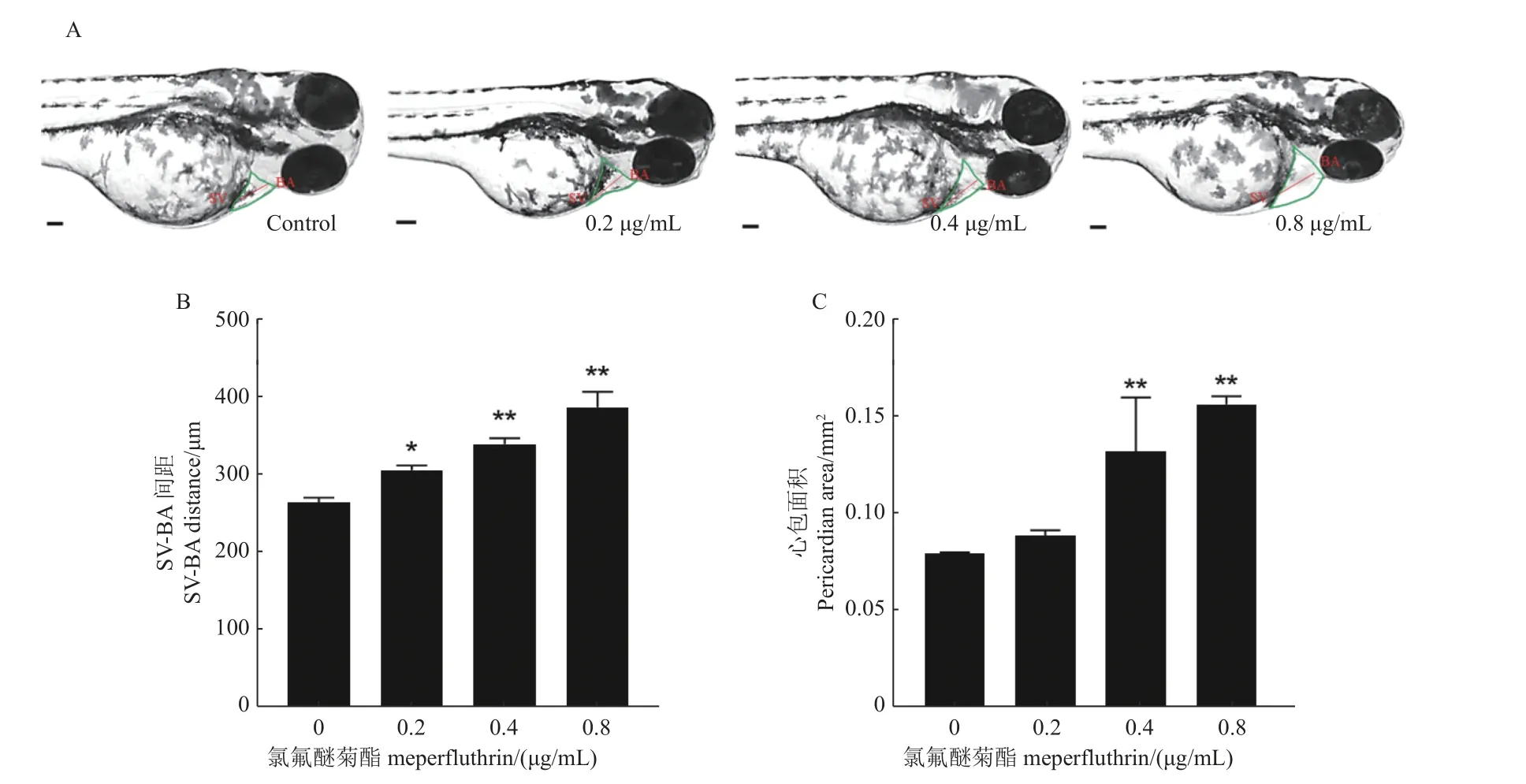
圖5 氯氟醚菊酯對斑馬魚仔魚心臟的SV-BA 間距 (B) 和心包面積 (C) 的影響(72 h)Fig.5 Effect of meperfluthrin on cardic SV-BA spacing (B) and pericardial area (C) on zebrafish larvae (72 h)
2.3.3 氯氟醚菊酯誘導斑馬魚心臟的心房心室分化 斑馬魚的心臟是脊椎動物胚胎中第一個發育成熟并具有生理功能的器官,由心房和心室兩個腔室組成[18-19]。若心臟受到影響,心房和心室的位置將發生改變,SV-BA 距離也會發生相應的改變。本研究結果發現,經3 個劑量的氯氟醚菊酯處理72 h,斑馬魚仔魚的心房和心室發生分化 (圖6),并且隨著藥劑質量濃度的增加,心房和心室間距較未處理組相比加大,這正好驗證了HE 染色和SV-BA 的結果。

圖6 氯氟醚菊酯暴露對斑馬魚仔魚心房心室位置的影響(72 h)Fig.6 Effect of meperfluthrin exposure on the position of the atria and ventricles of zebrafish larvae hearts (72 h)
2.3.4 氯氟醚菊酯誘導斑馬魚心臟的基因表達失調myl7在斑馬魚的心房和心室中表達,與其心肌細胞增殖等生理過程密切相關;myh6是與斑馬魚心臟發育有關的重要基因;vmhc是最早標記心室的標記基因[20]。如圖7 所示,斑馬魚胚胎暴露于3 個氯氟醚菊酯處理組72 h 后,與對照相比,myl7、myh6和vmhc的表達量均隨著藥劑質量濃度的增加而顯著降低。說明氯氟醚菊酯可能通過降低myl7、myh6和vmhc基因的表達而損傷心肌細胞的功能,從而產生對斑馬魚心臟的毒性。
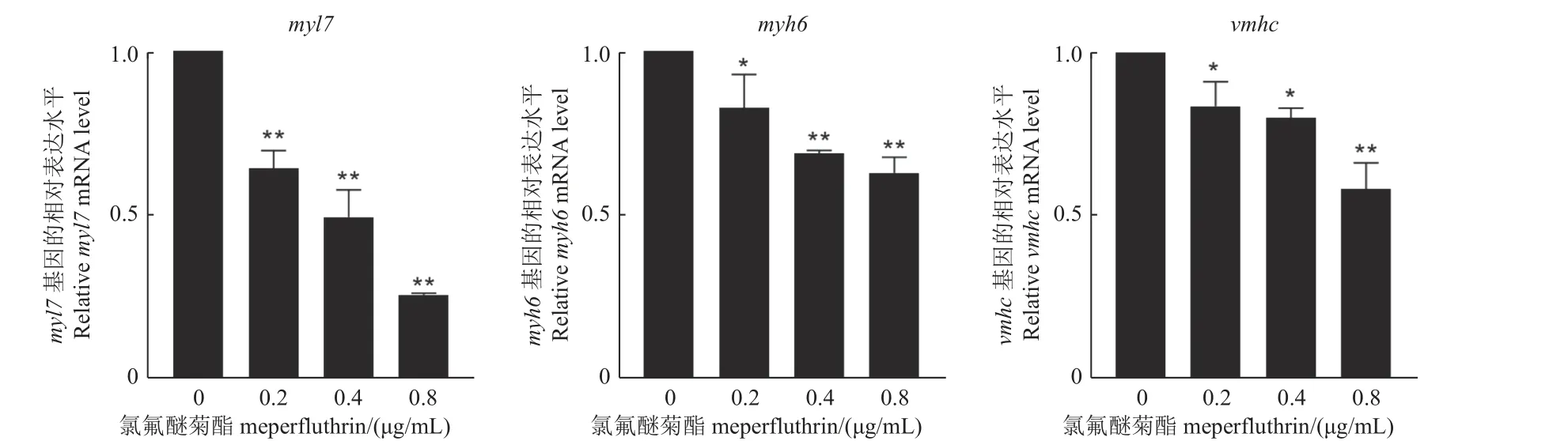
圖7 暴露于氯氟醚菊酯的斑馬魚心臟發育相關的基因表達水平(72 h)Fig.7 Expression levels of genes associated with cardiac development in zebrafish exposed to meperfluthrin (72 h)
2.4 氯氟醚菊酯對斑馬魚仔魚血管的毒性
2.4.1 氯氟醚菊酯對斑馬魚心臟部位血管發育的影響 采用6 hpf 的轉基因斑馬魚胚胎進行藥劑暴露,發現與對照相比,經0.2、0.4 和0.8 μg/mL 的氯氟醚菊酯處理的斑馬魚仔魚心臟部位的血管發育不完全 (圖8),說明氯氟醚菊酯會導致斑馬魚仔魚心臟的血管出現發育缺陷。
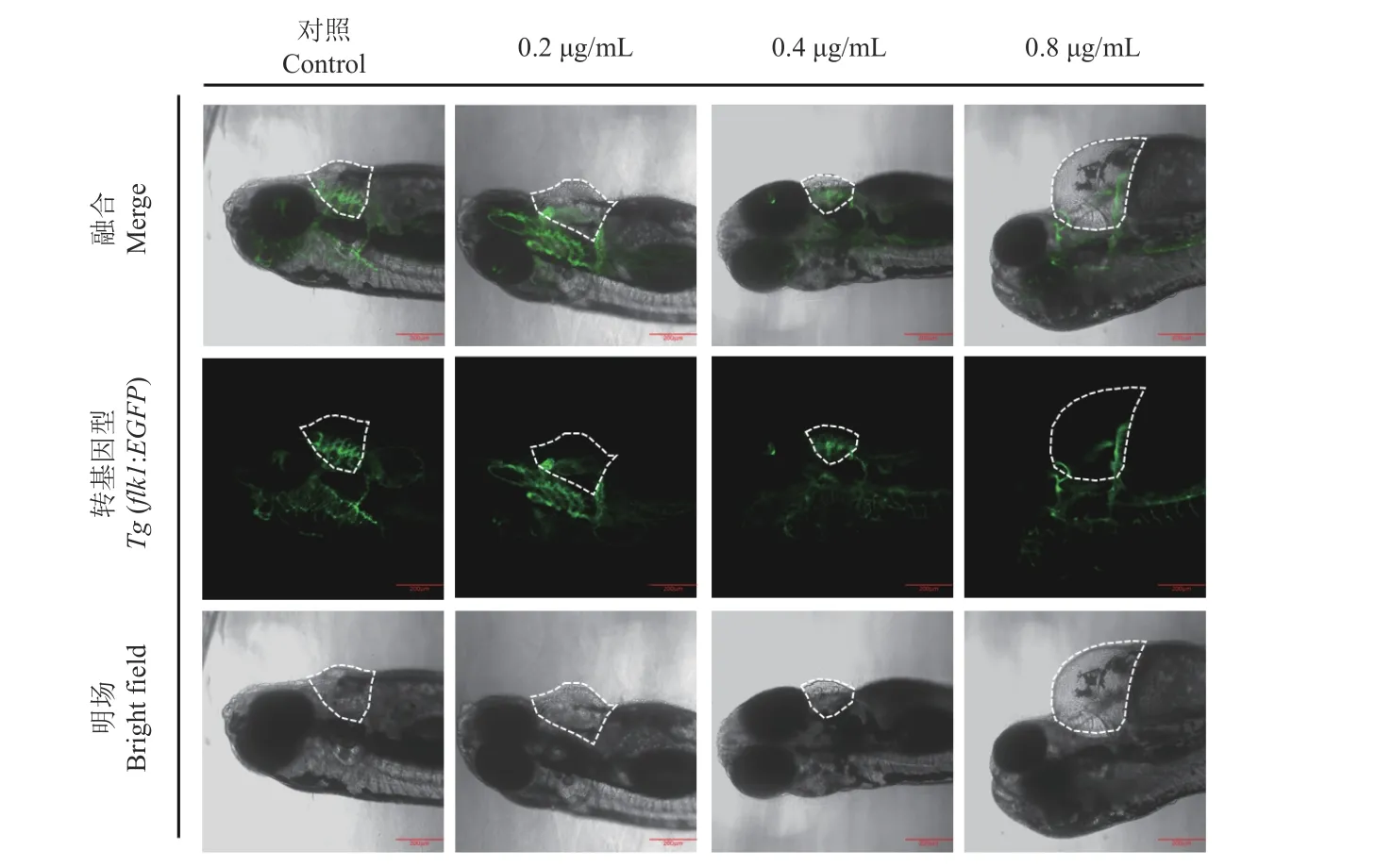
圖8 氯氟醚菊酯暴露對斑馬魚仔魚心臟血管發育的影響Fig.8 Effect of meperfluthrin exposure on zebrafish larvae cardiac vascular development
2.4.2 氯氟醚菊酯誘導斑馬魚腸下靜脈發育缺陷
將經藥劑處理72 h 的斑馬魚仔魚置于玻璃皿中,于共聚焦顯微鏡下采集圖像。結果表明,與對照相比,處理組的腸下靜脈排列雜亂,分布不均勻 (圖9)。說明0.2、0.4 和0.8 μg/mL 的氯氟醚菊酯處理胚胎72 h 后引起了斑馬魚腸下靜脈發育異常。
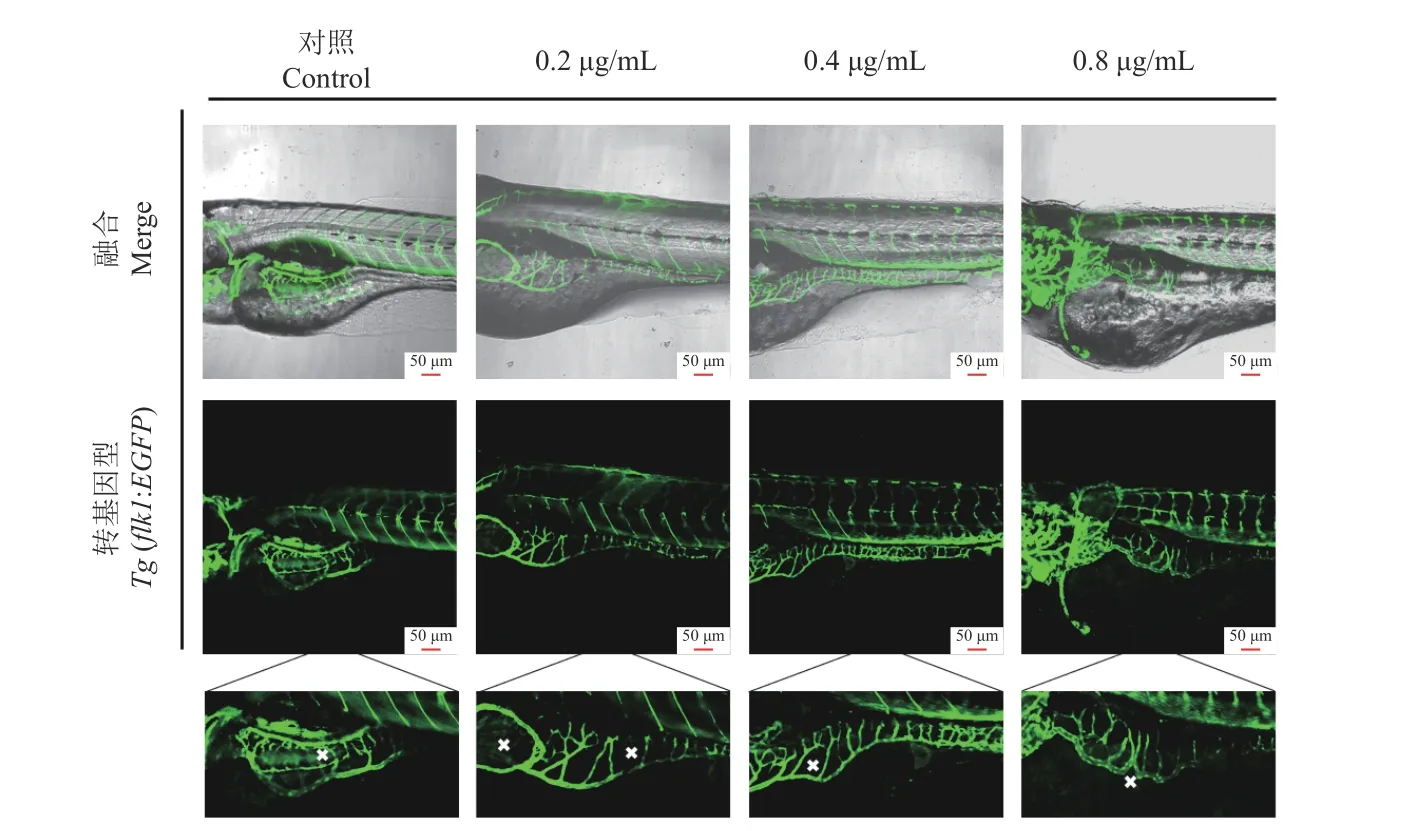
圖9 氯氟醚菊酯誘導對斑馬魚腸下靜脈的影響(72 h)Fig.9 Effect of meperfluthrin induction on zebrafish subintestinal veins (72 h)
2.5 氯氟醚菊酯對斑馬魚的氧化應激效應
2.5.1 氯氟醚菊酯誘導斑馬魚心臟產生ROS 本研究結果表明,與對照相比,氯氟醚菊酯處理組誘導了斑馬魚仔魚心臟處ROS 產生,并且這種現象呈現劑量依賴性 (圖10A 和10B),說明氯氟醚菊酯誘導斑馬魚的心臟毒性可能是通過氧化應激這一途徑。
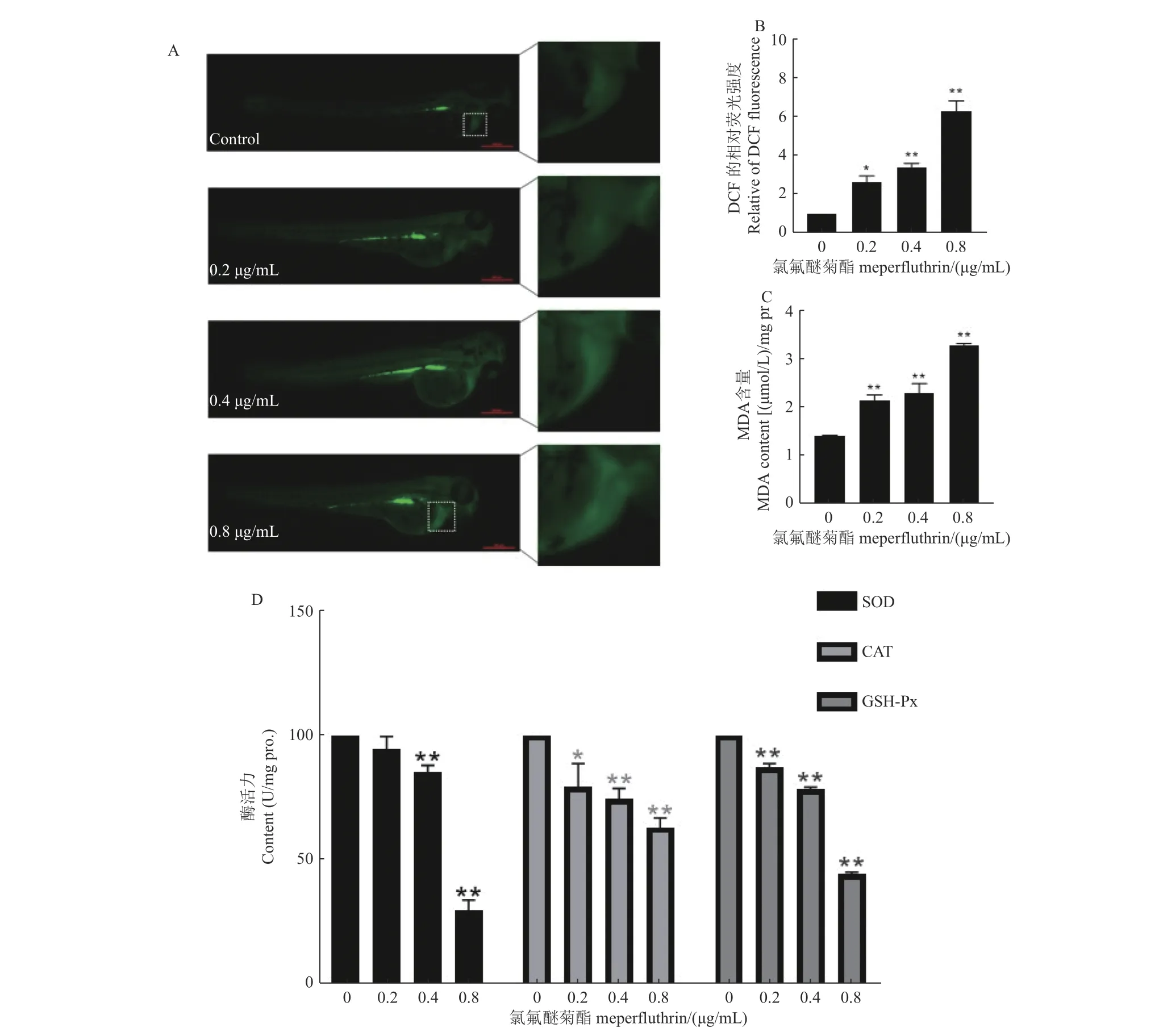
圖10 氯氟醚菊酯對斑馬魚氧化應激的影響(72 h)Fig.10 Effect of meperfluthrin on oxidative stress in zebrafish (72 h)
2.5.2 氯氟醚菊酯對MDA 含量的影響 6 hpf 的斑馬魚胚胎在不同質量濃度的氯氟醚菊酯中暴露72 h 后,與對照組相比,0.2、0.4、0.8 μg/mL 的暴露組中斑馬魚仔魚的MDA 含量均顯著增加(P均≤0.05) (圖10C),說明氯氟醚菊酯促進了斑馬魚體內MDA 的產生,可能引起其的氧化應激效應。
2.5.3 氯氟醚菊酯對抗氧化防御系統相關酶的影響 經過72 h 的氯氟醚菊酯暴露后,與對照組相比,0.4 和0.8 μg/mL 的暴露組中3 種酶的活性均顯著下降,其中最高濃度處理組的SOD 和GSHPx 的酶活性分別僅占對照組的29.87%和44.36%(圖10D),說明氯氟醚菊酯暴露引起了斑馬魚抗氧化防御系統的崩潰,使得過量的ROS 無法被清除而導致氧化損傷。
3 結論與討論
氯氟醚菊酯是目前市場上銷量最大的衛生用殺蟲劑品種之一,它的環境安全風險受到了廣泛關注。本研究通過研究氯氟醚菊酯急性暴露對斑馬魚胚胎發育的影響,尤其是對其心血管系統發育的影響,評價了氯氟醚菊酯的環境安全風險和毒理學特征。
斑馬魚的胚胎期是其生命周期中最重要的時期之一,早期發育過程相對快速且容易觀察[21]。將斑馬魚胚胎暴露于四溴菊酯,發現四溴菊酯會導致斑馬魚的心血管發育異常和紅細胞生成障礙等,同時胚胎還發生了氧化應激現象[22]。本研究結果表明,暴露于氯氟醚菊酯的斑馬魚胚胎出現了不同程度的畸形 (圖2A),在0.4 和0.8 μg/mL的氯氟醚菊酯下暴露72 h 的斑馬魚畸形特征尤為顯著,并且卵黃囊水腫的畸形率最高 (圖2B)。這可能是因為卵黃囊是由蛋白質和脂質組成的透明囊泡,是為斑馬魚的早期發育提供營養和支持的,其在受精卵形成后不久就開始退化變薄,蛋白質和脂質逐漸被胚胎吸收和利用,此時卵黃囊對外界污染物的抵抗能力下降,更易遭受氯氟醚菊酯的脅迫。此外,氯氟醚菊酯的暴露會造成斑馬魚胚胎及仔魚的早期發育毒性,如心率變化、體長變短、頭眼發育缺陷等,這可能導致斑馬魚對外界刺激的反應受損。
斑馬魚已被廣泛用作研究心臟發育、評估心臟結構和功能、探索毒性機制以及進行藥物篩選等研究的可信賴的模式生物[23]。Park 等的研究表明,衛生用菊酯類殺蟲劑聯苯菊酯對斑馬魚胚胎最顯著的病理誘導特征是心臟水腫[24]。SV-BA 間距可反映斑馬魚心房和心室的位置變化,通過在體式顯微鏡下測量SV-BA 間距可判斷受試化合物對心臟的影響[25]。與對照相比,暴露于氯氟醚菊酯72 h 的斑馬魚仔魚心臟的SV-BA 間距顯著增大,心房心室出現明顯分化,這可能是由于氯氟醚菊酯誘導斑馬魚心臟發育異常,導致心腔變形,從而引起壓力改變,使得SV-BA 間距受到影響。心臟形態學結果顯示,暴露于氯氟醚菊酯的斑馬魚仔魚的心包面積與對照相比也顯著增加(圖4、圖5B)。myl7、myh6、vmhc分別調節心肌收縮、維持心肌結構和推動血液泵出,共同確保斑馬魚心臟的正常功能和循環系統的穩定[26]。在心臟分化過程中,早在14 節段期就可以在前側板中胚層中觀察到肌球蛋白基因的表達,并且在少數細胞中開始表達myl7,它與肌球蛋白重鏈 (如myh6) 相互作用,形成心肌纖維的骨架[27]。vmhc主要參與心肌的收縮過程,推動血液從心室排出[28]。這3 種基因的表達失調說明斑馬魚的心肌細胞在氯氟醚菊酯誘導后功能受損 (圖7),這可能與觀察到的心臟缺陷和心包水腫有關。這些結果表明,氯氟醚菊酯分別從發育、結構和功能等方面對斑馬魚的心臟造成了嚴重損傷。
有研究表明,聯苯菊酯可通過抑制斑馬魚胚胎發育過程中的血管生成而抑制器官發育,其機制可能與腸道氧化應激和炎癥反應有關[24]。本研究結果表明,氯氟醚菊酯可誘導斑馬魚心臟部位的血管發育異常 (圖8),這說明氯氟醚菊酯暴露可能影響了斑馬魚血管的運輸功能,導致心臟無法正常供血,進而影響心臟發育。這可能也是氯氟醚菊酯引起斑馬魚心臟毒性的原因之一,并且這一毒性可能是通過氧化應激實現的。斑馬魚的腸下靜脈在胚胎發育中涉及到血液循環、營養吸收、免疫功能和器官發育等功能,氯氟醚菊酯的暴露影響了腸下靜脈的均勻排列,與對照相比靜脈血管出現分支,排列雜亂 (圖9),說明氯氟醚菊酯誘導斑馬魚產生了不可逆的血管毒性,對其進行研究有助于深入了解與斑馬魚胚胎發育相關的疾病和畸形的形成機制[29]。
擬除蟲菊酯類殺蟲劑,如氯氰菊酯可能會增加活性氧的產生,影響抗氧化酶的活性,從而導致氧化應激,引起細胞內的炎癥反應,進而導致代謝紊亂等[30-31]。氧化應激是導致機體組織產生病理表現的關鍵因素,心血管、肝臟等疾病都與活性氧 (ROS) 密切相關[32]。ROS 是重要的細胞信號分子,但過量的ROS 產生可能會導致氧化應激和細胞損傷,導致不可逆轉的細胞凋亡和死亡[33]。同時氧化應激可誘導細胞脂質過氧化,破壞細胞膜的完整性,產生具有高活性的MDA[34],這可能影響細胞內的信號傳遞,導致細胞凋亡、氧化應激和DNA 損傷等不良效應[35],而魚類的抗氧化防御機制用來對抗氧化應激和脂質過氧化。有研究稱,家用菊酯類殺蟲劑炔丙菊酯和四氟苯菊酯等均能誘導斑馬魚抗氧化酶的變化,增加脂質過氧化和氫過氧化物[36]。本研究也表明,氯氟醚菊酯誘導斑馬魚心臟部位產生了過量的ROS (圖10A),同時SOD、CAT、GSH-Px 等抗氧化酶的活性也因藥物作用而減少 (圖10B),MDA 含量顯著增加(圖10C),這導致了氧化應激的加劇,使細胞遭受不可逆轉的損傷,最終影響器官和組織的功能。
本研究使用斑馬魚為模型對氯氟醚菊酯的毒理學效應進行了探究。結果表明,氯氟醚菊酯對斑馬魚胚胎的72 h-LC50值為0.756 μg/mL;氯氟醚菊酯急性暴露引起了斑馬魚胚胎及仔魚的發育毒性 (心率變緩、孵化率降低、頭眼發育缺陷、體長縮短) 和器官畸形 (心包水腫、卵黃囊腫大、脊柱和尾部彎曲);心血管毒性 (心臟線性化、SVBA 間距增大、心房和心室分化、血管發育不完全) 和氧化應激效應 (ROS 產生過量,MDA 含量增加,抗氧化酶活性降低)。本研究揭示了衛生殺蟲劑氯氟醚菊酯的環境風險及毒性效應,初步闡明了氯氟醚菊酯誘導斑馬魚胚胎及仔魚心臟毒性發生的潛在機制;研究結果增進了氯氟醚菊酯的毒理學認識,有利于促進環境友好型衛生殺蟲劑的開發和使用。

