創傷性中樞神經系統損傷后腸道屏障變化及其可能機制的研究進展
王芳芳,朱莉,幸佳佳,龐日朝,茍翔,張安仁
1.610075 四川省成都市,成都中醫藥大學養生康復學院
2.610083 四川省成都市,中國人民解放軍西部戰區總醫院康復醫學科
3.200434 上海市,同濟大學附屬上海市第四人民醫院康復醫學科
創傷性中樞神經系統損傷主要包括創傷性腦損傷(traumatic brain injury,TBI)和脊髓損傷(spinal cord injury,SCI),常發生于高空墜落、交通事故和暴力事件,其高致殘率和復雜多樣的并發癥嚴重影響著患者的生活質量[1-2]。由于創傷性中樞損傷后神經修復存在復雜微環境及再生調節機制,目前尚未從根本上突破治療瓶頸[3]。然而隨著美國國立衛生研究院(NIH)“人類微生物組計劃”和歐盟“人類腸道宏基因組歐洲計劃”的展開,越來越多研究發現“腸-腦軸”是連接腸道和中樞的信息交換網絡,腸道微生物群在調節中樞神經系統疾病過程中發揮重要作用[4]。創傷性中樞神經損傷后可能導致腸道微環境紊亂,如腸道微生物群失衡、腸道通透性增加、胃腸黏膜損傷等,經常并發不同程度的急性胃腸道功能障礙[5-6]。并且近年來,大量研究提示腸道微環境可以作為創傷性中樞神經系統損傷嚴重程度的診斷以及疾病治療的重要作用靶點[6]。
研究表明,腸道微環境主要由腸道微生物群及腸黏膜細胞等構成,可參與機體物質代謝和免疫調節,然而微環境的穩態建立在腸道微生物群(微生物屏障)、腸道黏液層(化學屏障)、腸道上皮細胞(機械屏障)及腸道免疫細胞(免疫屏障)的微妙平衡之上[7]。因此,本文以此為著眼點展開綜述,系統描述創傷性中樞神經損傷后腸道各個屏障的結構和功能變化(圖1)及其與中樞的雙向作用,并對致使腸屏障破壞的可能機制進行闡述,為將來腸道微環境在創傷性中樞神經系統損傷性疾病的臨床診治及進一步研究提供一定參考。
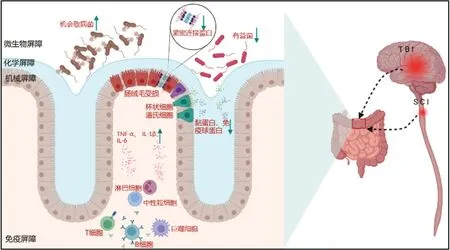
圖1 創傷性中樞神經損傷后腸道屏障的變化Figure 1 Changes of intestinal barrier after traumatic central nervous system injury
1 文獻檢索策略
以“Traumatic central nervous system injury,Traumatic brain injury,Spinal cord injury,Intestinal microbiota,Intestinal epithelial barrier,Intestinal mucosal barrier,Intestinal immune barrie”為英文關鍵詞檢索PubMed、Medline、Web of Science;以“創傷性中樞神經系統損傷、創傷性腦損傷、脊髓損傷、腸道微生物群、腸道機械屏障、腸道黏膜屏障、腸道免疫屏障”為中文關鍵詞檢索中國知網、萬方數據知識服務平臺、維普網以及中國生物醫學文獻服務系統。檢索時間為建庫至2023-04-01。納入標準:已發表的文獻;排除標準:數據信息少、重復發表、無法獲得全文或者質量差的文獻。最終納入文獻54篇。
2 腸道微生物屏障
腸道微生物群是定植在消化道中的微生物集合,位于管腔表面,是人體不可或缺的“微生物器官”,其不僅可以促進營養物質的消化與吸收,還可以通過競爭營養、釋放抗菌物質以及占據附著部位來提高對有害細菌和病原體的抵抗力,促進腸道健康,是腸道的微生物屏障[8-9]。研究表明,腸道微生物群及其代謝產物可以通過神經、體液以及淋巴途徑影響中樞神經系統,調節神經系統正常發育,如血-腦脊液屏障形成、髓鞘生成、神經發生和小膠質細胞成熟等[10-11]。創傷性中樞神經系統損傷后腸道微生物群穩態失衡,反過來,紊亂的腸道微生物群可能是導致機體繼發性損傷加重的重要誘因[12]。
臨床及臨床前研究均發現,創傷性中樞神經損傷后腸道微生物群發生紊亂,表現為有益菌減少而致病菌富集。具體地,意大利學者BAZZOCCHI等[13]招募100名SCI患者,將其與年齡和性別相匹配的健康人的腸道微生物群分布做比較,得出SCI患者有多個菌科出現差異富集,如腸桿菌科(8.3%∶0.5%)、疣微菌科(7.2%∶0.4%),而產生短鏈脂肪酸的瘤胃球菌科(15.5%∶23.6%)顯著減少。國內學者對SCI患者腸道微生物群分析發現,腸道微生物群失調與SCI后運動功能障礙的損傷持續時間和嚴重程度以及免疫功能抑制密切相關[14-15]。同樣地,研究者在TBI患者入院后0、3、7 d采集其直腸微生物樣本發現,變形菌門中致病菌腸桿菌科是最大的類群[16]。在動物實驗中,KANG等[17]對T8~T10創傷性SCI小鼠腸道菌群分析得出,SCI后腸道微生物群紊亂嚴重,其中包括促炎細菌(如志賀菌、擬桿菌、葡萄球菌和黏液螺旋菌)顯著增加,抗炎細菌(如乳酸桿菌、異體菌和薩特菌)減少。另外,YANG等[18]發現相較于假手術組,TBI小鼠模型在造模后7 h條件致病菌如乳酸梭菌、擬桿菌和鏈球菌顯著生長,并出現細菌易位至肺部誘發肺部感染。反過來,紊亂的腸道微生物群可能加劇中樞神經炎癥。ZHENG等[19]將TBI小鼠紊亂的腸道微生物群定植到正常小鼠腸道,發現正常小鼠在糞菌移植后28 d出現海馬小膠質細胞的持續激活,這表明TBI后腸道微生物群失調可誘發小膠質細胞長期活化介導的神經炎癥。多項研究也提示,腸道微生物群及其代謝產物可以作為中樞損傷嚴重程度及部分并發癥的生物標志物。比如,研究表明SCI后,腸道微生物群代謝產物可以通過血脊髓屏障進入中樞系統,引起神經炎癥,其中L-亮氨酸、L-蛋氨酸及L-苯丙氨酸等在激活SCI后氧化應激和炎癥反應中起到關鍵作用[17]。HE等[20]表明菌群代謝產物短鏈脂肪酸可以減輕脊髓小膠質細胞介導的炎癥反應,對SCI神經恢復至關重要,而SCI后短鏈脂肪酸含量顯著下降。另外,TARASKINA等[21]表明TBI會改變腸道微生物的組成,而改變的微生物通過各組細菌代謝產物影響著TBI嚴重程度、神經可塑性和代謝途徑。
綜上所述,創傷性中樞神經系統損傷可以導致腸道微生物屏障破壞,腸道微生物群穩態失衡,而腸道微生物群的改變反過來又可作為中樞損傷的生物標志物,可以反饋和改變中樞損傷的恢復。這也提示,腸道微生物群可以作為監測創傷性中樞神經損傷患者病情變化以及預防繼發性損傷的重要靶點。
3 腸道化學屏障
腸道黏液層富含黏蛋白、消化酶、抗菌肽和免疫球蛋白等,是覆蓋在腸上皮細胞表面的黏液屏障,可以塑造腸道微生物群的組成,調節吸收和分泌功能以及腸道通透性,并且可防止管腔微生物群與上皮表面直接接觸,形成腸道的化學屏障[22]。作為腸道微環境穩態的重要調控者,在創傷性中樞神經系統損傷后,黏液層相關成分發生變化,破壞腸道穩態,進一步影響中樞局部損傷恢復。
黏蛋白是腸上皮杯狀細胞主要的分泌物,其與腸腔內一些物質及水混合形成黏液凝膠,是宿主抵御腸道內容物的第一道防線[23]。HOULDEN等[24]研究結果顯示,TBI小鼠模型造模后72 h,盲腸杯狀細胞數量以及其黏蛋白的表達相較于假手術組顯著降低。溶菌酶是腸道潘氏細胞分泌的重要物質,對腸道病原菌的傳播和擴散有抑制作用。然而,TBI小鼠在損傷后3 d與假手術組小鼠相比較,潘氏細胞中的溶菌酶水平顯著降低[18]。此外,分泌免疫球蛋白A(secretory immunoglobulin A,SIgA)的漿細胞可以轉移到大腦進而對中樞神經系統發揮神經保護作用;ZHOU等[25]研究表明,腦損傷后腸道黏液層黏蛋白2(mucin 2,MUC2)和SIgA的表達顯著降低。腸道黏液層黏蛋白水平的變化與腸道健康以及對感染的易感性密切相關。
綜上所述,腸道黏液層可以通過分泌黏蛋白以及抗菌物質來維持腸道穩態。然而創傷性中樞神經系統損傷后腸道化學屏障功能受到影響,黏蛋白以及相關抗菌蛋白分泌水平降低可致使微環境穩態失衡,進而導致細菌或內毒素穿過腸屏障而增加感染易感性以及加劇中樞繼發性損傷。
4 腸道機械屏障
腸道機械屏障位于黏液層下,由排列在絨毛突起和隱窩凹陷中的單層上皮細胞組成,包括負責營養吸收的腸細胞、分泌黏蛋白的杯狀細胞、分泌激素的腸內分泌細胞、分泌抗菌肽的潘氏細胞以及其他功能尚未清楚的細胞[25]。腸上皮的完整性和上皮細胞間的緊密連接是維持腸屏障功能的重要因素。然而,創傷性中樞神經系統損傷后,腸道機械屏障被破壞,黏膜通透性增加,機械屏障受損可導致機體電解質紊亂、細菌易位、全身炎癥反應、多器官功能衰竭等后果,進一步增加死亡率,延長住院時間[26]。報道指出,許多重型顱腦創傷患者死于多器官功能障礙綜合征,而非腦創傷本身[27]。
緊密連接是腸上皮細胞之間的重要連接,形成防止腸道細菌和毒素移位的重要網絡,已被證明與腸道屏障完整性密切相關。JING等[10]研究結果顯示,SCI小鼠相較于假手術組其結腸中帶狀閉合蛋白1(ZO-1)和閉鎖蛋白(occludin)等緊密連接蛋白表達顯著減少,腸道機械屏障完整性遭到破壞。相似地,LIU等[28]在SCI大鼠模型中也發現腸道微觀病理改變如腸絨毛受損,腸毛細血管充血以及腸隱窩深度增加,同時閉合蛋白1(claudin-1)和鈣黏蛋白E(E-cadherin)的表達顯著降低。腸道緊密連接蛋白或其調節因子的表達或活性改變會導致腸道對大分子的通透程度改變[26]。同樣,TBI后也發生了腸道上皮細胞凋亡,進而導致腸道通透性增加,LIU等[29]指出TBI造模會導致大鼠腸上皮細胞通透性增高,這與緊密連接蛋白ZO-1和occludin的表達減少有關,并且腸道通透性增高可能與腦損傷后誘導的腸道氧化應激 ERK/Nrf2/HO-1信號通路有關。DUAN等[30]則對不同損傷分級的TBI大鼠造模24 h后處死發現,大鼠腸絨毛上皮細胞發生不同程度的腫脹變性而致絨毛廣泛剝脫塌陷,而腦損傷程度與腸黏膜損傷以及腸道功能障礙程度呈正相關。
綜上所述,創傷性中樞神經系統損傷會導致腸道上皮細胞及緊密連接受損,腸道通透性增加,腸機械屏障遭到破壞。并且,腸道機械屏障的損傷可能會增加細菌與內毒素易位的風險,引發多器官功能障礙或膿毒血癥的發展。
5 腸道免疫屏障
人體內約70%的免疫細胞位于胃腸道,形成腸道相關淋巴組織(Gut-associated lymphoid tissue,GALT),其主要包括Peyer氏斑、腸系膜淋巴結、分離的淋巴濾泡、淋巴細胞和抗原提呈細胞[31]。彌漫性GALT包括上皮內淋巴細胞和固有層中的淋巴細胞。大多數上皮內淋巴細胞是CD8+T細胞,其不斷地監測和響應管腔細菌和其他抗原;固有層中包括T細胞、B細胞、樹突狀細胞(DC)和巨噬細胞在內的各種免疫細胞,通過呈遞抗原、產生抗體和分泌細胞因子來協調免疫反應[32]。腸道免疫主要是一種先天免疫反應,其關鍵成分包括模式識別受體和抗菌肽,形成腸道的免疫屏障[33]。創傷性中樞神經系統損傷后腸道屏障的損傷會直接觸發腸道先天性免疫反應。
KIGERL等[34]則通過流式細胞術分析得出,SCI誘導的腸道生態失調可以激活GALT中的免疫細胞,其中B淋巴細胞、CD8+T淋巴細胞、DC細胞和巨噬細胞數量增加,并且腫瘤壞死因子α(TNF-α)、白介素1β(IL-1β)、轉化生長因子β(TGF-β)等炎癥因子表達也顯著增加。OUYANG等[35]研究也顯示,SCI大鼠相較于假手術組腸道中炎癥因子IL-1β、TNF-α及核因子κB(NF-κB)表達顯著升高。腸道的免疫細胞通過分泌炎癥因子可能會進一步加重中樞炎癥損傷。例如RONG等[36]研究顯示,SCI后結腸中TLR-4/MyD88炎癥信號通路的激活可以加劇脊髓小膠質細胞介導的中樞繼發性炎癥反應。另有研究表明,SCI后損傷局部膠質細胞產生的趨化因子及其受體可誘導外周白細胞、淋巴細胞和巨噬細胞等免疫細胞遷移至中樞,從而加劇炎癥級聯反應[37]。相似地,MIAO等[38]發現TBI大鼠模型相較于假手術組,結腸中CD3+細胞、CD4+和CD8+T細胞、CD45+細胞和CD103+細胞的比例顯著升高,其與繼發性肺部感染呈正相關。HU等[39]發現TBI大鼠在造模后40 h,空腸組織中CD40蛋白水平、NF-κB DNA結合活性顯著升高,并且空腸IL-1β和TNF-α的濃度也顯著增加。另外,TBI急性期會導致腸道功能障礙,損傷的腸道會釋放炎癥因子如TNF-α、IL-1β、白介素6(IL-6)和趨化因子在腦實質、腦脊液以及血清中的表達顯著增加,引起了一系列以神經膠質細胞激活、血-腦脊液屏障破壞、炎性因子和趨化因子釋放為特征的繼發性炎癥級聯反應[40]。
以上研究表明,創傷性中樞神經系統損傷后,腸道穩態受到破壞,腸道免疫作為機體先天性免疫的一道防線隨即做出反應,腸道免疫細胞可能被中樞膠質細胞產生的趨化因子募集,通過 “腸-腦軸”作用于中樞損傷局部,可進一步加重中樞繼發性炎癥損傷。
綜上所述,創傷性中樞神經系統損傷后可導致腸道屏障結構和功能破壞,使得腸道微環境紊亂,而紊亂失衡的腸道微環境又可反作用于中樞,加重中樞的繼發性損傷。腸道屏障作為中樞損傷后的重要一環,致使其破壞的背后機制值得探索。
6 創傷性神經系統損傷致腸屏障破壞的相關機制
6.1 營養不良
創傷性中樞神經系統損傷后,患者機體易出現營養狀況不良的現象。FLURY等[41]對252名SCI患者進行營養不良風險篩查,發現62%的患者在受傷后3個月有營養不良的風險,并且對臨床結局有明顯的負面影響。同樣,研究表明,腦損傷后機體分解代謝亢進會導致蛋白質消耗和能量需求較前增加4%,而早期患者營養支持不足會導致患者出現營養不良,進而增加并發癥的發生率[42]。KWAK等[43]研究表明,物理性腸營養不良會導致腸道黏膜厚度以及腸杯狀細胞數量顯著減少進而使得腸道黏膜屏障受損。PATTERSON等[44]則表明腸道營養不良可以導致腸道微生物群紊亂,機會致病菌腸桿菌科顯著擴張,盲腸和結腸腸道屏障功能障礙,這些均可加劇細菌及內毒素脂多糖易位,誘發炎癥反應。在營養不良的狀態下,腸道內各種消化酶分泌減少,其化學性殺菌作用減弱使得腸道內異源細菌過度繁殖,這可能會引起腸道微生物屏障穩態失衡[45]。此外,患者由于早期禁食,營養物質的缺失可能會使得腸黏膜萎縮,對腸屏障功能造成損害。
綜上所述,創傷性神經損傷后機體營養物質需求量增加而實際補充不足可能造成患者營養狀況較差,腸營養的不足可能會導致腸道屏障功能障礙,如腸道黏膜結構破壞,腸道微生物群發生紊亂等。
6.2 缺血再灌注損傷
創傷性中樞神經系統損傷發生后,機體處于顯著應激狀態常發生低血容量休克,胃腸道血流量顯著減少會導致腸黏膜出現缺血缺氧,血流再灌注則會加重腸黏膜氧化應激損傷和屏障功能障礙。BESECKER等[5]研究結果顯示,T3-SCI大鼠損傷急性期后出現內臟灌注不足,腸系膜上動脈血流量顯著減少,這些與腸道形態異常和炎癥標志物升高相吻合。另有研究發現,SCI后全身血液的重新分布導致腸道缺血和缺氧,這也擾亂了緊密連接蛋白的表達,增加了腸道通透性,導致腸道屏障受損,細菌和內毒素從腸道轉移到血液中,引起腸源性全身感染和敗血癥,嚴重影響了患者的病情[46]。另外,LIU等[6]研究表明,SCI大鼠術后3 d腸屏障通透性顯著增加,腸屏障緊密連接蛋白顯著降低,脂多糖更易通過腸屏障進入外周循環;其后續研究發現,SCI大鼠在術后3 d腸道氧化應激標志物丙二醛(malondialdehyde,MDA)升高,而超氧化物歧化酶(super oxide dismutase,SOD)、谷胱甘肽酶(glutathione,GSH)等抗氧化應激的酶活性顯著降低,顯示腸黏膜缺血或再灌注導致腸道氧化應激的發生。在TBI的相關研究中也有相似的發現,QIN等[47]研究結果顯示,TBI大鼠空腸組織氧化應激水平相關因子如活性氧(reactive oxygen species,ROS)和脂質過氧化物(lipid peroxide,LPO)明顯增加而抗氧化因子SOD表達下降,證實TBI后腸道存在顯著氧化應激損傷。
綜上所述,創傷性中樞神經損傷后,機體由于創傷應激常會出現內臟灌注不足,腸黏膜缺血缺氧及再灌注損傷會引發腸道氧化應激,這些均會導致腸道屏障通透性增加以及屏障破壞加重。
6.3 炎性反應
中樞創傷性損傷后,先天免疫系統作為第一道防線首先做出反應,其中巨噬細胞、中性粒細胞、樹突狀細胞、自然殺傷細胞和γδT細胞參與了對中樞損傷的先天免疫反應[48]。腸道免疫屬于先天免疫,而免疫細胞的激活會導致NF-κB、TNF-α、IL-1β、一氧化氮和血小板激活因子等炎癥介質的釋放,可能引起腸道黏膜損傷。多項動物研究結果顯示,TBI后腸道促炎因子IL-1β、TNF-α和IL-6等表達顯著增加,腸道組織出現炎癥浸潤[49-50]。在SCI大鼠損傷模型中也有相似發現,OUYANG等[35]研究結果表明SCI大鼠相較于假手術組其腸道IL-1β、TNF-α和NF-κB蛋白表達顯著升高。TNF-α是作用于緊密連接蛋白而引起腸道高通透性的核心因素,其可與腸上皮細胞上的TNF-α受體結合,激活多條途徑,如NF-κB途徑,上調IL-1β和IL-6的基因表達,從而增加緊密連接的通透性[51]。
綜上所述,創傷性中樞神經損傷后引發一系列免疫反應,腸道作為先天性免疫的重要器官,在損傷早期免疫細胞激活介導的炎癥反應會加劇,炎癥因子會進一步損傷腸道黏膜結構,致使腸道屏障破壞。
6.4 神經遞質與激素釋放
研究表明,創傷性中樞神經損傷后腎上腺髓質和交感神經末梢釋放大量兒茶酚胺,導致全身交感神經興奮性增強,引起內臟血管痙攣,腸黏膜血流量減少,腸黏膜屏障受損[52-53]。神經肽Y(neuropeptide Y,NPY)是一種多肽類神經遞質,廣泛分布于中樞和外周神經系統,在交感神經連接處與去甲腎上腺素同時發揮作用。DUAN等[30]研究結果顯示,TBI大鼠血漿中NPY濃度與空腸NPY基因和蛋白表達同步升高,而NPY水平升高可能是造成腸黏膜結構損傷的重要因素。此外,多巴胺是重要的神經遞質,廣泛存在于神經系統和周圍組織中,消化道也含有許多多巴胺能細胞,而神經系統中的多巴胺能神經元興奮會導致多巴胺釋放到突觸間隙,這可能會減少胃腸道的血液供應,并破壞腸道黏膜屏障[54]。
綜上所述,中樞神經創傷性損傷可能引發神經內分泌系統的一系列反應,進而通過神經遞質和激素釋放等體液調節方式作用于外周,調節腸道血流供應,影響腸道屏障功能。
7 小結與展望
綜合上述分析,創傷性中樞神經系統損傷可能導致腸道微生物屏障、化學屏障、機械屏障和免疫屏障的功能障礙,而腸道微環境穩態是建立在這些屏障的微妙平衡基礎之上,腸道微環境的失衡則可反作用于中樞,進一步加重中樞繼發性損傷以及其他并發癥,而中樞創傷性損傷導致的腸道屏障功能障礙可能涉及多種機制,如中樞損傷后腸道營養供應不足、腸黏膜缺血再灌注損傷、炎性改變以及神經遞質與激素的釋放等。
隨著對“腸-腦軸”及其雙向作用的研究深入,中樞系統疾病發生后的腸道已經成為研究人員關注的熱點及重要靶點。創傷性中樞損傷引起的腸道屏障功能障礙不僅可以影響患者腸道的功能,引發胃腸道并發癥,而且還能夠反饋中樞的病理情況,影響中樞神經功能的恢復。腸屏障功能障礙涉及多種機制,針對不同機制的靶向干預可能保護腸屏障功能,進而有助于減輕中樞的繼發性損傷。然而目前對創傷性中樞神經損傷后腸屏障功能障礙的發生率尚不清楚,特別是針對SCI后腸屏障的研究甚少,確切的發病機制仍待進一步闡明,因此確切有效的靶向干預仍然有限。未來的臨床及基礎研究可更多地關注創傷性中樞損傷后的腸道屏障,并對其機制做更加深入探索。
作者貢獻:王芳芳提出研究選題方向,進行論文的構思與設計、文獻及資料的整理,并撰寫論文初稿;朱莉、幸佳佳負責檢索和匯總文獻及資料;茍翔對初稿進行修訂;龐日朝、張安仁負責論文的質量控制及審校,對論文整體負責;所有作者確認了論文的最終稿。
本文無利益沖突。

