新輔助化療聯(lián)合靶向治療治療HER-2陽性乳腺癌患者獲得病理完全緩解的影響因素
林司杭 關(guān)家裕 周文斌
1.暨南大學(xué)第二臨床醫(yī)學(xué)院,廣東深圳 518020;2.深圳市人民醫(yī)院乳腺外科,廣東深圳 518020
乳腺癌是全球發(fā)病率位居第一位的癌癥,也是女性中最常見的腫瘤之一。人表皮生長因子受體2(human epidermal growth factor receptor 2,HER-2)陽性是乳腺惡性腫瘤高度惡性標(biāo)志之一,預(yù)后較HER-2陰性乳腺癌差,其腫瘤生物學(xué)行為特征為惡性程度高、總生存期和無病生存期短及遠(yuǎn)處轉(zhuǎn)移率和病死率高[1]。HER-2是目前乳腺癌新輔助治療的重要靶點(diǎn),新輔助化療可以縮小乳腺癌原發(fā)病灶的大小,實(shí)現(xiàn)腫瘤降期,為手術(shù)創(chuàng)造有利條件,提高腫瘤切除率和保乳率。新輔助化療聯(lián)合曲妥珠單抗及帕妥珠單抗可以進(jìn)一步使HER-2陽性乳腺惡性腫瘤獲得病理完全緩解(pathological complete response,pCR),提高患者的生存率及預(yù)后[2]。pCR是臨床醫(yī)生評(píng)估乳腺癌患者新輔助治療效果的可靠預(yù)后指標(biāo),達(dá)到pCR的患者較未達(dá)到pCR的患者無病生存時(shí)間、總生存時(shí)間均顯著延長且遠(yuǎn)期生存率更高[3]。但臨床也有相當(dāng)一部分患者未能達(dá)到pCR,故獲得pCR的影響因素值得探討。本研究回顧性分析深圳市人民醫(yī)院(本院)乳腺外科HER-2陽性乳腺癌患者新輔助化療聯(lián)合靶向治療的相關(guān)臨床資料,分析影響pCR的因素,為后續(xù)臨床診治提供相關(guān)依據(jù)。
1 資料與方法
1.1 一般資料
回顧性分析2018年1月1日至2023年4月1日于本院乳腺外科接受新輔助化療的209例HER-2乳腺癌患者的相關(guān)臨床資料。參考《中國乳腺癌新輔助治療專家共識(shí)(2022年版)》[4],納入標(biāo)準(zhǔn):①活檢穿刺病理結(jié)果確診為浸潤性乳腺癌;②標(biāo)本免疫組化檢測(cè)回報(bào)為HER-2+++/++,同時(shí)熒光原位雜交(fluorescence in situ hybridization,F(xiàn)ISH)為陽性;③患者接受≥4個(gè)周期的新輔助化療聯(lián)合靶向治療,靶向治療方案為曲妥珠單抗聯(lián)合帕妥珠單抗雙靶治療或曲妥珠單抗單靶治療;④患者同意手術(shù)治療并且有完整的臨床資料。排除標(biāo)準(zhǔn):①患者臨床相關(guān)資料不完善;②乳腺癌男性或患有雙側(cè)乳腺癌;③未接受完整的新輔助治療;④首診為Ⅳ期乳腺癌。本研究經(jīng)本院醫(yī)學(xué)倫理委員會(huì)批準(zhǔn)(倫理審批號(hào):LL-KY-2023097-01)。
1.2 方法
收集患者相關(guān)臨床數(shù)據(jù)包括確診年齡、乳腺癌的臨床分期、組織學(xué)分型、新輔助化療方案、靶向治療方案、激素受體(hormone receptor,HR)狀態(tài)、HER-2表達(dá)水平和Ki-67百分比及術(shù)后病理等。
1.3 實(shí)驗(yàn)室結(jié)果判定
根據(jù)第八版美國癌癥分期聯(lián)合委員會(huì)(American Joint Committee on Cancer,AJCC)乳腺癌分期系統(tǒng)來明確乳腺癌原發(fā)灶臨床分期、區(qū)域淋巴結(jié)的臨床分期及腫瘤總體分期[5]。根據(jù)乳腺癌的核分裂數(shù)、細(xì)胞核多形性及腺管形成程度的總評(píng)分將組織學(xué)分級(jí)分為Ⅰ級(jí)、Ⅱ級(jí)和Ⅲ級(jí)。HR陽性即孕激素受體(progesterone receptor,PR)和/或雌激素受體(estrogen receptor,ER)陽性。
參考2020版美國病理學(xué)家協(xié)會(huì)(College of American Pathologists,CAP)及美國臨床腫瘤協(xié)會(huì)(American Society of Clinical Oncology,ASCO)激素受體實(shí)驗(yàn)室檢測(cè)指南[6],HER-2陽性定義為免疫組化為+++/++,并且FISH檢測(cè)為陽性,意味著乳腺浸潤癌細(xì)胞膜著色強(qiáng)、完整和均勻,其比例>10%;++為HER-2不確定,意味著乳腺浸潤癌細(xì)胞膜著色弱-中等強(qiáng)度,其比例>10%;0/+為HER-2陰性,意味著乳腺浸潤癌細(xì)胞膜無染色或著色微弱和不完整。HER-2免疫組化結(jié)果為不確定時(shí)需額外進(jìn)行FISH實(shí)驗(yàn)室檢測(cè)。FISH陽性即平均HER-2拷貝數(shù)≥6.0且HER-2/CEP17<2.0或平均HER-2拷貝數(shù)≥4.0且HER-2/CEP17≥2.0;FISH陰性即HER-2平均拷貝數(shù)<4.0且HER-2/CEP17比值<2.0。ER和PR檢測(cè)結(jié)果為陰性即乳腺癌腫瘤細(xì)胞核染色比例小于1%,弱陽性即腫瘤細(xì)胞核染色比例為1%~10%,陽性則為腫瘤細(xì)胞核染色≥10%。Ki-67以14%為界,分為≤14%組和>14%組。
pCR的定義為乳腺的原發(fā)病灶無浸潤性癌并且區(qū)域淋巴結(jié)為陰性(ypT0/TisN0M0),即Miler-Payne分級(jí)系統(tǒng)中的MP5級(jí)且淋巴結(jié)陰性,或殘余腫瘤負(fù)荷(residual cancer burden,RCB)評(píng)估系統(tǒng)中的RCB 0級(jí)[7]。
1.4 統(tǒng)計(jì)學(xué)處理
使用SPSS 21.0統(tǒng)計(jì)學(xué)軟件進(jìn)行數(shù)據(jù)處理,計(jì)數(shù)和等級(jí)資料用[n(%)]表示,采用χ2檢驗(yàn)或秩和檢驗(yàn),將差異有統(tǒng)計(jì)學(xué)意義的變量納入多因素分析。通過二分類logistic回歸模型進(jìn)行pCR相關(guān)的多因素分析。評(píng)價(jià)指標(biāo)采用OR和95%CI表示,P< 0.05為差異有統(tǒng)計(jì)學(xué)意義,從而得到獨(dú)立相關(guān)指標(biāo)。
2 結(jié)果
2.1 患者臨床病理特征及pCR率
經(jīng)納入及排除標(biāo)準(zhǔn)篩選后,本研究共納入209例患者,其中205例(98.09%)患者病理類型為浸潤性導(dǎo)管癌,其余4例為浸潤性小葉癌。患者年齡26~77歲,平均(48.95±9.34)歲。T1期10例(4.78%),T2期154例(73.68%),T3期35例(16.75%),T4期10例(4.78%)。N0期62例(29.67%),N1期114例(54.54%),N2期19例(9.09%),N3期14例(6.70%)。209例患者中獲得pCR共93例,總體pCR率為44.50%。
2.2 影響新輔助化療治療后獲得pCR的單因素分析
結(jié)果顯示HR陰性組、HER-2 +++組、雙靶治療組、組織學(xué)分型Ⅲ級(jí)組的pCR率分別高于HR陽性組、HER-2 ++且FISH陽性組、單靶治療組、組織學(xué)分型Ⅰ/Ⅱ組,差異有統(tǒng)計(jì)學(xué)意義(P< 0.05)。腫瘤的組織學(xué)分型、靶向治療方案、HR狀態(tài)及HER-2表達(dá)水平是影響pCR的關(guān)聯(lián)因素。同時(shí),乳腺癌確診年齡、絕經(jīng)狀態(tài)、乳腺癌原發(fā)灶臨床分期、區(qū)域淋巴結(jié)的臨床分期、總體臨床分期、Ki-67狀態(tài)及新輔助化療方案對(duì)pCR率無顯著影響(P> 0.05)。見表1。
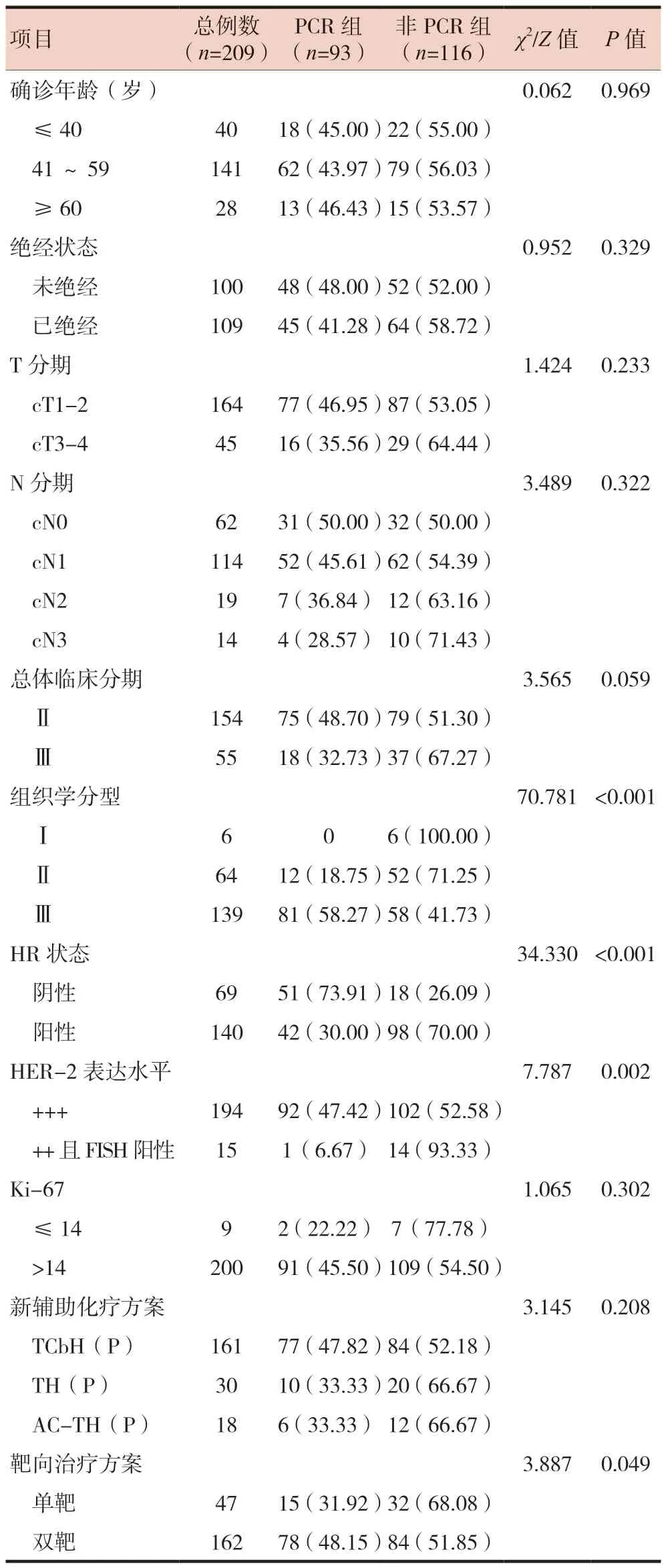
表1 影響HER-2陽性乳腺癌患者新輔助治療后獲得pCR的單因素分析[n(%)]
2.3 影響新輔助化療治療后獲得pCR的多因素分析
結(jié)果顯示影響pCR率的獨(dú)立預(yù)測(cè)因素有HR狀態(tài)(OR=3.859,95%CI:1.930~7.717,P< 0.001)、HER-2表達(dá)水平(OR=7.964,95%CI:0.918~69.065,P=0.048)及靶向治療方案(OR=0.432,95%CI:0.186~1.002,P=0.049),其中接受雙靶治療方案、腫瘤HR陰性及HER-2 +++乳腺癌患者更容易獲得pCR。見表2~3。

表2 多因素分析變量賦值表

表3 HER-2陽性乳腺癌各因素與pCR的關(guān)系多因素logistic回歸分析
3 討論
曲妥珠單抗等靶向藥物的廣泛應(yīng)用極大改善了HER-2陽性乳腺癌患者的預(yù)后,但目前對(duì)于新輔助化療聯(lián)合靶向治療的HER-2陽性乳腺癌患者達(dá)到pCR的預(yù)測(cè)因素尚不明確。因此,本研究探討靶向聯(lián)合化療對(duì)HER-2陽性乳腺癌獲得pCR的影響因素,以期為臨床醫(yī)生預(yù)測(cè)患者是否可獲得術(shù)后pCR提供參考。
HER-2陽性乳腺癌臨床及生物學(xué)存在異質(zhì)性,故不同類型患者治療獲益程度也存在差異。HR狀態(tài)是影響新輔助化療獲益的一項(xiàng)重要因素。本研究結(jié)果顯示HER-2陽性乳腺癌HR陰性較HR陽性患者更容易在新輔助化療后達(dá)到pCR(P< 0.001),與國外臨床試驗(yàn)結(jié)果一致[8]。研究表明,HER-2陽性患者對(duì)新輔助化療的敏感性因HR狀態(tài)而異[9]。HR陽性乳腺癌患者低pCR率可能與HER-2受體與HR受體之間相互干擾有關(guān),導(dǎo)致對(duì)HER-2治療藥物有耐藥性。其次HER-2與HR之間的交叉通路逃逸機(jī)制也可能是低pCR率的重要原因[10]。
本研究結(jié)果表明,HER-2 +++組的pCR率高于HER-2 ++且FISH陽性組,差異有統(tǒng)計(jì)學(xué)意義(P=0.002),表明HER-2呈高表達(dá)水平是HER-2陽性乳腺癌患者在新輔助化療聯(lián)合靶向治療中獲得pCR的獨(dú)立預(yù)測(cè)因子。這意味著HER-2表達(dá)程度越高越容易從新輔助化療聯(lián)合靶向治療中獲益,可能與靶向藥物如曲妥珠單抗介導(dǎo)的細(xì)胞毒作用刺激人體免疫殺傷細(xì)胞殺滅癌細(xì)胞相關(guān)[11]。雖然HER-2 ++且FISH陽性組將HER-2結(jié)果判定為陽性,但其pCR率卻遠(yuǎn)不如HER-2 +++組,故臨床行免疫組化及FISH檢測(cè)對(duì)患者預(yù)后顯得格外重要。
本研究中,雙靶治療方案組pCR率高于單靶治療方案組,差異有統(tǒng)計(jì)學(xué)意義(P=0.049),與國外臨床試驗(yàn)結(jié)果一致。曲妥珠單抗聯(lián)合帕妥珠單抗雙靶治療能提高患者pCR率16.8%~17.5%,4年中位無病生存期提高1.7%[12]。兩組pCR率存在差異,可能與曲妥珠單抗和帕妥珠單抗雙靶治療之間的疊加效應(yīng)有關(guān)[13]。二者可介導(dǎo)抗體依賴的細(xì)胞毒效應(yīng),還可以與HER-2陽性腫瘤細(xì)胞外的不同區(qū)域結(jié)合來遏制HER-2的同源和異源的二聚體化,從而阻斷相關(guān)信號(hào)通路[14-15]。
綜上所述,HER-2陽性乳腺癌新輔助化療后獲得pCR與接受雙靶治療方案、腫瘤HR陰性及HER-2呈高表達(dá)水平因素相關(guān)。此外,HER-2陽性乳腺癌患者新輔助化療獲得pCR的獨(dú)立預(yù)測(cè)因子為接受雙靶治療方案、腫瘤激素受體陰性及HER-2呈高表達(dá)水平。這意味著接受雙靶治療方案、腫瘤激素受體陰性及HER-2 +++的HER-2陽性乳腺癌患者更容易在新輔助化療中獲得pCR。由于本研究為單中心回顧性病例對(duì)照研究,研究資料具有局限性且樣本量相對(duì)不足,仍需要大樣本多中心前瞻性研究進(jìn)一步驗(yàn)證指標(biāo)的有效性。另外,本研究在病例搜集時(shí)難免會(huì)存在選擇偏倚,這一點(diǎn)無法與設(shè)計(jì)良好的前瞻性研究相比較。

