急性腦梗死靜脈溶栓后出血轉化影響因素及與腦小血管病的相關性研究
李尚坤 易永杜 梅麗冰
廣東省茂名市中醫院腦病科,廣東茂名 525000
急性腦梗死(acute cerebral infarction,ACI)為腦供血突然中斷致使腦組織局部缺氧、缺血引發的缺血性腦血管病癥,靜脈溶栓為當前臨床治療ACI的重要措施,可恢復腦血管再通,抑制病情進展,發揮重要作用[1]。但部分ACI患者靜脈溶栓后可發生出血轉化(hemorrhagic transformation,HT),其可影響溶栓療效,加劇腦組織損傷程度,甚至可增加病死風險,故明確ACI靜脈溶栓后HT影響因素對指導臨床進行針對性防控具有重要意義[2]。此外,腦小血管病(cerebrovascular disease,CSVD)為全腦小血管疾病,是多種因素影響腦內小靜脈、微靜脈、毛細血管、微動脈和小動脈所引發的綜合征,其發病隱匿,可繼發認知功能障礙、腦卒中等,既往有研究認為CSVD可增加ACI患者HT風險,但尚未得到廣泛證實[3-4]。基于此,本研究對茂名市中醫院(本院)308例ACI患者的臨床資料進行回顧性研究,旨在明確ACI患者靜脈溶栓后HT影響因素及與CSVD的關系。現報道如下。
1 資料與方法
1.1 一般資料
選取2014年1月至2020年5月在本院接受rt-PA靜脈溶栓治療的308例ACI患者的臨床資料進行回顧性研究,根據有無HT分為HT組、無HT組。納入標準:①符合《缺血性卒中基層診療指南(2021年)》[5]中ACI診斷標準,符合《中國腦小血管病診治指南2020》[6]中CSVD診斷標準,經臨床檢查確診;②急診完成靜脈溶栓;③年齡50~70歲;④溶栓后24 h內復查是否發生HT;⑤溶栓后48 h內接受多模MRI檢查;⑥臨床資料完整。排除標準:①存在靜脈溶栓禁忌證者;②既往存在腦卒中后遺癥者;③既往采取顱腦手術治療者。本研究經本院醫學倫理委員會批準。
1.2 方法
回顧性分析所有患者臨床資料,詳細統計性別、年齡、發病至溶栓治療時間、入院時美國國立衛生院神經功能缺損評分(national institutes of health stroke scale,NIHSS)[7]、有無高血壓、有無高脂血癥、有無糖尿病、有無冠心病、急性卒中治療試驗(acute stroke treatment trial,TOAST)分型[8](大動脈粥樣硬化型、心源性栓塞型、小動脈閉塞型等)、國際標準化比值(international normalized ratio,INR)、凝血酶原時間、是否合并房顫、中重度腦白質疏松情況[9][①輕度:低密度區少于白質的1/4,限于腦室前、中、后的腦室周圍區,可見散在的局限性低密度影;②中度:低密度區占腦白質的1/4~1/2,在側腦室前、中、后皮質下白質區可見非融合性或部分融合的低密度影;③重度:低密度區占腦白質的1/2以上,融合成片,累及雙側腦室周圍及皮質下白質區]、抗血栓治療史、CSVD程度。
CSVD評估標準包括以下幾點。①白質高信號(white matter high signal,WMH)。依據Fazekas量表[10],腦室旁高信號評估:無病變為0分,鉛筆樣/帽狀薄層病變為1分,病變為光滑暈圈狀為2分,腦室旁不規則高信號、并延伸至深處白質為3分;深處白質信號評估:無病變為0分,點狀病變為1分,病變逐漸融合為2分,病變廣泛融合為3分;Fazekas評估中腦室旁WMH至3分/深部WMH至2分則計1分。②腦微出血評估。存在微出血為1分。③血管周圍間隙(perivascular space,PVS)評估標準。無擴大PVS為0級,擴大PVS數目不足10個為1級,擴大PVS數目為11~20個為2級,擴大PVS數目為21~40個為3級,擴大PVS數目>40個為4級,基底節PVS為2~4級計1分。④腔隙性腦梗死。存在腔隙性腦梗死計1分。上述評分系統分值范圍0~10分,分值越高CSVD負荷越嚴重,將0~1分為輕度,2分為中度,≥3分為重度。
統計分析本組患者HT情況,靜脈溶栓治療后24 h復查顱腦CT,依據ECASSⅡ標準[9]評估,梗死灶周邊存在少量點狀滲血為出血性梗死(hemorrhagic infarction,HI)-1,梗死周邊存在片狀出血、未見占位效應為HI-2,血腫體積較梗死面積小30%、存在輕度占位效應為腦實質出血(parenchymal hemorrhage,PH)-1,血腫體積較梗死面積大30%、存在明顯占位效應為PH-2;癥狀性顱內出血評估標準:經MRI等檢查可見顱內出血,存在出血相關神經功能惡化,或36 h內病死、存在實質性血腫,或NIHSS分值增高≥4分。
1.3 觀察指標
①統計分析HT發生率;②統計分析不同出血轉化情況患者一般資料;③統計分析ACI患者靜脈溶栓后HT影響因素及與CSVD的關聯性。
1.4 統計學處理
數據處理采用SPSS 22.0統計學軟件,計數資料以例數或[n(%)]描述,采用χ2檢驗;計量資料采取Bartlett方差齊性檢驗與Kolmogorov-Smirnov正態性檢驗,均確認具備方差齊性且近似服從正態分布,以均數±標準差()描述,多組間比較采用單因素方差分析,進一步兩兩組間比較采用LSD-q檢驗,兩組間比較采用獨立樣本t檢驗;影響因素采用logistic回歸分析,檢驗水準α=0.05。P< 0.05為差異有統計學意義。
2 結果
2.1 HT發生率
本研究308例ACI患者中,靜脈溶栓后有82例發生HT(其中HI-1共19例、HI-2共21例、PH-1共17例、PH-2共25例),其余226例未發生HT,HT發生率為26.62%(82/308)。
2.2 不同HT情況患者一般資料比較
不同HT情況患者性別、年齡、有無高脂血癥、有無糖尿病、有無冠心病、INR、TOAST分型、凝血酶原時間比較,差異無統計學意義(P> 0.05);不同HT情況患者發病至溶栓治療時間、入院時NIHSS評分、有無高血壓、是否合并房顫、中重度腦白質疏松情況、抗血栓治療史、CSVD程度比較,差異有統計學意義(P< 0.05)。見表1。
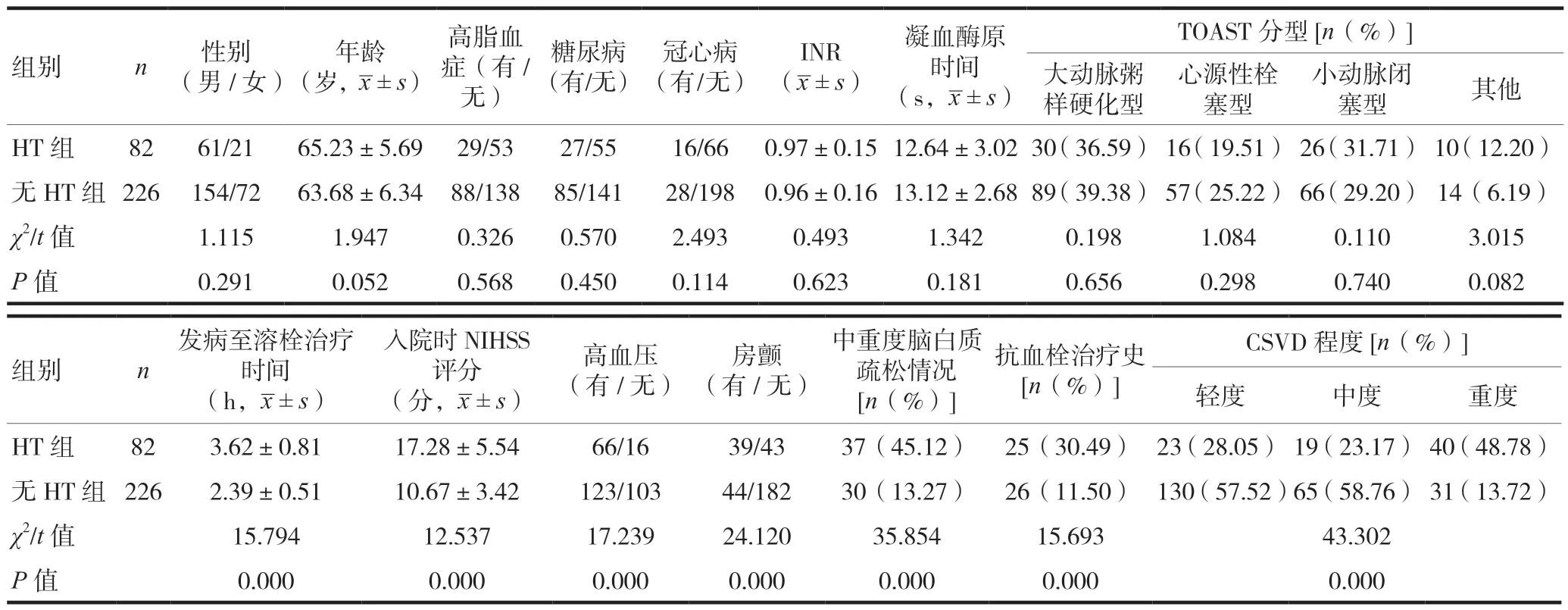
表1 不同出血轉化情況患者一般資料比較
2.3 ACI靜脈溶栓后HT影響因素及與CSVD的關聯性
以ACI靜脈溶栓后發生HT作為因變量,以發病至溶栓治療時間、入院時NIHSS評分、高血壓、合并房顫、中重度腦白質疏松、抗血栓治療史、CSVD程度作為自變量,其賦值情況見表2。將上述指標納入logistic回歸分析模型,發現發病至溶栓治療時間、入院時NIHSS評分、高血壓、合并房顫、中重度腦白質疏松、抗血栓治療史、CSVD程度均是ACI靜脈溶栓后HT的重要影響因素(P< 0.05)。見表3。

表2 賦值表

表3 ACI靜脈溶栓后HT影響因素及與CSVD的關聯性分析
3 討論
HT為ACI靜脈溶栓治療后常見并發癥類型,其致病機制較復雜且可致使病情迅速惡化,甚至病死[11-12]。因此,明確ACI患者靜脈溶栓后發生HT的影響因素具有重要意義,有助于臨床醫師采取針對性診療措施,保證疾病良好轉歸[13]。
本研究結果顯示發病至溶栓治療時間、入院時NIHSS評分、高血壓、合并房顫、中重度腦白質疏松、抗血栓治療史、CSVD程度均是ACI靜脈溶栓后HT的重要影響因素(P< 0.05),分析其原因可能在于:①高血壓能促使微小血管、腦血管硬化,增加破裂出血風險,經靜脈溶栓治療后血壓增高會加劇動脈血管內皮細胞損傷,影響血管內皮完整性,增加血管壁通透性,進而增加HT發生風險;因此,對ACI患者實施治療時應對血壓予以有效調節,并在治療期間密切監測血壓水平。②NIHSS評分是評估ACI患者神經功能損傷程度的重要指標,分值越高梗死面積越廣泛,腦組織缺血壞死后腦水腫對動脈血管產生壓迫,影響血管壁完整性,血管通透性增加,靜脈溶栓治療后缺血再灌注損傷可增加HT發生率;因此治療時應選取適宜的溶栓時機,并在治療前后密切監測NIHSS分值。③發病至溶栓治療時間越長,則腦組織缺血缺氧時間較長,可大量生成氧自由基,損壞腦血管相關膜結構,進而損壞血管壁,增加HT風險;因此,針對發病至入院時間較長者,應在條件允許的前提下最大程度縮短入院至救治時間,從而減少HT生發。④房顫可造成心源性梗死和其他原因所致腦梗死,進而影響疾病干預效果,增加HT風險。⑤抗血栓藥物為ACI患者HT的重要因素,主要是其可影響患者的凝血功能,故臨床應合理、嚴謹地給予抗血栓治療,并在治療期間加強監測。⑥中重度腦白質疏松也是導致ACI患者靜脈溶栓后HT的重要危險因素,主要是此類患者多存在血管內皮功能障礙,深穿支動脈硬化,加之慢性缺血致使灌注不足,可對血管內皮細胞產生不同程度損傷,增加血管通透性,且血管內皮功能障礙可加速血管脂質玻璃樣變性,因此針對中重度腦白質疏松者應慎重選擇靜脈溶栓治療,若選擇靜脈溶栓則應在圍治療期加強相關健康監測[14-15]。
此外,本研究發現,CSVD與ACI患者靜脈溶栓后HT存在密切關聯性。CSVD與血腦屏障滲漏、內皮功能異常關系密切,血管內皮功能異常,尤其是血管內皮生長因子可參與小血管疾病病理過程。WMH為CSVD重要影像標志,其可通過多種機制對ACI預后產生影響。隨WMH嚴重程度加劇,微血管循環與側支循環自我調節能力嚴重受損,可減弱腦組織對缺血抵抗力,導致再灌注減少,損傷血腦屏障,且靜脈溶栓治療可加劇血腦屏障受損程度,增加血管性水腫及HT 風險[16-17]。
綜上所述,發病至溶栓治療時間、入院時NIHSS評分、高血壓、合并房顫等均是ACI靜脈溶栓后HT的重要影響因素,臨床可據此制訂防控措施。

