慢性腎衰竭大鼠OAT1 的表達(dá)對(duì)骨代謝的影響
沈文娟 ,梁紋鑫 ,李 清 ,徐宏芳 ,張偉琴 ,李海欣
(1)昆明醫(yī)科大學(xué)海源學(xué)院病理生理學(xué)教研室;2)人體解剖學(xué)教研室;3)醫(yī)學(xué)機(jī)能學(xué)實(shí)驗(yàn)室;4)人體寄生蟲學(xué)教研室,昆明 云南 651700;5)昆明市第二人民醫(yī)院骨科,昆明 云南 650204)
腎功能衰竭的腎性骨營(yíng)養(yǎng)不良、尿毒癥環(huán)境、藥物和全身性疾病可導(dǎo)致慢性腎臟疾病患者的骨損傷。慢性腎臟疾病患者的骨折發(fā)生率比常人高出4~5 倍,并且骨折的發(fā)生率隨著腎功能的惡化而增加[1]。骨折對(duì)慢性腎功能衰竭患者的生活質(zhì)量和死亡率有不利影響,骨丟失和骨折的發(fā)病機(jī)制復(fù)雜多樣。
有機(jī)陰離子轉(zhuǎn)運(yùn)蛋白(organic anion transporter,OAT)由 540~560 個(gè)氨基酸組成,含12 個(gè)跨膜結(jié)構(gòu)域,負(fù)責(zé)有機(jī)陰離子的跨膜轉(zhuǎn)運(yùn)[2]。OAT1、OAT2、OAT3 共同參與腎小管上皮細(xì)胞尿酸分泌的第1 階段,具有尿酸轉(zhuǎn)運(yùn)功能,OAT1 與尿酸分泌和排泄密切相關(guān),主要見于腎近端小管的基底膜一側(cè),參與腎臟分泌[3-4]。腎小管上皮細(xì)胞表達(dá)OAT,尿酸的分泌和重吸收由不同的轉(zhuǎn)運(yùn)蛋白表達(dá)[5]。OAT 轉(zhuǎn)運(yùn)的底物的多樣性決定了OAT 的重要作用。當(dāng)發(fā)生尿毒癥的有機(jī)毒素增加時(shí),內(nèi)源性毒素在OAT 運(yùn)輸不平衡下引起組織損傷。有研究指出,在高尿酸環(huán)境下,OAT1 的表達(dá)會(huì)下調(diào)[6]。
筆者著重研究慢性腎衰竭中OAT 表達(dá)對(duì)骨代謝的影響,采用單腎切除+腺嘌呤灌胃法建立大鼠慢性腎衰竭模型,觀察慢性腎衰竭時(shí)OAT1 表達(dá)的變化,探討OAT1 表達(dá)對(duì)骨代謝的影響,為腎性骨營(yíng)養(yǎng)不良的防治提供一定基礎(chǔ)。
1 材料與方法
1.1 試劑與儀器
蘇木素(賽維爾,批號(hào):G1004-100ML);二甲苯(西隴化工股份有限公司,批號(hào):33535);伊紅染色液(索萊寶,批號(hào):G1108);山羊抗兔二抗(賽維爾,批號(hào):G1213-100UL);DAB 試劑盒(賽維爾,批號(hào):G1212-200T);邁瑞獸用全自動(dòng)血液細(xì)胞分析儀(型號(hào):BC-2800vet);臥式冷凍箱(美菱,型號(hào):BCD-318AT);全自動(dòng)生化分析儀(深圳雷杜生命科技,型號(hào):Chemray 800);實(shí)維儀器石蠟切片機(jī);尼康倒置顯微鏡(型號(hào):TS2)。
1.2 實(shí)驗(yàn)動(dòng)物
20 只的SD 雄性大鼠(體重350~400 g,12 周)購(gòu)自昆明醫(yī)科大學(xué)海源學(xué)院動(dòng)物提供合作中心,將大鼠隨機(jī)分為對(duì)照組和模型組,每組10只大鼠。大鼠在24 ℃和(60±10)% 相對(duì)濕度下適應(yīng)性飼養(yǎng)1 周,光照/黑暗周期為12 h。本次動(dòng)物實(shí)驗(yàn)方案經(jīng)昆明醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物權(quán)利與倫理管理委員會(huì)批準(zhǔn)[SCXK(滇)K2020-0004]。
1.3 研究方法
1.3.1 大鼠慢性腎衰竭模型的復(fù)制采用“單腎切除+腺嘌呤灌胃法”建立大鼠慢性腎衰竭模型,模型組給10%的水合氯醛腹腔注射麻醉。取俯臥位將模型組大鼠固定在手術(shù)臺(tái)上,進(jìn)行背部手術(shù)區(qū)常規(guī)備皮,酒精消毒,以肋脊角為標(biāo)志進(jìn)行左側(cè)背部斜切口,在脊柱旁0.5 cm 處,分離皮膚。分離腰大肌,進(jìn)入后腹膜,找到腎臟,使用止血鉗分離腎周圍脂肪囊和腎蒂,注意避免損傷腎上腺。充分暴露左側(cè)腎臟,用止血鉗夾閉腎蒂,確認(rèn)腎動(dòng)脈、靜脈和輸尿管均包括在內(nèi)后,用絲線結(jié)扎。用剪刀剪斷腎蒂,摘除腎臟,并將結(jié)扎的腎蒂放入腹腔,見圖1。關(guān)閉腹腔。1 號(hào)線分層縫合肌肉和皮膚。術(shù)后對(duì)照組蒸餾水灌胃,模型組腺嘌呤灌胃,模型組大鼠每天上午以加200 mg/(kg·d)劑量的腺嘌呤混懸液灌胃造模,連續(xù)28 d。每只動(dòng)物均可自由獲得水和食物。采集大鼠血液、處死后獲得腎臟、骨組織保存在-80 ℃冰箱,進(jìn)行后續(xù)實(shí)驗(yàn)研究。

圖1 左側(cè)單腎切除過(guò)程Fig.1 Left side single kidney resection process diagram
1.3.2 生化指標(biāo)檢測(cè)測(cè)定大鼠的一般指標(biāo),每隔7 d 測(cè)定并觀察大鼠的體重、攝食和飲水量,共持續(xù)4 周。測(cè)量大鼠生化指標(biāo),連續(xù)0、2、4、6、8、10 周采全血。麻醉用10% 水合氯醛腹腔注射,從股動(dòng)脈抽血。全血標(biāo)本于室溫放置2 h或4 ℃過(guò)夜。后于2~8℃采用3 000 r/min 離心15 min,取上清分裝。并將標(biāo)本放于-20 ℃或-80 ℃保存。紅細(xì)胞(RBC)和血紅蛋白(Hb)通過(guò)血常規(guī)分析儀測(cè)定。尿素氮(BUN)、肌酐(Cr)、尿酸(UA)、血鈣(Ca2+)、血磷(P3+)通過(guò)全自動(dòng)生化分析儀測(cè)定。
采用尿素酶-谷氨酸脫氫酶法測(cè)定尿素,上樣3 μL 樣本。采用酶法測(cè)定肌酐,上樣8 μL。采用酶標(biāo)檢測(cè)儀測(cè)定尿酸,上樣7.5 μL 血清樣本。采用終點(diǎn)法測(cè)定鈣濃度,加入試劑250 μL,試劑盒型號(hào):C057,每份加入2.5 μL 血清樣本,反應(yīng)120 s。采用兩點(diǎn)法測(cè)定磷濃度,加入試劑300 μL,試劑盒型號(hào):C014,每份加入6 μL 血清樣本,反應(yīng)300 s。測(cè)量大鼠腎臟一般指標(biāo),10 周處死大鼠,取出腎臟,用生理鹽水沖洗,除去淤血及血管、脂肪等非腎臟組織。裸腎用濾紙吸干,用精密電子天平稱單腎濕重,計(jì)算大鼠單側(cè)腎重/體重的值,肉眼觀察腎臟,大小、形態(tài)、顏色、質(zhì)地、包膜、皮質(zhì)、髓質(zhì)等。
1.3.3 Hematoxylin-eosin Staining(HE 染色)將組織用4%多聚甲醛溶液固定,石蠟包埋,切片。(1)烤片:將組織片放入64℃恒溫箱中烘烤1 h;(2)脫蠟:將玻片放入到二甲苯中Ⅰ(10 min)-二甲苯Ⅱ(10 min);(3)水化:100% 酒精Ⅰ(5 min)-100%酒精Ⅱ(5 min)-95%酒精(5 min)-80%酒精(3 min)-70%酒精(2 min);PBS 沖洗3 次,每次5 min;(4)蘇木素復(fù)染:將玻片放到蘇木素中染色5 min,蒸餾水沖洗,放入到酒精-鹽酸溶液中進(jìn)行分化,分化10~15 s,放入到自來(lái)水中返藍(lán),返藍(lán)至少15 min;(5)伊紅染色:將玻片放入到伊紅中染色5~10 s,放入到蒸餾水中洗1 次;(6)脫水:95%酒精(5~10 s)-100%酒精Ⅰ(5 min)-100%酒精Ⅱ(5 min);(7)透明:二甲苯Ⅰ(10 min)-二甲苯Ⅱ(10 min);(8)封片:用中性樹膠進(jìn)行封片;(9)拍片:選擇中間和四周不少于5 個(gè)視野進(jìn)行拍照和分析。將對(duì)照組和模型組大鼠的腎組織用HE 染色,以觀查其基本結(jié)構(gòu),分析病變情況、分辨細(xì)胞種類以及炎癥細(xì)胞浸潤(rùn)情況等。
1.3.4 X 線拍片檢測(cè)大鼠脛骨標(biāo)本的生長(zhǎng)情況使用X 線檢查對(duì)照組和腺嘌呤誘導(dǎo)模型組大鼠脛骨標(biāo)本,觀察到對(duì)照組骨質(zhì)內(nèi)骨小梁排布的比較緊密、規(guī)律,骨質(zhì)的密度正常;模型組骨小梁排布得比較稀疏,甚至出現(xiàn)紊亂或者缺失,骨密度不足。對(duì)比其骨小梁變化分析骨密度情況。
1.3.5 免疫組化檢測(cè)OAT1 表達(dá)(1)取材和切片及脫蠟:二甲苯、二甲苯Ⅱ各7 min,4 個(gè)梯度乙醇各4 min,沖洗3 min,PBS 沖洗2 次(3 min/次);(2)抗原修復(fù):2 次(8 min/次),自然冷卻至室溫;(3)滅活:使內(nèi)源性過(guò)氧化物酶失去活性;(4)加一抗∶1∶150 的一抗(陰性對(duì)照加PBS),37℃孵育150 min 后,PBS 沖洗;(5)加OAT1 抗體:加二抗并置于37℃烘箱20 min,PBS 沖洗3 次;(6)DAB 顯色及封片:避光環(huán)境下,滴加現(xiàn)配的DAB 試劑,顯色、沖洗、脫水,中性樹膠封片。將骨切片染色確認(rèn)骨質(zhì)吸收情況,使用圖像分析系統(tǒng)計(jì)算吸收面積。
1.4 統(tǒng)計(jì)學(xué)處理
應(yīng)用SPSS 24.0 進(jìn)行統(tǒng)計(jì)學(xué)分析,以均數(shù)±標(biāo)準(zhǔn)差()表示計(jì)量資料,組間比較采用t檢驗(yàn),采用 Graphpad Prism 5.0 作圖,P<0.05 為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 大鼠的一般情況
造模后,體重維持不變,而后呈下降趨勢(shì)。單側(cè)腎重占比模型組與對(duì)照組并無(wú)明顯差別(P=0.077)。對(duì)照組則先上升、后下降,后又上升,模型組飲水量呈上升趨勢(shì),隨后持平,在3~4 周區(qū)間范圍內(nèi)呈波動(dòng)趨勢(shì)。對(duì)照組則隨時(shí)間上升,模型組飲食量隨時(shí)間呈下降趨勢(shì),見圖2。

圖2 大鼠的一般情況Fig.2 General situation of rats
2.2 單腎切除+腺嘌呤誘導(dǎo)對(duì)大鼠腎組織的影響
2.2.1 大鼠腎組織取材對(duì)照組大鼠腎臟紅潤(rùn)光滑,其形態(tài)、大小正常,模型組大鼠腎臟明顯肥大,表面蒼白粗糙,見圖3。
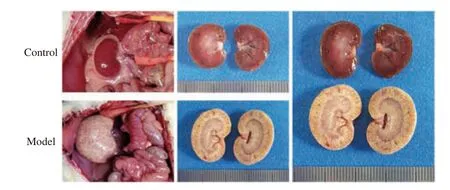
圖3 大鼠腎組織取材Fig.3 Rat kidney tissue sampling diagram
2.2.2 大鼠右腎HE 染色結(jié)果顯微鏡下可見對(duì)照腎小球、腎小管結(jié)構(gòu)正常,系膜細(xì)胞和基質(zhì)無(wú)增生,腎間質(zhì)無(wú)炎性細(xì)胞浸潤(rùn)及纖維化;模型組腎間質(zhì)炎性細(xì)胞浸潤(rùn),使腎小管萎縮、腎小管上皮細(xì)胞空泡樣變,基底膜增厚、腎間質(zhì)大量炎性細(xì)胞浸潤(rùn)及纖維化,見圖4。

圖4 大鼠右腎HE 染色Fig.4 HE staining of right kidney in rats
2.3 單腎切除加腺嘌呤誘導(dǎo)對(duì)大鼠腎功能的影響
模型組的尿素氮(BUN)、肌酐(Cr)及血鈣(Ca2+)、血磷(P3+)較對(duì)照組升高(P<0.05),見表1。
表1 不同組間大鼠的腎功能指標(biāo)比較(,n=6)Tab.1 Comparison of renal function indicators among different groups of rats(,n=6)

表1 不同組間大鼠的腎功能指標(biāo)比較(,n=6)Tab.1 Comparison of renal function indicators among different groups of rats(,n=6)
與對(duì)照組比較,*P<0.05,**P<0.01。
2.4 OAT1 表達(dá)對(duì)尿酸、鈣磷代謝及骨組織的影響
2.4.1 OAT1 表達(dá)對(duì)尿酸、鈣磷代謝的影響與對(duì)照組相比,模型組大鼠血清中的尿酸、血磷和血鈣升高,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),見表2。
表2 不同組間大鼠的尿酸、鈣和磷水平(,n=6)Tab.2 Uric acid,calcium,and phosphorus levels in rats of different groups(,n=6)

表2 不同組間大鼠的尿酸、鈣和磷水平(,n=6)Tab.2 Uric acid,calcium,and phosphorus levels in rats of different groups(,n=6)
與對(duì)照組比較,*P<0.05,**P<0.01。
2.4.2 OAT1 表達(dá)對(duì)骨組織的影響大鼠脛骨X線拍片檢查觀察骨生長(zhǎng)情況。觀察到對(duì)照組骨質(zhì)內(nèi)骨小梁,排布緊密、規(guī)律,骨質(zhì)的密度正常,而模型組骨小梁排布得比較稀疏,甚至出現(xiàn)紊亂或者缺失,骨密度低于對(duì)照組,見圖5。

圖5 大鼠脛骨X 線拍片F(xiàn)ig.5 X-rays of rat tibia
2.5 OAT1 對(duì)骨營(yíng)養(yǎng)不良的影響
對(duì)照組和腺嘌呤誘導(dǎo)模型組大鼠OAT1 的面積。將骨組織中的OAT1 染色,并使用GraphPad Prism 5 計(jì)算面積后發(fā)現(xiàn):模型組大鼠骨組織結(jié)合OAT1 值低于對(duì)照組(P<0.05),見圖6。
3 討論
有機(jī)陰離子轉(zhuǎn)運(yùn)蛋白家族屬于溶質(zhì)載體家族(solute carrier family,SLC22),在腎臟上皮細(xì)胞中表達(dá)以調(diào)節(jié)內(nèi)源性和外源性有機(jī)陰離子的排泄和重吸收,包括各種藥物及其代謝物[7-9]。OATs 也在血腦屏障、肌肉細(xì)胞和成骨細(xì)胞中表達(dá),這暗示了OAT 介導(dǎo)的尿毒癥毒素轉(zhuǎn)運(yùn)的各種致病作用[10]。慢性腎衰竭大鼠腎 OAT1 表達(dá)減少,并且其分泌負(fù)荷減少[11]。有研究指出,一些有機(jī)陰離子轉(zhuǎn)運(yùn)多肽(OATPs)和有機(jī)陰離子轉(zhuǎn)運(yùn)蛋白參與了尿毒癥毒素的腎臟清除[12]。且已有研究證明OAT家族中的OAT1 在腎臟中參與尿酸鹽的轉(zhuǎn)運(yùn)過(guò)程[13-14]。并發(fā)現(xiàn),在OAT 下降的條件下,慢性腎衰竭的尿酸清除率降低,導(dǎo)致慢性腎衰竭大鼠血清中尿酸含量增高。臨床上慢性腎功能衰竭患者體內(nèi)的尿酸水平可反映患者體內(nèi)腎功能損傷情況,兩者具有明顯的相關(guān)性,可作為其臨床診斷或術(shù)后評(píng)估的參考依據(jù)之一[15-16]。
本研究結(jié)果觀察到造模后模型組體重、飲水量、飲食量的變化,單腎占比未變。并且,對(duì)照組和模型組大鼠的紅細(xì)胞、血紅蛋白水平,尿素氮及肌酐水平顯符合腺嘌呤誘導(dǎo)慢性腎功能衰竭預(yù)期[17]。大鼠處死后,取腎組織發(fā)現(xiàn)模型組大鼠腎臟明顯肥大,表面蒼白粗糙,而對(duì)照組大鼠腎臟紅潤(rùn)光滑,其形態(tài)、大小也無(wú)異常。將腎組織切片染色,顯微鏡下可見對(duì)照腎組織正常,系膜細(xì)胞和基質(zhì)無(wú)增生,腎間質(zhì)無(wú)炎性細(xì)胞浸潤(rùn)及纖維化;模型組腎間質(zhì)炎性細(xì)胞浸潤(rùn),使腎小管萎縮、腎小管上皮細(xì)胞空泡樣變,基底膜增厚、腎間質(zhì)大量炎性細(xì)胞浸潤(rùn)及纖維化。上述結(jié)果均表明單腎切除+腺嘌呤灌胃法已成功建立大鼠腎衰竭模型,且與張圓圓等[18]的研究成果相符合。
腎性骨營(yíng)養(yǎng)不良是指在慢性腎功能衰竭患者中經(jīng)常觀察到的骨形態(tài)和代謝的改變,并且由于骨量和質(zhì)量的惡化導(dǎo)致骨強(qiáng)度受損,致使患者易發(fā)生骨折[6,19-21]。本研究通過(guò)X 線拍片觀察大鼠脛骨生長(zhǎng)情況、骨形態(tài)分析顯示,觀察X 線拍片,模型組大鼠骨小梁結(jié)構(gòu)的變化和皮質(zhì)骨密度降低。確定了慢性腎功能衰竭大鼠有腎性骨營(yíng)養(yǎng)不良的狀況。有研究顯示,骨營(yíng)養(yǎng)不良主要表現(xiàn)在骨重塑(骨保護(hù)素、骨鈣素、骨橋蛋白)和維生素D 代謝(7-脫氫膽固醇還原酶、Gc-球蛋白、Cyp2r1、Cyp27a1)的基因失調(diào),以及鈣和維生素D 穩(wěn)態(tài)的改變[6]。實(shí)驗(yàn)數(shù)據(jù)表明模型組大鼠的鈣磷流失高于對(duì)照組。維持機(jī)體鈣磷代謝穩(wěn)態(tài)是腎臟的主要功能之一,慢性腎功能衰竭患者體內(nèi)的腎功能受損后,機(jī)體內(nèi)的礦物質(zhì)和骨代謝發(fā)生異常可導(dǎo)致腎性骨病[22-23]。因此筆者推測(cè)慢性腎功能衰竭大鼠內(nèi)的鈣磷代謝紊亂導(dǎo)致骨營(yíng)養(yǎng)不良[24]。然而,慢性腎衰竭又通過(guò)什么因素導(dǎo)致了骨營(yíng)養(yǎng)不良?
據(jù)報(bào)道,在慢性腎功能衰竭中,OAT1、OAT2、Oct1、Oct2、Oatp4C1 的mRNA 表達(dá)均下調(diào)[25]。并且OATP1B 活性可能在腎衰竭患者中降低,影響其藥物代謝清除率及藥物轉(zhuǎn)運(yùn)能力[26]。筆者觀察到模型組大鼠骨組織結(jié)合OAT1 值低于對(duì)照組(P=0.001 8)。這意味著,腎衰竭影響了OAT1 在骨組織中的表達(dá)。OAT1 在骨組織中的結(jié)合能力下降,會(huì)影響骨組織的鈣磷結(jié)合能力,導(dǎo)致慢性腎衰竭大鼠骨小梁結(jié)構(gòu)的變化和皮質(zhì)骨密度降低。
綜上所述,本實(shí)驗(yàn)證明了模型組大鼠骨組織OAT1 表達(dá)值遠(yuǎn)低于對(duì)照組,影響鈣磷代謝,致慢性腎衰竭大鼠骨小梁結(jié)構(gòu)的變化和皮質(zhì)骨密度降低。從而加重腎性骨營(yíng)養(yǎng)不良,該研究進(jìn)一步探明慢性腎衰竭大鼠OAT1 表達(dá)與腎性骨營(yíng)養(yǎng)不良兩者的關(guān)系,為臨床提供一定的理論依據(jù)。

