螺環類農藥研究進展
袁 婷,伍思凱,吳志兵
(1.貴州中醫藥大學時珍學院,貴陽 550200;2.貴州大學綠色農藥與農業生物工程教育部重點實驗室/國家重點實驗室培育基地,貴陽 550025;3.貴州師范大學國際教育學院,貴陽 550001)
螺環化合物以其獨特的三維結構、廣泛的生物活性而著稱[1-3]。螺環結構的特點是在季碳上稠合各類芳香或非芳香環,如圖1所示,許多天然產物普遍存在該特征結構[4-5]。在該類結構中,螺環碳固定了化合物的構象,使其具有較強的剛性,不僅可以穩定配體與蛋白質結合所需的構象,還可以增加結構的特異性及分子的復雜性,從而降低其耐藥性并增強代謝的穩定性[6-7]。
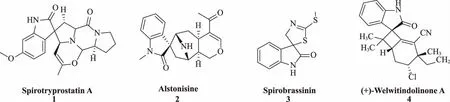
圖1 帶有螺環骨架的天然產物
此外,制備該類結構具有一定的合成難度,針對合成該骨架的研究可促進合成方法學的發展,而這些發展為藥物分子的制備提供了新的合成策略。有關學者已研究了許多具有不同生物活性的螺環結構,并確定了其中一些分子的特定靶標和作用方式。
20世紀80年代,拜耳公司發現了一種對白粉病、銹病和條銹病等常見病害具有較好抑制作用的二氧螺[4.5]癸烷化合物,以“螺環菌胺”命名并登記上市,即農藥領域的第一款螺環化合物[8]。而后拜耳公司相繼推出螺螨酯、螺甲螨酯和螺蟲乙酯等3款螺環類化合物[9-11]。它們至今仍為殺蟲(螨)劑市場的主力軍(圖2)。

圖2 已登記的螺環類化合物
大多數殺螨劑將螺螨酯作為復配成分加入,但害蟲對其抗性嚴重,且螺螨酯存在對成螨無效、起效慢等缺點;而螺蟲乙酯雖活性較好,但存在起效慢等問題[12-13]。青島科技大學發現的螺螨雙酯已由浙江宇龍生物科技有限公司于2019年登記上市,為我國自主知識產權產品[14]。螺螨雙酯主要通過觸殺和胃毒作用防治卵、若螨和雌成螨,其作用機理為抑制害螨體內脂肪合成,阻斷能量代謝,殺卵效果突出[15]。相對于螺螨酯對成螨效果差的缺點,螺螨雙酯對不同發育階段的害螨均具有較好防效,可在柑橘各個生長期使用。在推薦用藥劑量范圍內對作物安全,未見藥害發生,且對捕食天敵、寄生天敵低毒或無影響。
目前,已有一些關于螺環化合物在藥物化學領域研究的綜述:魏榮寶等[16]綜述了螺環化合物在農用殺菌、殺蟲、除草等方面的研究情況;丁研等[17]總結了近年來具有抗菌活性的螺環化合物的研究進展;Ye等[18]綜述了螺環吲哚化合物作為抗病毒劑在醫用領域的研究進展;Yang等[19]介紹了螺環化合物作為殺菌劑的應用和研究進展。由于螺環化合物研究進展較快且其在農藥領域中應用綜述文章較少,本文針對螺環化合物在農用活性方面的研究進展進行總結,以期為新農藥創制提供幫助。
1 具有農藥活性的螺環化合物
1.1 具有殺蟲活性的螺環化合物
近年來,螺環季酮酸類殺蟲(螨)劑因其結構新穎、高效低毒、無交互抗性等特點成為新農藥創制研究的熱點之一[20]。拜耳公司先后開發了3個全新結構的螺環季酮酸類殺蟲(螨)劑——螺螨酯、螺甲螨酯、螺蟲乙酯。這3款農藥具有相似的化學結構和作用機理,均是乙酰輔酶A羧化酶(Acetyl CoA carboxylase,ACCase)抑制劑,能通過抑制ACCase活性,干擾生物的脂肪酸生物合成,達到殺滅害蟲的目的[21]。相比于螺螨酯、螺甲螨酯,螺蟲乙酯具有雙向內吸性且持效長等優點,在殺蟲劑市場中占有很大份額。
目前螺環類殺蟲劑主要以季酮酸類化合物作為母體衍生。Zhao等[22]以3-(2,4-二氯苯基)-4-羥基-1-氧雜螺[4.5]癸-3-烯-2-酮為原料合成了21個螺環季酮酸衍生物(圖3),并對其進行了初步殺蟲活性測試。測試結果表明,該類化合物對朱砂葉螨、蚜蟲和黏蟲均具有很好的生物活性,尤其是化合物10a和10b,對朱砂葉螨的LD50分別為35.12、10.39 μg/mL,優于螺螨酯(LD50為45.20 μg/mL),化合物10c對蠶豆蚜的LD50為21.90 μg/mL,遠優于螺螨酯(LD50為174.13 μg/mL)。構效關系分析表明:將甲氧肟基團引入螺環季酮酸衍生物后,生物活性變化不明顯;酯鍵的長短對殺蟲殺螨活性有明顯影響,對蠶豆蚜的抑制活性初篩結果顯示,其為3~4個碳時較適合,鏈長過短活性較低,鏈長過長活性也不高;直鏈酯鍵引入雙鍵后,活性顯著增加。
Zhao等[23]繼續在結構上進行突破,合成一系列五元環的螺環衍生物11(圖4),在保留活性基團的前提下豐富了化合物結構。對該系列化合物進行活性測試,發現其對朱砂葉螨、蚜蟲和黏蟲的活性都優于先導化合物螺甲螨酯。化合物11a、11b和11c均表現出優異的殺蚜蟲活性,尤其是11a,對蚜蟲的LC50為1.09 μg/mL,優于螺甲螨酯(5.06 μg/mL)。構效關系表明,當取代基為直鏈烷烴所連接的酰基時活性增強,尤其是戊羰基時活性最高。對logP分析發現,在4.0~6.0區間內目標化合物的殺蟲活性表現最佳。
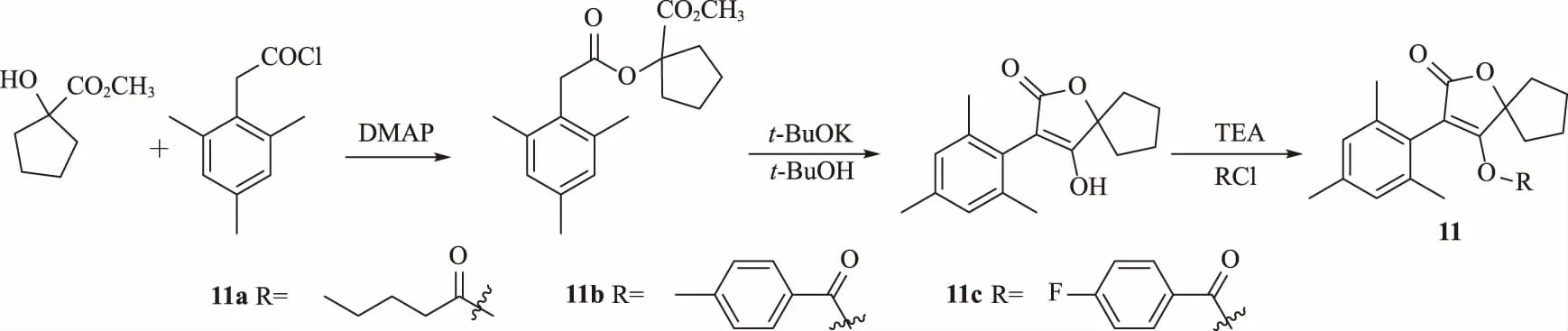
圖4 具有殺蟲活性的螺環化合物11 的合成路線
Cheng等[24]根據以上研究,以螺蟲乙酯為先導進行結構改造,通過在C4和C8位引入各種取代基,設計合成了35個具有殺蟲活性的螺環衍生物12~17(圖5),用親本測定了新化合物對蠶豆蚜、胭脂紅蜘蛛和黏蟲的生物活性。初步分析表明,化合物13f、13h和13u對蠶豆蚜的抑制活性優于螺蟲乙酯,而13f和13u是該系列中對這3種生物最有效的化合物。化合物13f、13h和13u對蠶豆蚜的LC50分別為0.42、0.28和2.53 μg/mL;對胭脂紅蜘蛛的LC50分別為8.12、50.93和11.03 μg/mL。13f、13h和13u可用作開發新型殺蟲劑的潛在先導化合物。初步構效關系分析表明,螺環中柔性橋C4的位置在殺蟲活性中起著重要作用,C8位的官能團大小對活性有很大影響。化合物14、15、16和17未表現出較好的殺蟲活性。

圖5 具有殺蟲活性的螺環季酮酸衍生物12~17 的結構
Liu等[25]以螺甲螨酯為先導化合物進行結構改造,在酯基部分引入雙羰基結構,設計并合成了一系列含有草酰部分的新型螺環四氫苯甲酸衍生物。生物活性測定結果表明,大多數目標化合物對胭脂紅蜘蛛幼蟲和卵有出色的活性,特別是二異丙基氨基草酰化衍生物18a(圖6)和哌啶草酰化衍生物18b,對紅蜘蛛卵的抑制活性分別是市售藥劑螺甲螨酯的1.4倍和2.3倍。大多數目標化合物對鱗翅目害蟲表現出殺蟲活性。從構效關系可以看出,引入草酰基后活性大大增加,由此可見將草酰部分引入螺環四氫苯甲酸可能會產生新的生物活性。
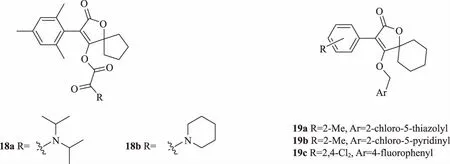
圖6 具有殺蟲活性的螺環季酮酸衍生物18~19 的結構
Ke等[26]同樣以季酮酸為出發點,通過酯化、一鍋雜環和醚化3步簡便地合成一系列螺環季酮酸衍生物,并測試了其對棉鈴蟲和小菜蛾的殺蟲活性。生物活性測定結果表明,大部分化合物對小菜蛾的活性優于螺螨酯的活性,其中化合物19a、19b和19c在125 μg/mL質量濃度下仍能保證100%的致死率,高于對照藥劑螺螨酯(125 μg/mL質量濃度下致死率為0~10%)。根據構效關系分析,含有氫和4-氟取代基的化合物與帶有鄰甲基及2,4-二氯取代基的化合物表現出一定的反差。前者在相同濃度下表現出相對較低的活性,可能為芳環中取代基的位置變化顯著影響了活性,在芳環的鄰位引入基團可能存在重要的空間和電子效應,從而影響目標化合物的生物活性。
1.2 具有殺菌活性的螺環化合物
植物病原菌對作物危害嚴重,給農業生產帶來了巨大的影響[26]。螺環菌胺屬于甾醇生物合成抑制劑,主要抑制C14脫甲基化酶的合成[27]。其具有內吸性,持效期長,作用迅速,兼具保護和治療作用,可用于麥類作物防治白粉病、銹病、云紋病、條銹病等,葡萄、香蕉等果樹防治白粉病、葉斑病等。目前應用在殺菌領域的螺環骨架大多是在天然產物的基礎上進行結構修飾而得到的全新骨架,該類骨架具有新穎的結構,且與甲氧基丙烯酸酯類殺菌劑和琥珀酸脫氫酶抑制劑(SDHI)類殺菌劑等無交互抗性。
Evidente等[27]從殼二孢屬真菌Ascochyta agropyrina var.nana的代謝物中分離出papyracillic acid,并通過化學轉化合成一系列papyracillic acid衍生物,初步測試其對柑橘潰瘍病菌的活性(圖7)。測定結果表明,papyracillic acid及其甲基化衍生物21顯示出一定的殺菌效果,2個化合物對野油菜黃單胞菌的MIC值分別為7.5和5.2 μg/mL。
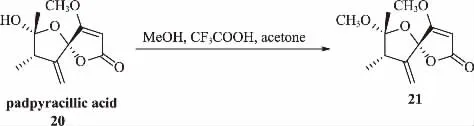
圖7 Papyracillic acid 的轉化路線
螺環天然產物灰黃霉素(Griseofulvin)(圖8)已被開發用作醫用殺菌劑,它能抑制真菌有絲分裂,使有絲分裂的紡錘結構斷裂,終止中期細胞分裂[28]。Bai等[29]將灰黃霉素進行化學轉化后作為農用殺菌劑,測試其對馬鈴薯干腐病菌(Fusarium solani)、蘋果炭疽病菌(Colletotrichum gloeosporioides)、蘋果腐爛病菌(Cytospora sp.)、番茄早疫病菌(Alternaria solani)及番茄灰霉病菌(Botrytis cinerea)等5種常見植物病原真菌的抑制活性。結果表明,22a、22b和22c對蘋果炭疽病菌的IC50分別為(47.25±1.46)、(49.44±1.50)和(53.63±1.74)μg/mL,低于甲基硫菌靈的IC50(69.66±6.07)μg/mL。對其進行的活體試驗結果與離體測試結果相符。構效關系分析顯示,合適的大體積和負電酰基取代基更有利于增加灰黃霉素的4'位置的活性。
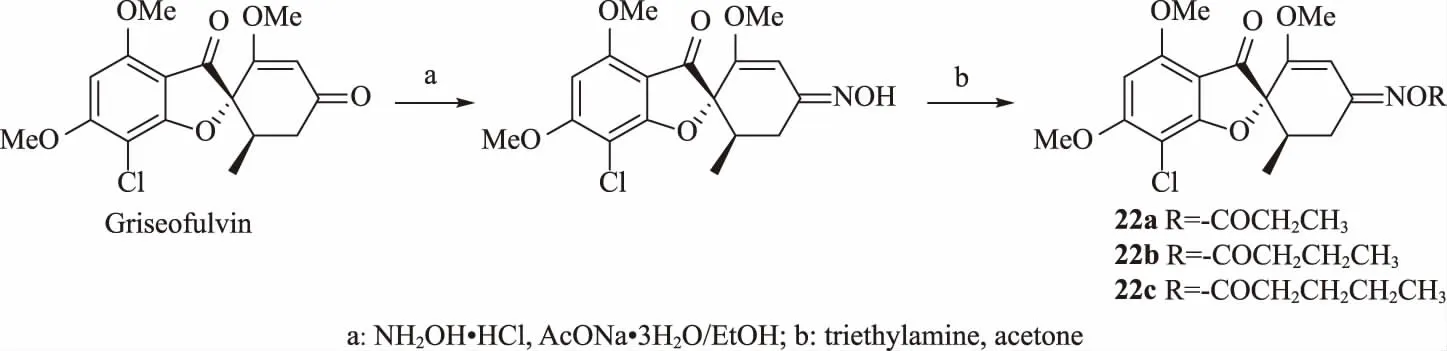
圖8 灰黃霉素的轉化路線
靛紅廣泛存在于自然界中,可利用靛紅通過簡單的轉化制備螺環化合物,且靛紅大多具有廣泛的生物活性[30]。Wu等[31]以羥吲哚衍生物為原料,在溫和條件下與β-芳基丙烯腈衍生物發生堿介導的偶聯[3+2]雙邁克爾反應,以良好的收率得到了一系列螺吲哚四氫呋喃衍生物(圖9)。測試其對水稻紋枯病菌(Rhizoctonia solani)、半裸鐮刀菌(Fusarium semitectum)、馬鈴薯早疫病菌(Alternaria solani)、蘋果樹腐爛病菌(Valsa mali)和小麥赤霉病菌(Fusarium graminearum)的生物活性。結果表明:大多數化合物顯示出良好的殺菌活性,其中在苯環的間位具有溴原子的螺氧雜吲哚衍生物23對小麥赤霉病菌的IC50為3.31 μg/ mL,與陽性對照環己酰亞胺(IC50為3.30 μg/mL)活性相當。構效關系分析可知,在靛紅N-位取代基R1相同的情況下,R2為吸電子取代基間溴苯基的化合物23顯示出活性增加的作用,對小麥赤霉病菌抑制活性顯著高于R2處為對甲苯基的化合物。
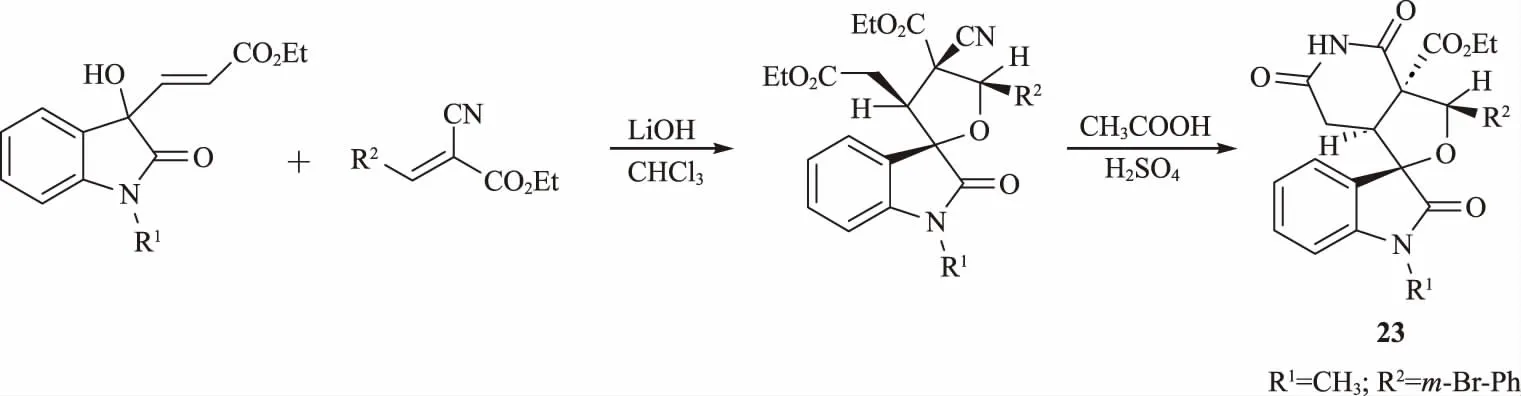
圖9 螺吲哚四氫呋喃衍生物的合成路線
辣椒是重要的蔬菜作物,我國辣椒產量十分可觀,但是病害發生也較嚴重,特別是病毒病等惡性病害發生普遍,危害極大[32]。Marinov等[33]發現一種環烷螺衍生物24(圖10)可以和棘孢木霉(Trichoderma asperellum T6)搭配使用,用于防治由辣椒斑點病菌(Xanthomonas vesicatoria)和半裸鐮刀菌引起的植物病害。化合物24對辣椒斑點病菌和半裸鐮刀菌具有較強抑制作用,同時對生防菌棘孢木霉的生長無影響,可將化合物24與生防菌棘孢木霉聯用。
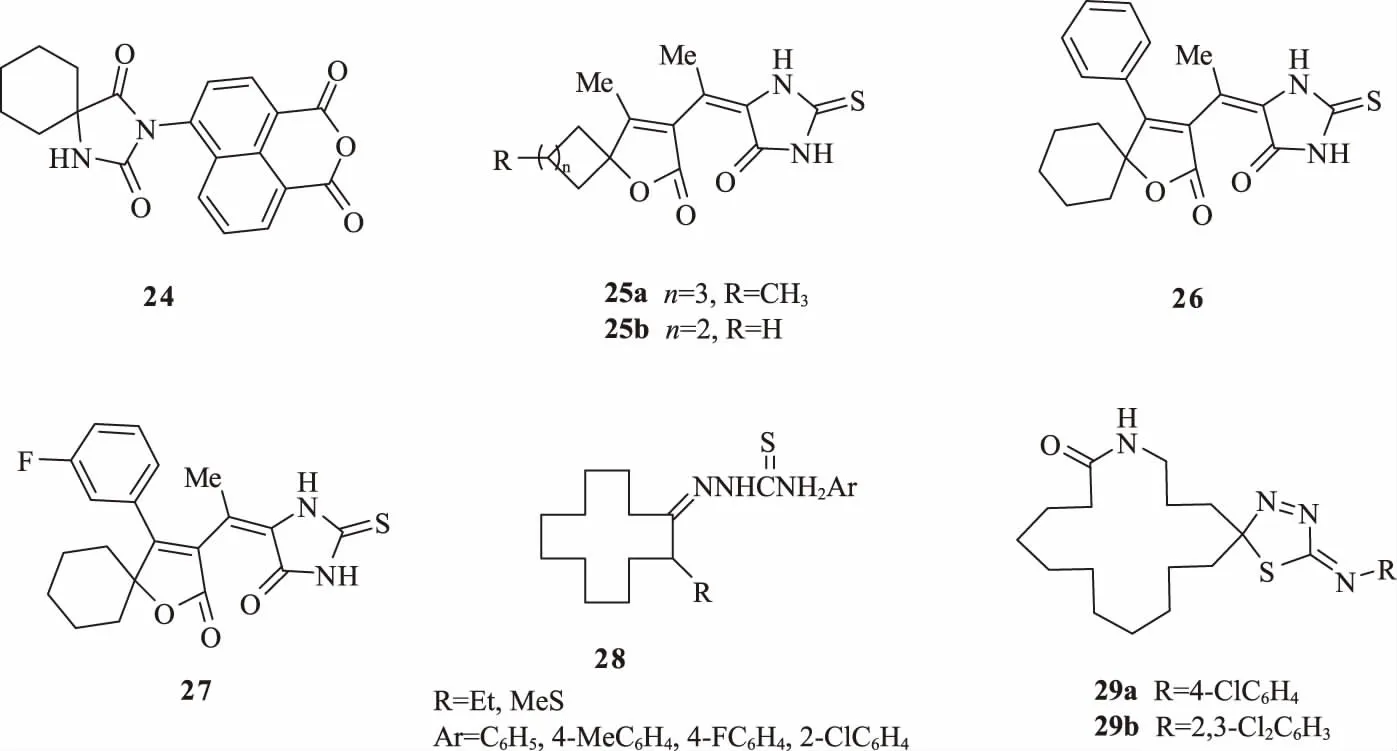
圖10 具有殺菌活性的化合物24~29 的結構
Tang等[34]設計并合成了一類新型的氧雜螺環咪唑衍生物,通過活性測試發現該系列化合物對辣椒疫霉病菌(Phytophthora capsici)具有較強的抑制作用,其中化合物25a和25b在50 μg/mL質量濃度下的抑制率分別為96.4%和92.5%,EC50分別為2.45和7.42 μg/mL,優于多菌靈(EC50為77.80 μg/mL)。構效關系顯示,烯內酯支架中螺環部分的引入使其抑菌活性提高,且芳香胺衍生物的殺真菌活性較芐胺衍生物好。在該系列化合物研究的基礎上,Yu等[35]固定左側螺環的大小,選擇活性最優的環己烷,替換與呋喃相連的甲基為苯基,設計了化合物26,發現其活性明顯降低。將化合物26的苯環部分進一步用鹵素修飾后,Li等[36]發現苯環上3位為F取代的化合物27顯示出更高的殺菌活性,能顯著抑制菌絲生長、孢子囊生成、游動孢子釋放和囊孢子萌發。
大環化合物大多應用于超分子和材料等領域,在農藥領域的應用不多,但其具有的特殊性質對改善藥物活性具有一定幫助。Li等[37]合成了一系列新穎的大環螺噻二唑啉化合物28,并發現其對水稻紋枯病菌具有一定的殺菌活性,但是活性不佳。對其進行改造,將大環烷烴部分改為含雜原子的內酯和內酰胺后,活性明顯提升,得到一系列結構新穎的化合物29。采用菌絲生長速率法測定該類化合物對番茄灰霉病菌、核盤菌、大豆紋枯病菌、蘆筍莖枯病菌和稻瘟病菌等5種植物病原菌的活性。結果表明,大多數化合物顯示出一定的殺菌活性,其中化合物29a和29b對稻瘟病菌具有非常好的抑制作用,其EC50分別為0.054和0.72 μg/mL,均優于對照藥劑稻瘟靈(EC50為7.19 μg/mL)。
1.3 具有抗病毒活性的螺環化合物
煙草花葉病毒(tobacco mosaic virus,TMV)是一種單鏈RNA病毒,專門感染植物,尤其是煙草及其他茄科植物,受感染的葉片斑駁污損,出現花葉癥狀,生長陷于不良狀態,葉呈畸形[38]。目前防治煙草花葉病毒主要有寧南霉素等抗病毒劑,尚無螺環類抗病毒劑的登記信息,但已有以螺環化合物作為植物抗病毒劑的研究。
Chen等[39]以色氨酸為原料合成了一系列新穎的螺環吲哚衍生物,并測試了該類化合物的抗病毒、殺菌、殺蟲活性。測試結果表明:在質量濃度為500 μg/mL時,化合物30(圖11)表現出較好的抗TMV活性,治療、保護、鈍化活性分別為58.0%、49.7%和55.2%,優于對照藥劑病毒唑(治療、保護、鈍化活性分別為36.4%、36.4%和37.5%)。構效分析表明,苯環處給電子取代基的殺菌活性大于吸電子取代基。通過對螺吲哚骨架的修飾,酰基部分的引入有利于提高抗病毒活性。因此,可以認為,酰基的氫鍵供體和受體可以明顯增強目標分子與TMV受體之間的相互作用,從而提高活性。之后,Chen等[40]在此基礎上采用一鍋法制備螺環吲哚的合成策略,制得一系列化合物31,并評估其對TMV的抗病毒活性。結果表明,這些化合物表現出良好的抗TMV活性,尤其是31a、31b和31c,比抗病毒劑病毒唑更有效。構效關系表明,沒有修飾基存在時,螺環的大小和排列以及構型對活性的影響不大,而骨架中存在修飾基時可以改善它們的抗TMV活性,以達到最佳抗病毒效果。
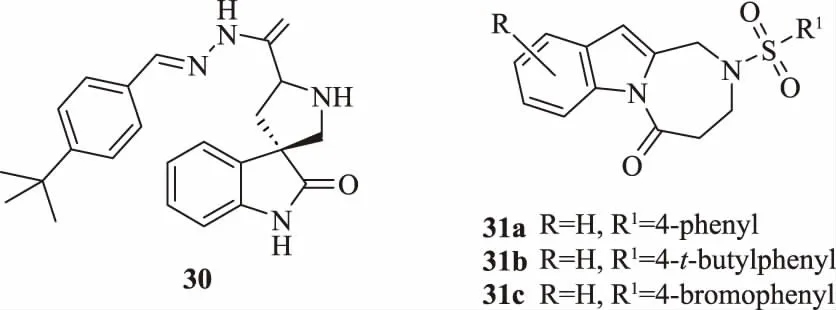
圖11 帶有螺環骨架的抗病毒劑30~31 的結構
Zhu等[41]合成了一系列5A5B6c三環螺內酯衍生物,在初步合成27個化合物后通過QSAR進行合理藥物設計,最終得到33個目標化合物。對其進行抗TMV病毒活性和蜜蜂毒性測試。結果表明:在質量濃度為100 μg/mL時,大多數目標化合物對TMV病毒有較強的鈍化活性,其中有4個化合物鈍化活性大于90%,特別是化合物32a和32b(圖12),鈍化活性分別為93%和98%,遠高于對照藥劑病毒唑(50%)和寧南霉素(64%)。通過初步作用機制分析發現,化合物32b與TMV CP交聯并阻止其脫殼,使其在侵染植物過程中失活,這是一種全新的作用機制。同時,對蜜蜂毒性試驗結果表明,全部化合物在2.73 μg/蜂時,對意大利蜜蜂無明顯毒性,化合物32b有開發為新型抗病毒劑的潛力。
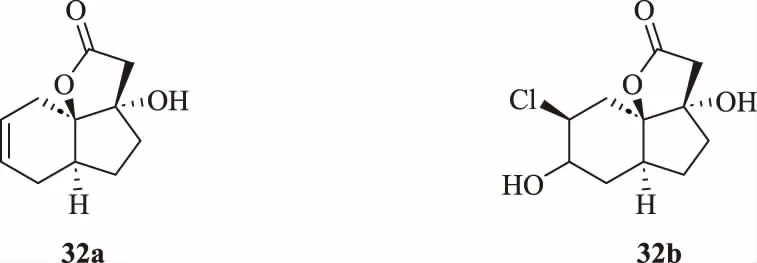
圖12 三環螺內酯衍生物32 的結構
Zhang等[42]通過在靛紅、氨基酸和橙酮之間進行一鍋[3+2]環加成反應,開發了新型雙螺雜環的簡便合成方法(圖13),并合成了一系列化合物。以寧南霉素為對照,采用半葉枯斑法,初步測定新化合物在質量濃度為500 μg/mL時的抗TMV活性。測定結果表明:在該質量濃度下,大多數化合物都表現出一定的抗病毒活性,其中,化合物33a和33b表現出良好的抗TMV病毒活性;33a治療、保護、鈍化活性分別為44.6%、45.5%和52.1%;33b分別為52.3%、50.9%和57.1%,雖略低于對照藥劑寧南霉素(55.9%、57.1%和58.8%),但一鍋環化法的提出簡化了化合物的制備流程,為螺環化合物的制備合成提供了新的思路。
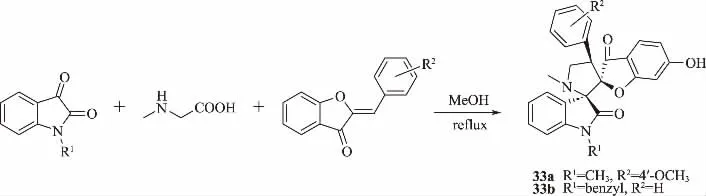
圖13 雙螺雜環化合物33 的合成路線
1.4 具有殺線蟲活性的螺環化合物
植物寄生線蟲給農業生產造成了巨大的損失,目前市場中并未出現含有螺環結構的商品化殺線蟲劑,但螺環結構在防治植物寄生線蟲的研究領域已經取得了部分進展。
Wang等[43]合成了一系列新的螺環1,2,3-苯并三嗪-4-酮衍生物34(圖14),并對其進行生物評價。活性測定結果表明,合成的大多數化合物在質量濃度為10.0 μg/mL時,對南方根結線蟲具有中等至良好的防治效果。其中,化合物34a和34b在該濃度下表現出100%的抑制活性,這意味著它們可用作潛在的殺線蟲劑的先導化合物。
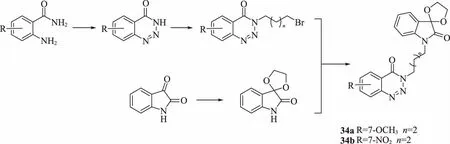
圖14 螺環1,2,3-苯并三嗪-4-酮衍生物34的合成路線
Zou等[44]將螺環結構引入新煙堿類殺蟲劑結構中,制備了一系列螺(橋)雜環新煙堿類衍生物(圖15),并評價其殺線蟲活性。大多數化合物都表現出中等至良好的殺線蟲活性,構效關系表明,螺環化合物35a在質量濃度為20 μg/mL和5 μg/mL時分別具有66.4%和21.7%的抑制作用。當咪唑啉環替換為六元環時得到化合物35b,其活性大大提高。連接雜環藥效基團的氯吡啶基亞基化合物35c提高了質量濃度為20 μg/mL時的活性,但降低了5 μg/mL時的活性。在新煙堿部分的構效關系研究中,引入氯吡啶基亞基可導致活性急劇增加;吸電子基團硝基或給電子基團甲基的引入均導致活性增加。六元化合物35e和35g的效力低于五元化合物35d和35f,該發現與35a和35b之間的構效關系不一致。
Banothu等[45]開發了一種簡單有效的方法,以三乙胺作為催化劑,在乙腈中通過1,3-茚滿二酮、芳族醛、α-溴代-4-氯苯乙酮和吡啶的多組分2步串聯反應合成反式螺環丙烷衍生物36(圖16),并測定其殺菌和殺線蟲活性。化合物36a和36b對所有測試的細菌和真菌菌株均具有活性。化合物36a在質量濃度為250 μg/mL時對南方根結線蟲表現出了良好的活性。
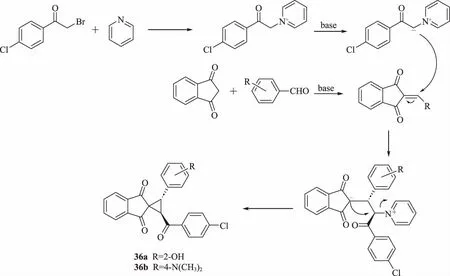
圖16 螺環丙烷衍生物36 的合成路線
Avula等[46]通過微波輻射反應制備了一系列含膦酰基的噻唑螺吡唑衍生物,該系列化合物對蘑菇莖線蟲和秀麗隱桿線蟲表現出一定的活性。化合物37(圖17)對2種線蟲的LD50分別為219和220 μg/mL,稍弱于對照藥劑左旋咪唑(LD50分別為160和180 μg/mL)。
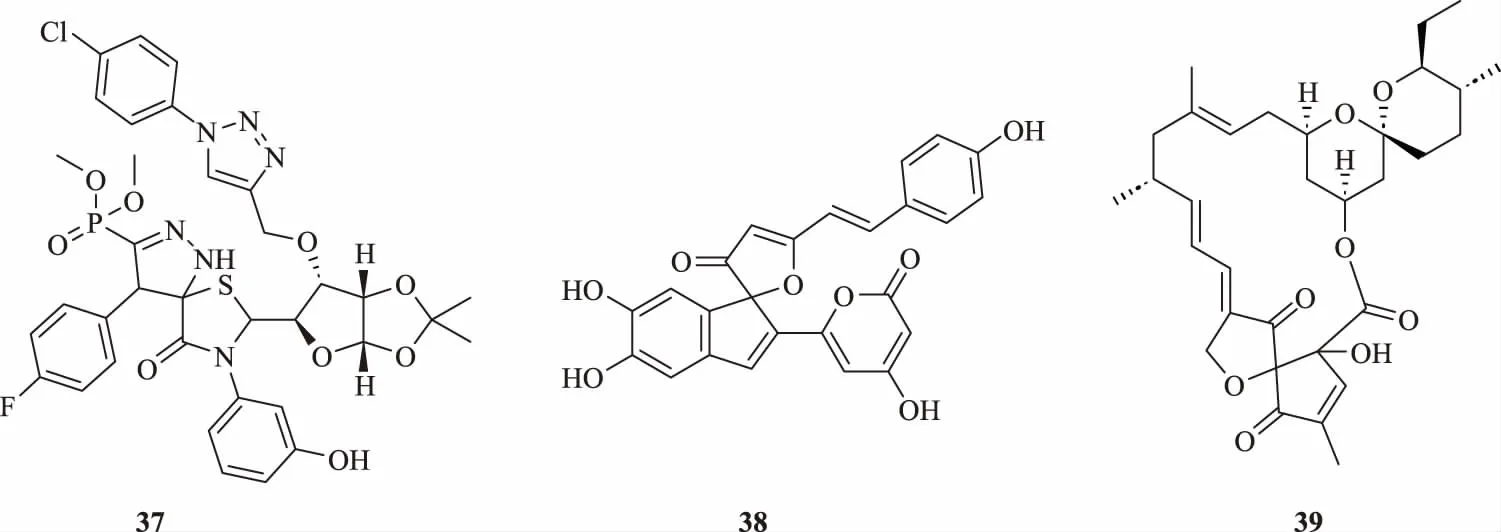
圖17 具有殺線蟲活性的化合物(37~39)
Chepkirui等[47]從肯尼亞的桑黃菌代謝物中提取的化合物38對秀麗隱桿線蟲表現出良好的活性,其LD50為12.5 μg/mL。
Hao等[48]發現冰城鏈霉菌(Streptomyces bingchenggensis)代謝物中分離出的Milbemycin R(化合物39)對朱砂葉螨(Tetranychus cinnabarinus)和松材線蟲(Bursaphelenchus xylophilus)具有良好的生物活性。
2 結論與展望
2.1 結論
目前,殺蟲劑的研究仍以拜耳公司的3款螺環季酮酸類殺蟲(螨)劑為主,對其進行一系列的結構衍生和優化,如最新登記上市的螺螨雙酯,結合了螺螨酯和螺蟲乙酯的結構特點,使其能在螨蟲各個生長周期都有較好的殺滅作用。從各研究機構的側重點可以看出,季酮酸結構在發揮螺環類的殺蟲活性上起著重要作用,保留該藥效團是螺環殺蟲劑發揮藥效的關鍵。螺環殺菌劑和抗病毒劑的研究百家爭鳴,無論是以天然產物灰黃霉素為先導優化,或從真菌代謝物中提取分離,亦或是根據構效團模型的合理藥物設計等,不同的團隊取得不同的階段性成果。螺環菌胺上市后市面上尚無第二款螺環殺菌劑,也未出現螺環抗病毒劑,螺環殺菌劑和抗病毒劑的研發仍然是填補市場空缺的研究熱點。目前,含有螺環結構的農藥數量不多,從綜述中的化合物結構可以看出,大多是含有氧、硫、氮原子的內酰胺類、內酯類、縮醛酮類和烯酮類化合物[49-50],基本沒有單純的烷烴螺環結構。從其他非螺環結構可以看出,這些元素本就是產生生物活性不可或缺的重要部位,但在螺環結構中,剛性較大的碳原子固定住了螺環整體結構,使具有生物活性的雜原子進入受體時仍能保持緊密的構型,與靶標位點牢固地結合。
2.2 展望
關于螺環作為潛在農藥分子構型的研究已取得一定的進展。在未來的研究中,必須在確保目標化合物具有綠色、高效、高選擇性、環境友好等特點前提下,構建一個以螺環化合物為基礎的先導化合物進行活性測試和結構優化;開發新方法、分子和生物標記物,以闡明相關的分子靶標與活性化合物的作用機理;迫切需要鑒定出靶標-配體復合物的X射線晶體結構,以使用現代藥物發現技術,如基于結構的藥物設計[51-54]、基于片段的藥物設計[55-58]等計算機輔助藥物設計手段,加速合理的農藥分子設計[59-61];研究出單一手性螺環終產物的綠色合成方法,將目前已看好的非手性軸類轉換成螺環結構的化合物,這不僅可以提高藥效,減緩抗藥性發展,降低對環境的影響,還可能因為結構的改變帶來意想不到的收獲。

