雞柔嫩艾美耳球蟲2種假定致密顆粒蛋白基因的克隆與表達
李天恩,周思含,孫洪超,付 媛,石團員,*,閆文朝
(1.河南科技大學 動物科技學院,河南 洛陽 471023; 2.浙江省農業科學院 畜牧獸醫研究所,浙江 杭州 310021)
雞球蟲病由專性寄生于宿主腸道上皮細胞內的艾美耳屬球蟲所引起[1]。每年因雞球蟲病造成的全球經濟損失超過144億美元,嚴重制約著養雞業健康發展[2]。在目前世界公認的7種雞球蟲中,柔嫩艾美耳球蟲(Eimeriatenella)的致病性最強,同時也是國內外各地雞群感染最普遍的優勢蟲種[3],其感染不受年齡段限制,主要寄生在盲腸上皮細胞,造成腸上皮細胞壞死,腸黏膜損傷,最常見的臨床癥狀是血便[4-7]。輕度感染時可對雞的生長發育、生產性能造成影響,重度感染可造成雞大批量死亡[8]。此外,柔嫩艾美耳球蟲感染后對宿主黏膜系統的嚴重破壞會降低機體的免疫力,導致其他病原感染可能性增加。研究發現,柔嫩艾美耳球蟲與J亞群禽白血病病毒雙重感染時,可導致雛雞更嚴重的腸道組織損傷和較高的死亡率[9]。然而,目前雞球蟲病傳統防控策略主要依賴藥物和弱毒活卵囊疫苗,隨著球蟲耐藥蟲株的頻發,以及公眾對雞肉、蛋產品藥物殘留問題的日益關注[10],抗球蟲藥物存在防治效果不佳和使用受限等實際問題[11],活卵囊疫苗也存在成本高、不易操作和潛在返強散毒等諸多弊端[12]。因此,養雞生產上亟需球蟲病新型疫苗。采用基因工程技術研制安全、有效的雞球蟲新型疫苗是一個很有吸引力的研究方向,其中,重組亞單位疫苗的表達系統較為成熟,該系統具有生產周期短、產量高和生產成本相對較低等優點,而篩選具有良好免疫保護效果的疫苗抗原蛋白,無疑是重組亞單位疫苗研制的關鍵[13]。
致密顆粒(dense granule, DG)是頂復合器門原蟲(包括球蟲、弓形蟲和新孢子蟲等)特有的一種分泌性亞細胞器,在透射電鏡下為單層膜包裹的球形致密小體,數量和大小隨種類和發育階段的不同存在差異[14]。早在上世紀的八九十年代,就有國內外學者在球蟲子孢子和裂殖子內觀察到DG的報道,E.tenella細胞內的DG數量大約為4個,且觀察到了DG向納蟲空泡(parasitophorous vacuole, PV)分泌蛋白的現象[15-16]。致密顆粒蛋白(GRAs)是一類由致密顆粒分泌的、具有重要生物學功能和免疫學應用價值的蛋白質,在弓形蟲(Toxoplasmagondii)上已得到深入研究。目前,已報道的弓形蟲GRAs有54種[17-19]。蛋白質序列和結構顯示,GRAs是一類分子量大小為20~60 ku,具有靶向信號肽和疏水性α螺旋結構的分泌性小分子蛋白[17]。按照其參與PV結構和功能不同,可大致分為3類:(1)納蟲空泡膜(PVM)結構和功能相關GRAs,包括GRA3、GRA5、GRA7、GRA8、GRA10、GRA14、GRA15、GRA19~24、GRA33、GRA35和GRA36[17,20-21],這類GRAs可形成伸入宿主細胞質內的細長突出,與PV結構穩定性、宿主逃避和營養物質交換功能密切相關;(2)泡內膜樣微管網絡(MNN)結構和功能相關GRAs,包括GRA2、GRA3、GRA4、GRA6、GRA9、GRA12和GRA14[17,20-21],這類GRAs存在于PVM上,與蟲體空間穩定、有序分裂和物質運輸功能密切相關;(3)非PV結構相關GRAs,這類GRAs包括位于PV腔內的可溶性GRA1和最終靶向宿主細胞核的GRA15、GRA16、GRA24,具有催化和宿主細胞應答調節功能[16]。另外,按照其免疫應答類型和應用價值來說,GRAs大體可分為2類:(1)能夠激發宿主Th1型/CD8+T細胞為主要免疫應答的GRAs,包括GRA1、GRA6、GRA7和GRA14等,因Th1型或CD8+T免疫應答是宿主清除細胞內原蟲的主要免疫機制,這類GRAs具有較高的疫苗研發價值[22]。據Scorza等[23]報道,GRA1蛋白免疫C3H小鼠后,能夠激發宿主高水平的CD8+T為主的特異性免疫應答,免疫小鼠攻蟲后的存活率可達75%~100%;另據Quan等[24]和Vazini等[25]報道,GRA7也能夠激發高水平的保護性免疫應答,免疫小鼠存活時間和存活率均顯著提高,弓形蟲腦組織包囊減少率可高達80%以上,GRA1和GRA7都是具有弓形蟲疫苗研發價值的候選抗原基因。(2)能夠激發宿主較高體液特異性免疫應答的GRAs,包括GRA2、GRA4、GRA7、GRA24和GRA41等;其中,GRA7不僅能夠激發宿主細胞免疫應答,也能夠激發宿主較高的體液免疫應答,能夠用于人、豬、雞和貓等動物的弓形蟲病診斷,GRAs在弓形蟲病診斷中也具有較高的應用價值[26-30]。
令人遺憾的是,盡管國內外對球蟲DG的報道較早,目前尚未有關于球蟲GRAs分子生物學和功能方面的確切研究報道。鑒于GRAs對球蟲胞內寄生、發育起重要作用,以及在球蟲新型疫苗研發中的潛在價值,本研究以E.tenella北京株為研究對象,通過對E.tenella基因組分析,發掘到2種假定致密顆粒蛋白基因hEtGRA12、hEtGRA9,進而通過基因擴增、質粒構建和原核表達獲得重組蛋白rhEtGRA12、rhEtGRA9,并鑒定了其抗原性,為球蟲致密顆粒蛋白基因功能和免疫應用深入研究奠定了基礎。
1 材料與方法
1.1 材料
柔嫩艾美耳球蟲北京株由中國農業大學寄生蟲實驗室饋贈并由本實驗室傳代保存。Trans1-T1、Transetta (DE3)感受態細胞、TransScript?One-Step RT-PCR SuperMix一步法RT-PCR試劑盒購自北京全式金生物技術股份有限公司,pET32a(+)表達載體為實驗室保存,pMD19-T克隆載體、dNTP、10×Buffer、rTaq酶、DNA marker、蛋白質分子量標準購自寶日醫生物技術(北京)有限公司,DNA瓊脂糖凝膠回收試劑盒、質粒小量提取試劑盒購自北京索萊寶科技有限公司,Trizol試劑購自賽默飛世爾科技(中國)有限公司,胰蛋白胨、酵母提取物、瓊脂粉和瓊脂糖購自OXOID公司。
1.2 球蟲假定致密顆粒蛋白基因序列篩選
目前尚未有關于球蟲致密顆粒蛋白基因的確切報道,本研究首先從NCBI基因庫下載目前已報道的頂復合器門原蟲(如剛地弓形蟲、犬新孢子蟲、豬囊等孢球蟲等)的GRAs基因序列,然后通過BLAST工具分別將其與NCBI中E.tenellaHoughton株基因組比對分析,篩選出11條與GRAs蛋白序列相似性較高的假定基因序列,進而利用Primer Primier 5.0軟件設計合成相應的引物(引物由杭州有康生物技術有限公司合成),引物序列見表1。根據推薦的反應程序進行逆轉錄PCR(RT-PCR)。

表1 克隆E. tenella假定致密顆粒蛋白基因序列所用引物Table 1 Primers for cloning dense granule protein hypothetical genes in E. tenella
1.3 RT-PCR
取新鮮的E.tenella孢子化卵囊5×107個,通過機械研磨、化學消化、G3漏斗過濾、水平離心等系列方法步驟提取子孢子;取感染E.tenella后第5天的雞盲腸,刮取腸黏膜依次通過酶消化、離心洗滌、紅細胞裂解、Percoll密度梯度離心等手段提取第2代裂殖子。利用Trizol試劑提取子孢子、裂殖子的總RNA,然后進行RT-PCR。擴增產物經1.5%瓊脂糖凝膠電泳鑒定,采用瓊脂糖凝膠回收試劑盒回收目的片段。將回收的目的片段與pMD19-T載體于16 ℃連接過夜,轉化至大腸埃希菌Trans1-T1感受態細胞。經含有氨芐抗性的LB固體培養基于37 ℃過夜培養,挑取單菌落培養并擴增,選擇擴增陽性菌液送杭州有康生物技術有限公司測序。
1.4 球蟲假定致密顆粒蛋白結構生物信息學分析
通過一系列生物信息學分析軟件對擴增獲得的疑似基因蛋白結構,包括基本理化性質(ProtParam tool在線軟件,https://web.expasy.org/protparam/)、信號肽(SignalP-5.0在線軟件,https://services.healthtech.dtu.dk/)、跨膜結構域(TMHMM-2.0在線軟件,https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)、二級結構(GOR4在線軟件,https://npsa-prabi.ibcp.fr/cgi-bin/secpred_gor4.pl)、抗原表位(Antigenic在線軟件,http://imed.med.ucm.es/Tools/antigenic.pl)和親疏水性(Protscale在線軟件,https://web.expasy.org/protscale/)等進行分析,并與已知的其他頂復合器門原蟲GRAs蛋白功能結構域保守性進行比對分析,以確定擴增到的基因序列是否為球蟲假定致密顆粒蛋白基因。
1.5 球蟲假定致密顆粒蛋白重組表達質粒的構建
將測序正確的pMD19T-hEtGRA克隆質粒和pET32a(+)表達載體經限制性內切酶雙酶切,酶切產物用瓊脂糖凝膠回收試劑盒回收。通過T4 DNA連接酶16 ℃連接過夜,構建出重組表達質粒pET32a(+)-hEtGRA,并轉化至大腸埃希菌Transetta (DE3)感受態細胞。經含有氨芐抗性的LB固體培養基37 ℃過夜培養。挑取單菌落培養,通過質粒小提試劑盒提取質粒,用PCR和雙酶切鑒定。
1.6 球蟲重組蛋白rhEtGRA表達、純化與Western blot分析
將鑒定陽性的pET32a(+)-hEtGRA重組表達菌按1∶100比例擴大培養至D600(600 nm處的吸光度)為0.6~0.8時,加入終濃度為1 mmol·L-1的IPTG,37 ℃、200 r·min-1誘導表達4 h。將誘導表達后的菌液于4 ℃ 10 000×g離心10 min,收集菌體棄去上清液。加入菌體10倍體積的裂解液將菌體充分懸浮,冰浴超聲破碎,將破碎液轉移至離心管,4 ℃,10 000×g離心10 min,取上清液(蛋白粗提物)待過柱。在純化柱中加入適量Ni-NTA純化介質并靜置15 min,再對Ni-NTA純化柱進行清洗、平衡。將蛋白粗提物加入Ni-NTA純化柱,使目的蛋白與Ni2+充分接觸,再經過洗雜、洗脫處理,即可得到純化的目的蛋白。以純化的目的蛋白為抗原進行SDS-PAGE,并轉印到NC膜上,進行Western blot分析。以雞抗柔嫩艾美耳球蟲陽性血清和雞陰性血清作為一抗,辣根過氧化物酶(HRP)標記的兔抗雞IgG作為二抗,對重組蛋白抗原的特異性進行鑒定。
1.7 鼠抗rhEtGRA多克隆抗體的制備與檢測
取6周齡SPF(無特定病原體)小鼠,將已測定濃度的rhEtGRA與弗氏完全佐劑或弗氏不完全佐劑1∶1混合后充分乳化,并采用頸部皮下多點注射的方式免疫小鼠。首免劑量為每只100 μg,二免、三免劑量均為每只50 μg,每次免疫間隔14 d。三免后第7天摘取眼球采血,采集的血液在37 ℃溫箱靜置1 h,再靜置于4 ℃冰箱過夜,第2天3 000×g離心5 min,分離血清并置于-80 ℃冰箱保存備用。使用間接ELISA方法檢測多克隆抗體效價,以rhEtGRA為抗原,以rhEtGRA免疫小鼠血清和陰性鼠血清為一抗,以HRP標記的羊抗鼠IgG為二抗,經過顯色后用H2SO4終止,最后在酶標儀中讀取450 nm處的吸光度D450。
2 結果與分析
2.1 球蟲假定致密顆粒蛋白基因hEtGRA12、hEtGRA9
通過RT-PCR擴增E.tenella子孢子、裂殖子總RNA,獲得特異性擴增條帶2條,分別命名為hEtGRA12基因(ETH_00023950)、hEtGRA9基因(ETH_00031740)。hEtGRA12條帶測序大小為1 188 bp(圖1-A),與E.tenellaHoughton株核苷酸序列一致性為99.92%,氨基酸序列一致性為100%,與T.gondiiME49株致密顆粒蛋白GRA12相似性為33.88%。hEtGRA9條帶測序大小為1 110 bp(圖1-B),與E.tenellaHoughton株核苷酸序列一致性為99.91%,氨基酸序列一致性為99.73%,與T.gondiiME49株致密顆粒蛋白GRA9相似性為27.5%。
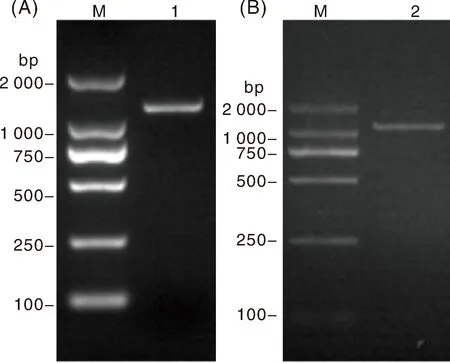
M,DNA marker;1,hEtGRA12基因片段;2,hEtGRA9基因片段。M, DNA maker; 1, hEtGRA12 gene fragment; 2, hEtGRA9 gene fragment.圖1 hEtGRA12、hEtGRA9基因的克隆Fig.1 Cloning of hEtGRA12 gene and hEtGRA9 gene
對hEtGRA12基因進行同源數據庫OrthoDB(https://www.expasy.org/resources/orthodb)分析,結果表明,頂復合器門GRA12蛋白在艾美耳屬和肉孢子蟲科均存在(圖2-A)。下載相應的基因和蛋白序列,采用MEGA 11軟件進行比對分析,并用NJ法構建系統發育樹,結果顯示,hEtGRA12蛋白氨基酸序列與剛地弓形蟲(T.gondii)、犬新孢子蟲(Neosporacaninum)、貝氏貝諾孢子蟲(Besnoitiabesnoiti)、豬囊等孢球蟲(Cystoisosporasuis)致密顆粒蛋白GRA12物種間相似性為28.8%~39.6%(圖2-B),hEtGRA12與剛地弓形蟲致密顆粒蛋白GRA12(TgGRA12)氨基酸序列間相似性最高,約為40%。系統發育樹表明,hEtGRA12種間與TgGRA12親緣關系最近(圖2-C)。利用EMBL-EBI中成對序列比對工具(https://wwwdev.ebi.ac.uk/Tools/jdispatcher/)對hEtGRA9蛋白進行相似性比對分析,結果表明hEtGRA9與TgGRA9、BbGRA9蛋白序列相似性分別為27.5%、29.5%(圖3)。
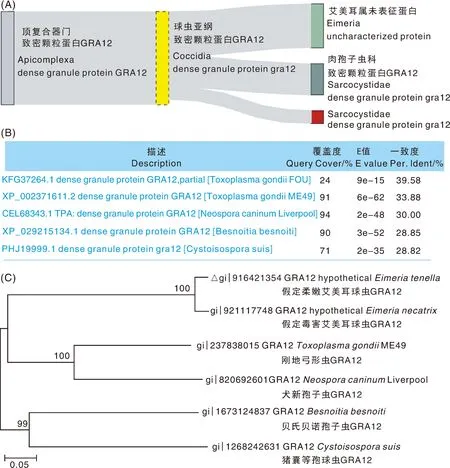
A,同源性分析;B,序列相似性分析;C,親緣關系分析,△表示hEtGRA12蛋白序列。A, Analysis of homolog; B, Analysis of sequence similarity; C, Analysis of kinship, △ represented sequence of hEtGRA12 protein.圖2 hEtGRA12蛋白同源性與系統發育分析Fig.2 Homology and phylogenetic analysis of hEtGRA12 protein

A,hEtGRA9與TgGRA9蛋白序列相似性分析;B,hEtGRA9與BbGRA9蛋白序列相似性分析。●,hEtGRA9蛋白序列;▲,TgGRA9蛋白序列;◆,BbGRA9蛋白序列。A, Sequence similarity analysis of hEtGRA9 and TgGRA9 protein; B, Sequence similarity analysis of hEtGRA9 and BbGRA9 protein. ●,Sequence of hEtGRA9 protein; ▲, Sequence of TgGRA9 protein; ◆, Sequence of BbGRA9 protein.圖3 hEtGRA9蛋白序列相似性分析Fig.3 Sequence similarity analysis of hEtGRA9 protein
2.2 hEtGRA12、hEtGRA9蛋白具有保守功能結構域
生物信息學軟件分析結果顯示,hEtGRA12蛋白含有395個氨基酸,其中酸性氨基酸(Asp+Glu)38個、堿性氨基酸(Arg+Lys)45個;分子式為C1977H3054N558O569S19,原子總數6 177;理論分子量、等電點分別為44.35 ku、9.03;親水指數為-0.237,屬于親水性蛋白;含有疏水性信號肽,位于1~24位氨基酸(圖4-A);無跨膜結構域(圖4-B);含有多個親水性較高的區域,其中較為典型的主要有108、147、234位氨基酸,均位于-3.0~-4.0的超強親水性區域(圖4-C);在該蛋白的395個氨基酸中,130個氨基酸可能形成α螺旋(32.91%),97個氨基酸形成延伸鏈(24.56%),168個氨基酸形成無規則卷曲(42.53%)(圖4-D);存在17個可能的抗原表位(圖4-E)。
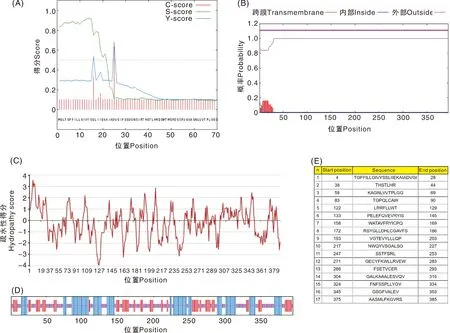
A,信號肽預測;B,跨膜區預測;C,親/疏水性分析;D,二級結構預測,藍色代表α螺旋,紫色代表無規則卷曲,紅色代表延伸鏈;E,抗原表位預測。圖5同。A, Prediction of signal peptide; B, Prediction of transmembrane region; C, Analysis of hydrophilic/hydrophobic; D, Prediction of secondary structure, blue represented α-helix, purple represented random coi, red represented extended strand; E, Prediction of antigen epitope. The same as in figure 5.圖4 hEtGRA12蛋白的生物信息學分析Fig.4 Bioinformatics analysis of EtGRA12 protein
生物信息學軟件分析結果顯示,hEtGRA9蛋白含有369個氨基酸,其中酸性氨基酸(Asp+Glu)60個、堿性氨基酸(Arg+Lys)46個;分子式為C1713H2719N533O560S7,原子總數5 532;理論分子量、等電點分別為39.97 ku、5.16;親水指數為-0.856,屬于親水性蛋白;含有疏水性信號肽,位于1~25位氨基酸(圖5-A);無跨膜結構域(圖5-B);含有多個親水性較高的區域,其中較為典型的主要有119、230、307、363位氨基酸,均位于-3.0~-4.0的超強親水性區域(圖5-C);在該蛋白的369個氨基酸中,187個氨基酸可能形成α螺旋(50.68%),18個氨基酸形成延伸鏈(4.88%),164個氨基酸形成無規則卷曲(44.44%)(圖5-D);存在9個可能的抗原表位(圖5-E)。

圖5 hEtGRA9蛋白的生物信息學分析Fig.5 Bioinformatics analysis of hEtGRA9 protein
hEtGRA12、hEtGRA9均有信號肽、α螺旋,超強親水性區域,均屬于親水性蛋白,對TgGRA12、TgGRA9蛋白結構進行分析,發現也同樣具有信號肽、在二級結構上也均只有α螺旋、延伸鏈和無規則卷曲3種結構模式組成(圖6),且同屬于親水性蛋白,提示hEtGRA12、hEtGRA9在蛋白功能結構域上與TgGRA12、TgGRA9具有一定的保守性。

綠色,信號肽;藍色,α螺旋;紫色,無規則卷曲;紅色,延伸鏈。Green, Signal peptide; Blue, α-Helix; Purple, Random coil; Red, Extended strand.圖6 蛋白功能結構域保守性分析Fig.6 Conservative analysis of protein functional domain
2.3 hEtGRA12、hEtGRA9基因的原核表達
將pMD19T-hEtGRA12質粒和pET32a(+)表達載體用BamHⅠ和HindⅢ雙酶切,用T4 DNA連接酶連接,構建出重組表達質粒pET32a(+)-hEtGRA12,經BamHⅠ和HindⅢ雙酶切鑒定有目的基因片段(圖7-A),表明原核表達質粒構建成功。pET32a-hEtGRA12重組表達菌經IPTG誘導表達后,用超聲破碎儀破碎,離心后分別取上清液和沉淀進行SDS-PAGE鑒定,結果顯示,獲得了63.6 ku的目的重組蛋白rhEtGRA12(圖7-B)。

A,pET32a(+)-hEtGRA12質粒雙酶切鑒定;B,hEtGRA12蛋白的表達純化;C,pET32a(+)-hEtGRA9質粒雙酶切鑒定;D,hEtGRA9蛋白的表達純化。M1,DNA marker;M2,蛋白分子量標準;1,pET32a(+)-hEtGRA12質粒;2,pET32a(+)-hEtGRA12質粒雙酶切產物;3,未純化的hEtGRA12蛋白;4~5,純化的hEtGRA12蛋白;6,pET32a(+)-hEtGRA9質粒;7,pET32a(+)-hEtGRA9質粒雙酶切產物;8,未純化的hEtGRA9蛋白;9,純化的hEtGRA9蛋白。A, Identification of pET32a (+)-hEtGRA12 plasmid by double enzyme digestion; B, Expression and purification of hEtGRA12 protein; C, Identification of pET32a (+)-hEtGRA9 plasmid by double enzyme digestion; D, Expression and purification of hEtGRA9 protein; M1, DNA maker; M2, Protein maker; 1, pET32a (+)-hEtGRA12 plasmid; 2, Digestion product of pET32a(+)-hEtGRA12 plasmid; 3, Unpurified hEtGRA12 protein; 4-5, Purified hEtGRA12 protein; 6, pET32a(+)-hEtGRA9 plasmid; 7, Digestion product of pET32a(+)-hEtGRA9 plasmid; 8, Unpurified hEtGRA9 protein; 9, Purified hEtGRA9 protein.圖7 hEtGRA12、hEtGRA9基因的重組表達Fig.7 Recombinant expression of hEtGRA12 and hEtGRA9 genes
使用同樣的方法和相對應的內切酶構建hEtGRA9基因重組表達質粒,并進行蛋白的表達純化。結果顯示,成功構建了重組表達質粒pET32a(+)-hEtGRA9(圖7-C),獲得了約67.00 ku的重組蛋白,與理論蛋白分子量59.46 ku存在差異,推測重組蛋白rhEtGRA9存在翻譯后修飾(圖7-D)。
2.4 rhEtGRA12、rhEtGRA9重組蛋白的抗原性
Western blot結果表明,重組蛋白rhEtGRA12、rhEtGRA9能夠被雞抗柔嫩艾美耳球蟲陽性血清識別,表明具有較好的反應原性(圖8-A、8-B)。
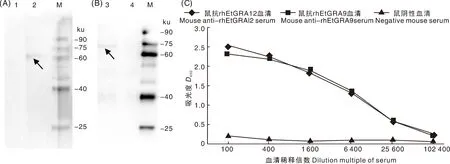
A,重組蛋白rhEtGRA12 Western blot分析;B,重組蛋白rhEtGRA9 Western blot分析;M,蛋白質分子量標準;1、4,陰性雞血清;2、3,抗柔嫩艾美耳球蟲陽性雞血清;C,鼠抗rhEtGRA12、鼠抗rhEtGRA9多克隆抗體效價檢測。A, Western blot analysis of recombinant protein rhEtGRA12; B, Western blot analysis of recombinant protein rhEtGRA9; M, Protein marker; 1 and 4, Negative chicken serum; 2 and 3, Anti-Eimeria tenella positive chicken serum; C, Detection of mouse anti-rhEtGRA12 and mouse anti-rhEtGRA9 polyclonal antibody titers.圖8 rhEtGRA12、rhEtGRA9抗原性分析Fig.8 Antigenicity analysis of rhEtGRA12 and rhEtGRA9
以獲得的多抗和鼠陰性血清為一抗,以HRP標記的羊抗鼠IgG為二抗,再經過顯色、終止反應,最后在酶標儀中讀取D450。取4個鼠抗rhEtGRA12、鼠抗rhEtGRA9血清和2個鼠陰性血清的平均值作圖,結果表明,小鼠體內均產生了高水平的抗體(圖8-C),抗體效價為1∶102 400,表明rhEtGRA12、rhEtGRA9重組蛋白具有較好的免疫原性。
3 討論
致密顆粒蛋白是頂復合器門原蟲特有的亞細胞器致密顆粒分泌的重要功能蛋白,具有較高的免疫學應用價值,然而目前尚未有關于球蟲致密顆粒蛋白的確切報道,僅有些許假定致密顆粒蛋白的報道。本研究通過序列相似性比對和功能結構域保守性分析從E.tenella北京株發掘并成功克隆了2個雞球蟲假定致密顆粒蛋白基因hEtGRA12、hEtGRA9;序列相似性比對結果顯示,hEtGRA12、hEtGRA9與Houghton株對應的基因編碼的氨基酸序列一致性分別為100%、99.73%,而與頂復合器門其他原蟲致密顆粒蛋白GRA12、GRA9物種間相似性分別為28.8%~39.6%、27.5%~29.5%,表明hEtGRA12、hEtGRA9基因在種內具有高度保守性,在種間具有不同程度差異性,提示球蟲中的致密顆粒蛋白除了具有頂復合器門原蟲共性的功能外,還可能具有獨特的種內功能。弓形蟲致密顆粒蛋白之間或與已知功能的蛋白之間沒有顯著相似性,也沒有共同的保守結構域,但基于它們在致密顆粒內獨特的共定位被定義為GRA蛋白家族,但大多數均包含一個與它們分泌情況相關的N端疏水信號肽和α螺旋[17]。本研究中hEtGRA12、hEtGRA9蛋白均含有疏水信號肽,且α螺旋結構占比很高,對TgGRA12、TgGRA9蛋白結構進行分析,發現也同樣具有信號肽,在二級結構上也均只有α螺旋、延伸鏈和無規則卷曲3種結構模式組成,且同屬于親水性蛋白,提示hEtGRA12、hEtGRA9在蛋白功能結構域上與TgGRA12、TgGRA9具有一定的保守性,進而提示hEtGRA12、hEtGRA9可能為雞球蟲真正的致密顆粒蛋白。
蛋白質二級結構中的無規則卷曲指不能被歸入明確的二級結構如折疊片或螺旋的多肽區段,因其肽鏈沒有一定規律且易變形,大多位于蛋白分子表面,因此利于與抗體結合,同時也是潛在的抗原表位。hEtGRA12、hEtGRA9蛋白序列無規則卷曲結構將近占全部結構的一半,表明它們具有很好的潛在抗原表位。氨基酸殘基因其親/疏水性可分為親水性氨基酸和疏水性氨基酸,疏水性氨基酸殘基位于蛋白質內部,主要構成了蛋白質折疊的主要動力[31]。親水性氨基酸殘基位于蛋白質表面,連續的高親水氨基酸殘基通常構成一側線性抗原表位,因此它也是判斷B細胞抗原表位的常用參數[32]。hEtGRA12、hEtGRA9蛋白均具有多個超強親水性區域,可構成一側線性抗原表位。通過抗原決定簇預測網站預測到hEtGRA12、hEtGRA9分別有17、9個潛在的抗原決定簇,進一步說明hEtGRA12、hEtGRA9蛋白可能具有很好的免疫原性,具有成為候選抗原分子的潛力。蛋白異源表達是通過分子生物學技術將外源基因克隆到人工載體上,構建出異源表達體系,從而獲得特定蛋白的一種方法。大腸埃希菌具有遺傳背景清楚、易培養、廉價、繁殖速度快、蛋白高表達等優點,已成為很多異源蛋白表達的首選[33]。本研究通過大腸埃希菌原核表達系統獲得的重組蛋白rEtGRA12、rhEtGRA9,rEtGRA12、rhEtGRA9可與雞抗E.tenella陽性血清發生特異性反應,表明重組蛋白rEtGRA12、rhEtGRA9均具有較好的反應原性。本研究還利用純化的蛋白免疫小鼠制備多抗,檢測小鼠血清中抗rEtGRA12、rhEtGRA9抗體水平,結果表明,可以誘導小鼠產生較高的抗體水平,再次驗證了這2種重組蛋白具有較好的免疫原性和反應原性,具有成為抗雞球蟲病優秀疫苗抗原分子的潛力。
雖然NCBI已公布了柔嫩艾美耳球蟲假定致密顆粒蛋白基因EtGRA9(ETH_00028350),但是已有研究證明該基因并不是真正的致密顆粒蛋白基因。Hu等[34]利用CRISPR/Cas9介導的柔嫩艾美耳球蟲分泌蛋白的基因標記法對假定的EtGRA9基因進行研究,結果在囊泡中發現了EtGRA9的標記信號,而未在致密顆粒中發現,表明EtGRA9是一種分泌蛋白,可以幫助柔嫩艾美耳球蟲子孢子從孢子囊中釋放,并可能在子孢子和裂殖子入侵過程中發揮重要作用,并非真正的球蟲致密顆粒蛋白。本研究根據序列相似性和保守的功能結構重新假定了一種EtGRA9基因(ETH_00031740),并命名為hEtGRA9。本研究中hEtGRA12基因(ETH_00023950)目前已有了相關研究報道,Mu等[35]構建了基因ETH_00023950的真核表達質粒并轉染到雞肝癌(LMH)細胞,然后對轉染后的LMH細胞進行轉錄組測序,結果表明,該基因改變了LMH細胞2 680個基因的表達,說明該基因具有很高的研究價值。雖然hEtGRA12基因已經被初步研究過,但其克隆到的序列與Houghton株相比,存在堿基差異,并由此導致提前終止翻譯。本研究克隆到的基因其蛋白序列與Houghton株相比一致性100%,在功能上可能會與Mu等[35]的研究有所差異,所以很有必要進一步研究該基因的相關生物學特性。
本研究利用分子克隆手段獲得了E.tenella北京株hEtGRA12、hEtGRA9基因編碼區的全長序列,并通過生物信息學相關技術和方法對hEtGRA12、hEtGRA9蛋白進行了分析,獲得了重組蛋白rhEtGRA12、rhEtGRA9并鑒定了其抗原性。這兩種重組蛋白具有很好的抗原性,后續研究擬對其定位和免疫效果進行評估。本研究在一定程度上為球蟲致密顆粒蛋白基因功能和免疫應用深入研究奠定了基礎。

